قرن آمون
الحصين (كلمة لاتينية مشتقة من الكلمة اليونانية ἱππόκαμπος، أي «فرس البحر») (بالإنجليزية: Hippocampus) هو أحد المكونات الرئيسية لدماغ الإنسان وغيره من الفقاريات. يمتلك الإنسان والثدييات الأخرى حصينًا في كل جانب من جانبي الدماغ. يشكل الحصين جزءًا من الجهاز النطاقي، ويلعب العديد من الأدوار الهامة في استحصاف المعلومات من الذاكرة قصيرة الأمد إلى الذاكرة طويلة الأمد، وفي الذاكرة المكانية المسؤولة عن التنقل. يقع الحصين لدى الإنسان[1][2][3] وغيره من الرئيسيات في القشرة العريقة،[4] مع إسقاطات عصبية إلى داخل القشرة الجديدة. يُعد الحصين بنية موجودة لدى جميع الفقاريات، باعتباره القشرة المخية الأنسية.[5] يحتوي الحصين في دماغ الإنسان على جزأين رئيسيين متكاملين: الحصين المخصوص (الذي يُسمى أيضًا قرن آمون)[6] والتلفيف المسنن.
| قرن آمون | |
|---|---|
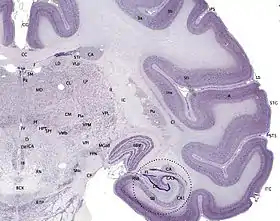
 يقع قرن آمون في الفص الصدغي الوسطي للدماغ. في هذه النظرة الجانبية للدماغ يظهر الفص الجبهي إلى اليسار وفص مؤخر الرأس إلى اليمين بينما الفصان الجداري والصدغي تم إزالتهما بشكل كبير لإظهار مكان قرن آمون في الأسفل مباشرة. | |
 قرن آمون (البصلة الوردية السفلى) كجزء من الجهاز الطرفي قرن آمون (البصلة الوردية السفلى) كجزء من الجهاز الطرفي | |
| تفاصيل | |
| جزء من | فص صدغي |
| ترمينولوجيا أناتوميكا | 14.1.09.321 |
| FMA | 275020 |
| معلومات عصبية | braininfo |
| نيوروليكس | Hippocampus |
| ن.ف.م.ط. | |
| ن.ف.م.ط. | D006624 |
| دورلاند/إلزيفير | 12422843 |


يُعد الحصين إحدى مناطق الدماغ الأولى المعرضة للتلف في مرض آلزهايمر (وغيره من أشكال الخرف)؛[7] إذ تشمل الأعراض المبكرة كلًا من فقدان الذاكرة قصيرة الأمد والتوهان. قد ينجم تلف الحصين أيضًا عن مجاعة الأكسجين (نقص التأكسج)، أو التهاب الدماغ أو صرع الفص الصدغي الأنسي. قد يعاني الأفراد المصابون بتلف ثنائي الجانب واسع النطاق في الحصين من فقد الذاكرة التقدمي: انعدام القدرة على تكوين الذكريات الجديدة والاحتفاظ بها.
استُخدم الحصين بشكل متكرر كنظام نموذجي لدراسة الفيزيولوجيا العصبية، نظرًا إلى احتوائه على العديد من أنواع الخلايا العصبونية المختلفة والمنظمة بدقة داخل طبقاته. اكتُشف أحد أشكال اللدونة العصبية، الذي يُدعى التأييد طويل الأمد (إل تي بّي)، لأول مرة في الحصين، وغالبًا ما ركزت دراسات «إل تي بّي» على بنية الحصين. يمثل التأييد طويل الأمد، كما يُعتقد على نحو واسع، أحد الآليات العصبية الرئيسية التي يستخدمها الدماغ من أجل تخزين الذكريات.
ركزت العديد من الدراسات، التي استخدمت القوارض كنماذج حية، على الحصين بوصفه جزءًا من نظام الدماغ المسؤول عن الذاكرة المكانية والتنقل. تظهر العديد من عصبونات الحصين لدى الجرذان والفئران استجابات مماثلة لاستجابة خلايا المكان: تطلق هذه العصبونات دفعات من جهود الفعل عند مرور الحيوان عبر جزء محدد من بيئته. تتفاعل خلايا المكان الحصينية على نحو واسع مع خلايا توجيه الرأس، التي يشبه نشاطها عمل البوصلة بالقصور الذاتي، وتخمينيًا مع خلايا الشبكة في القشرة الشمية الداخلية المجاورة.
الاسم

يأتي أقرب وصف لسلسلة النتوء على طول أرضية القرن الخلفي (القذالي) للبطين الجانبي من طبيب التشريح الفينيسي يوليوس قيصر أرانزي (1587)، الذي شبهها أولاً بدودة الحرير ومن ثم بفرس البحر (باللاتينية: hippocampus من اليونانية: ἵππος، "الحصان" و "seaος ،" وحش البحر "). كما أن عالم التشريح الألماني دوفرنوي (1729)، وهو أول من شرح هذا الجزء، كان يتردد أيضًا بين "فرس البحر" و "دودة الحرير". اقترح عالم التشريح الدنماركي يعقوب وينسلو "قرن الكبش" في عام 1732؛ وبعد ذلك بعقد من الزمان، استخدم زميله الباريسي، الجراح دي غارينغوت، (cornu Ammonis) - قرن (الإله المصري القديم) آمون،[9] الذي كان يُمثَّل في الغالب برأس كبش.[10] وقد استمر استخدام هذا المصطلح على شكل اختصار CA في تسمية الحقول الفرعية للحصين. ظهرت إشارة أخرى مع مصطلح pes hippocampi (قَدَمُ الحُصَين)، الذي قد يعود تاريخه إلى ديميربروك في عام 1672، مقدمًا مقارنة مع شكل الأطراف الأمامية المطوية للخلف والأقدام الوتراء لحصان البحر هيبوكمبوس، وهو وحش بحري يمتلك أطراف الحصان الأربعة وذيل سمكة. ثم يوصف قرن آمون على أنه قدم الحصين الكبيرة، مع انتفاخ مجاور في القرن القذالي، الذي يوصف بأنه قدم الحصين الصغيرة ثم أعيد تسميته فيما بعد باسم مِهْمازُ الطَّير.[9][11] يعزى إعادة تسمية الحصين بقدم الحصين الكبيرة، وقدم الحصين الصغيرة بمهماز الطير، إلى نظام التسمية الخاص بفيليكس فيك-دازير لأجزاء الدماغ في 1786. استخدم ماير عن طريق الخطأ مصطلح فرس النهر في 1779، وتبعه بعض الكتاب الآخرين حتى حل كارل فريدريش بورداتش هذا الخطأ في عام 1829. في عام 1861، أصبح الحصين الصغير مركزًا للنزاع حول تطور الإنسان بين توماس هنري هكسلي وريتشارد أوين، والتي عرفت بشكلٍ ساخر بقضية الحصين العظيم. انخفض قل استخدام مصطلح الحصين الصغير في الكتب التشريح الدراسية، وأزيل رسميًا من نومينا أناتوميكا من عام 1895.[12] اليوم، يطلق على هذا الجزء من الدماغ اسم الحصين فقط،[9] مع مصطلح "قرن آمون" الذي لا يزال يستخدم في أسماء الحقول الفرعية للحصين CA1–CA4؛[13]
تم إدخال مصطلح الجهاز الحوفي في عام 1952 من قبل بول ماكلين [14] لوصف مجموعة الهياكل التي تبطن حافة القشرة: يشمل هذالجهاز الحصين، القشرة الحزامية، نظام الشم، واللوزة. اقترح بول ماكلين لاحقًا أن الهياكل الحوفية تشكل الأساس العصبي للعاطفة. يرتبط الحصين تشريحيًا بأجزاء من الدماغ مؤثرة في السلوك العاطفي - النوى الحاجزية، والجسم الحلمي تحت المهاد، ونوى المهاد الأمامية، ويُقبل عمومًا كجزء من الجهاز الحوفي.[15]
التشريح

أقسام الجهاز العصبي المركزي
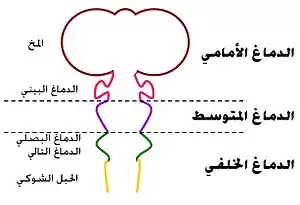
| جهاز عصبي مركزي | دماغ | دماغ أمامي | الدماغ الانتهائي (المخ) |
دماغ شمي Rhinencephalon، أميغدالا = لوزة عصبية Amygdala، حصين، قشرة جديدة، بطينات جانبية |
|
| دماغ بيني |
مهيد Epithalamus، مهاد ، الوطاء أو تحت المهاد , مهاد تحتاني Subthalamus، غدة نخامية ، غدة صنوبرية ، البطين الثالث |
||||
| دماغ متوسط |
سقف (تشرح عصبي) Tectum، سويقة مخية Cerebral peduncle، برتيكتوم Pretectum، المسال الدماغي |
||||
| دماغ خلفي | دماغ تالي | المخيخ، الجسر | |||
| دماغ بصلي | النخاع المستطيل | ||||
| نخاع شوكي | |||||
الاضطرابات
الشيخوخة
تمتلك الحالات المتعلقة بالعمر مثل مرض آلزهايمر وغيره من أشكال الخرف (التي تتميز بحدوث اضطراب الحصين كإحدى العلامات المبكرة[6]) تأثيرًا شديدًا على أشكال المعرفة المختلفة بما في ذلك الذاكرة. ترتبط الشيخوخة الطبيعية مع التدهور التدريجي في بعض أنواع الذاكرة، بما في ذلك الذاكرة العرضية والذاكرة العاملة (أو الذاكرة قصيرة الأمد). أُحيل اهتمام ملحوظ لاحتمال حدوث التدهور المرتبط بالعمر كنتيجة لتدهور الحصين، نظرًا إلى اعتبار الحصين إحدى البنى المركزية للذاكرة.[6] أفادت بعض الدراسات المبكرة بفقدان كبير للعصبونات في الحصين لدى المسنين، لكن لم تجد الدراسات اللاحقة التي استخدمت تقنيات أكثر دقة أي فروقات معتبرة.[6] بالمثل، أبلغت بعض دراسات «إم آر آي» عن تقلص في الحصين لدى المسنين، لكن فشلت دراسات أخرى في إيجاد نتائج مشابهة. مع ذلك، توجد علاقة وثيقة بين حجم الحصين وأداء الذاكرة؛ إذ يتعطل أداء الذاكرة عند وجود تقلص مرتبط بالعمر.[6] أظهرت بعض التقارير أيضًا أن مهام الذاكرة غير قادرة على إنتاج نشاط كبير في الحصين لدى المسنين مقارنة باليافعين.[6] علاوة على ذلك، وجدت تجربة منضبطة معشاة منشورة في عام 2011 قدرة التمارين الهوائية على زيادة حجم الحصين لدى البالغين ممن تتراوح أعمارهم بين 55 و88 عام، إلى جانب تحسين الذاكرة المكانية.[6]
الإجهاد
يحتوي الحصين على مستويات عالية من مستقبلات الهرمون القشري السكري، ما يجعله أكثر عرضة للإجهاد طويل الأمد مقارنة بمناطق الدماغ الأخرى.[6] تشير بعض الدلائل إلى حدوث ضمور أكبر في الحصين مقارنة بمناطق الدماغ الأخرى لدى الأشخاص الذين عانوا من إجهاد طويل الأمد ناتج عن الصدمة.[6] تظهر مثل هذه التأثيرات في اضطراب الكرب التالي للصدمة،[16] وقد تساهم في ضمور الحصين المبلغ عنه لدى مرضى الفصام والاكتئاب الشديد.[17][18] يرتبط حجم الحصين الأمامي لدى الأطفال إيجابًا مع الدخل الأسري، إذ يُعتقد أن هذا الارتباط عائد إلى الإجهاد المتعلق بالدخل.[19] وجدت دراسة حديثة أيضًا حدوث الضمور كنتيجة للاكتئاب، لكن أمكن إيقافه باستخدام مضادات الاكتئاب حتى في حالة عدم فعاليتها في تخفيف الأعراض الأخرى.[6]
يُعتبر الإجهاد المزمن الناتج عن ارتفاع مستويات الهرمونات القشرية السكرية، وخاصة الكورتيزول، سببًا للضمور العصبوني في الحصين. يؤدي هذا الضمور إلى نقص حجم الحصين الملاحظ أيضًا في متلازمة كوشينغ. تنتج مستويات الكورتيزول المرتفعة عادة في متلازمة كوشينغ عن الأدوية الموصوفة للمريض لعلاج الحالات الأخرى.[20][21] تحدث الخسارة العصبونية أيضًا نتيجة لخلل تخلق النسيج العصبي. يُعد الانكماش التغصني أحد العوامل الأخرى المساهمة في صغر حجم الحصين، إذ يتناقص طول التغصنات ويقل عددها استجابة لارتفاع مستويات الهرمونات القشرية السكرية. يُعد هذا الانكماش التغصني قابلًا للعكس. يمكن استعادة حجم الحصين بنسبة تصل إلى 10% بعد العلاج الدوائي لتقليل مستوى الكورتيزول في متلازمة كوشينغ.[20] يُعتبر هذا التغيير ناجمًا عن إعادة تشكيل التغصنات.[21] يمكن حدوث استعادة التغصنات أيضًا عند زوال الإجهاد. مع ذلك، تفيد إحدى الدلائل المستندة بشكل رئيسي إلى الدراسات على الفئران بأن الإجهاد الناشئ بعد فترة قصيرة من الولادة من شأنه التأثير على وظيفة الحصين بشكل مستمر مدى الحياة.[6]
ثبت أيضًا أن استجابات الإجهاد المتعلقة بالجنس قادرة على التأثير في الحصين. أظهر الإجهاد المزمن لدى الفئران الذكور حدوث انكماش تغصني وفقدان خلايا في المنطقة «سي إيه 3»، مع عدم ظهور هذه النتائج لدى الإناث. يُعتقد أن هذا عائد إلى الهرمونات المبيضية المحصنة العصبية.[22][23] يرتفع مستوى تلف الدنا في الحصين لدى الفئران في ظل حالة الإجهاد.[24]
الصرع
يُعتبر الحصين إحدى مناطق الدماغ القليلة المسؤولة عن توليد العصبونات الجديدة. تقتصر عملية تخلق النسيج العصبي هذه على التلفيف المسنن.[6] قد يتأثر إنتاج العصبونات الجديدة إيجابيًا بالتمارين الرياضية أو سلبيًا بالنوبات الصرعية.[6]
قد تؤثر نوبات صرع الفص الصدغي على التطور الطبيعي للعصبونات الجديدة، وقد تسبب التلف النسيجي. يمثل التصلب الحصيني النوع الأكثر شيوعًا من هذا التلف النسيجي.[6] على الرغم من ذلك، من غير الواضح ما إذا كان الصرع عائدًا إلى شذوذات الحصين أم كان تلف الحصين ناجمًا عن تأثيرات النوبات التراكمية.[6] مع ذلك، حدث تلف الحصين بشكل متكرر في البيئات التجريبية عند إثارة نوبات متكررة بشكل صنعي على الحيوانات. قد ينجم هذا عن تركيز مستقبلات الغلوتامات القابلة للاستثارة في الحصين. قد يؤدي فرط الاستثارية إلى سمية الخلايا والموت الخلوي.[21] قد يتعلق هذا أيضًا بكون الحصين موقعًا لتشكل العصبونات المستمر طوال الحياة،[6] وبالشذوذات المؤثرة على هذه العملية.[21]
الفصام
ما تزال مسببات الفصام غير مفهومة بشكل جيد، لكن أبلغت الدراسات عن عدد من الشذوذات الملاحظة في بنية الدماغ. تقع أكثر التغيرات التي خضعت للدراسة الدقيقة في القشرة المخية، لكن وُصفت أيضًا بعض التأثيرات الملاحظة على الحصين.[6][25] وجدت العديد من التقارير تقلصًا في حجم الحصين لدى الأشخاص المصابين بالفصام. تأثر الحصين الأيمن بشكل كبير مقارنة بالأيسر.[6] يوجد إجماع إلى حد كبير على حدوث هذه التغيرات الملاحظة كنتيجة للتطور غير الطبيعي. ما يزال دور تغيرات الحصين في حدوث الأعراض الذهانية المميزة للفصام غير واضح. يؤدي الخلل الوظيفي في الحصين، وفقًا لإحدى المقترحات بالاستناد إلى عمل تجريبي على الحيوانات، إلى حدوث تعديل على تحرير الدوبامين في العقد القاعدية، ما يؤثر بشكل غير مباشر على تكامل المعلومات في قشرة فص الجبهة.[6] اقتُرح أيضًا حدوث اضطرابات الذاكرة طويلة الأمد التي تُلاحظ بشكل متكرر كنتيجة للخلل الوظيفي في الحصين.[6]
أظهرت الدراسات باستخدام «إم آر آي» انخفاضًا في حجم الدماغ وزيادة في حجم البطينات لدى الأشخاص المصابين بالفصام – مع ذلك، من غير الواضح ما إذا كان هذا التقلص عائدًا إلى الفصام أم إلى الأدوية.[26][27] ثبت حدوث انخفاض في حجم كل من الحصين والمهاد؛ مع زيادة في حجم الكرة الشاحبة. لُوحظ تغير في الأنماط القشرية، بالإضافة إلى انخفاض حجم القشرة المخية وسماكتها في الفصين الصدغي والجبهي. اقتُرح أيضًا ظهور العديد من التغيرات الملاحظة في بداية الاضطراب، ما يدعم نظرية حدوث التطور العصبي غير الطبيعي.[28]
يُعتبر الحصين عنصرًا مركزيًا في علم أمراض الفصام، بما في ذلك التأثيرات العصبية والفيزيولوجية على حد سواء. من المقبول عمومًا وجود اتصال مشبكي شاذ كامن في حالة الفصام. تشير دلائل عديدة إلى حدوث تغيرات في التنظيم والاتصال المشبكيين في ومن الحصين. وجدت العديد من الدراسات خللًا وظيفيًا في الدوائر المشبكية داخل الحصين إلى جانب نشاطها في قشرة فص الجبهة. لُوحظ أيضًا تأثر مسارات الغلوتامات بشكل كبير. وُجد أن مشاركة الحقل الفرعي «سي إيه 1» قليلة مقارنة بالحقول الفرعية الأخرى، ووُجد أيضًا أن «سي إيه 4» والمرفد المنطقتان الأكثر مشاركة. خلصت المراجعة إلى أن الإمراضية عائدة إلى الوراثيات، أو التطور العصبي المعيب أو اللدونة العصبية الشاذة. خلصت أيضًا إلى أن حدوث الفصام غير مرتبط بأي اضطراب تحلل عصبي معروف. يرتفع مستوى تلف الدنا المؤكسد بشكل ملحوظ في الحصين لدى المرضى المسنين المصابين بالفصام المزمن.[29][6]
قراءة إضافية
صحف
- Hippocampus (Wiley)
كتب
- The Hippocampus Book، مطبعة جامعة أكسفورد، 2007، ISBN 978-0-19-510027-3.
- Space,Time and Memory in the Hippocampal Formation، سبرنجر، 2014، ISBN 978-3-7091-1292-2.
- Henri M. Duvernoy, F. Cattin (2005)، The Human Hippocampus: Functional Anatomy, Vascularization, and Serial Sections with MRI، Springer، ISBN 978-3-540-23191-2.
- Howard Eichenbaum (2002)، The Cognitive Neuroscience of Memory، Oxford University Press US، ISBN 978-0-19-514175-7.
- edited by Patricia E. Sharp. (2002)، The Neural Basis of Navigation: Evidence from Single Cell Recording، Springer، ISBN 978-0-7923-7579-1.
{{استشهاد بكتاب}}:|مؤلف=has generic name (مساعدة) - Philippe Taupin (2007)، The Hippocampus: Neurotransmission and Plasticity in the Nervous System، Nova Publishers، ISBN 978-1-60021-914-6.
- John H Byrne, المحرر (2008)، Learning and Memory: A comprehensive reference، Elsevier، ISBN 978-0-12-370509-9.
روابط خارجية
- صور لشريحة دماغية مصبوغة تُشمل "hippocampus" على مشروع برين مابز [الإنجليزية]
- Diagram of a Hippocampal Brain Slice
- Hippocampus – Cell Centered Database
- Temporal-lobe.com An interactive diagram of the rat parahippocampal-hippocampal region
- Search Hippocampus on BrainNavigator via BrainNavigator
- Gyorgy Buzsaki (2010) Hippocampus. Scholarpedia. 6(1):1468.
مراجع
- Martin, JH (2003)، "Lymbic system and cerebral circuits for emotions, learning, and memory"، Neuroanatomy: text and atlas (ط. third)، McGraw-Hill Companies، ص. 382، ISBN 978-0-07-121237-3، مؤرشف من الأصل في 27 مارس 2020، اطلع عليه بتاريخ 16 ديسمبر 2016.
- "Hippocampal neuroanatomy"، The hippocampus book (ط. first)، New York: Oxford University Press، 2007، ص. 37، ISBN 978-0-19-510027-3، مؤرشف من الأصل في 16 مارس 2020، اطلع عليه بتاريخ 15 ديسمبر 2016.
- "The hippocampal formation"، The hippocampus book (ط. first)، New York: Oxford University Press، 2007، ص. 3، ISBN 978-0-19-510027-3، مؤرشف من الأصل في 15 مارس 2020، اطلع عليه بتاريخ 15 ديسمبر 2016.
- Bachevalier, Jocelyne (26 ديسمبر 2019)، "Nonhuman primate models of hippocampal development and dysfunction"، Proceedings of the National Academy of Sciences، 116 (52): 26210–26216، doi:10.1073/pnas.1902278116، PMC 6936345، PMID 31871159.
- Bingman V.P., Salas C., Rodriguez F. (2009) Evolution of the Hippocampus. In: Binder M.D., Hirokawa N., Windhorst U. (eds) Encyclopedia of Neuroscience. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-540-29678-2_3158 نسخة محفوظة 2020-05-12 على موقع واي باك مشين.
- قرن آمون
- "Preclinical Alzheimer's disease: Definition, natural history, and diagnostic criteria"، Alzheimer's & Dementia، 12 (3): 292–323، مارس 2016، doi:10.1016/j.jalz.2016.02.002، PMC 6417794، PMID 27012484.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - preparation by László Seress in 1980.
- Duvernoy, 2005
- "cornu ammonis"، TheFreeDictionary.com، مؤرشف من الأصل في 29 يناير 2019.
- "Hippocampus minor, calcar avis, and the Huxley-Owen debate"، Neurosurgery، 65 (6): 1098–104, discussion 1104-5، ديسمبر 2009، doi:10.1227/01.neu.0000359535.84445.0b، PMID 19934969.
- Gross, 1993
- Wechsler, 2004
- "The limbic system conception and its historical evolution"، TheScientificWorldJournal، 11: 2428–41، 2011، doi:10.1100/2011/157150، PMC 3236374، PMID 22194673.
- "Chapter 9: Limbic System"، www.dartmouth.edu، مؤرشف من الأصل في 30 ديسمبر 2017.
- "A meta-analysis of structural brain abnormalities in PTSD"، Neuroscience and Biobehavioral Reviews، 30 (7): 1004–31، 2006، doi:10.1016/j.neubiorev.2006.03.004، PMID 16730374، S2CID 15511760.
- "Meta-analysis of regional brain volumes in schizophrenia"، The American Journal of Psychiatry، 157 (1): 16–25، يناير 2000، doi:10.1176/ajp.157.1.16، PMID 10618008.
- "Structural neuroimaging studies in major depressive disorder. Meta-analysis and comparison with bipolar disorder"، Archives of General Psychiatry، 68 (7): 675–90، يوليو 2011، doi:10.1001/archgenpsychiatry.2011.60، PMID 21727252. see also MRI database at www.depressiondatabase.org نسخة محفوظة 2011-09-29 على موقع واي باك مشين.
- Decker, Alexandra L.؛ Duncan, Katherine؛ Finn, Amy S.؛ Mabbott, Donald J. (12 أغسطس 2020)، "Children's family income is associated with cognitive function and volume of anterior not posterior hippocampus"، Nature Communications (باللغة الإنجليزية)، 11 (1): 4040، Bibcode:2020NatCo..11.4040D، doi:10.1038/s41467-020-17854-6، ISSN 2041-1723، PMC 7423938، PMID 32788583.
- "Decrease in cortisol reverses human hippocampal atrophy following treatment of Cushing's disease"، Biological Psychiatry، 46 (12): 1595–602، ديسمبر 1999، doi:10.1016/s0006-3223(99)00203-6، PMID 10624540، S2CID 7294913.
- Disorders, Institute of Medicine (US) Forum on Neuroscience and Nervous System (01 يناير 2011)، Overview of the Glutamatergic System، National Academies Press (US)، مؤرشف من الأصل في 01 سبتمبر 2018، اطلع عليه بتاريخ 05 فبراير 2017.
- "Chronic stress-induced hippocampal vulnerability: the glucocorticoid vulnerability hypothesis"، Reviews in the Neurosciences، 19 (6): 395–411، 2008، doi:10.1515/revneuro.2008.19.6.395، PMC 2746750، PMID 19317179.
- "Cholesterol and perhaps estradiol protect against corticosterone-induced hippocampal CA3 dendritic retraction in gonadectomized female and male rats"، Neuroscience، 246: 409–21، أغسطس 2013، doi:10.1016/j.neuroscience.2013.04.027، PMC 3703463، PMID 23618757.
- "DNA brain damage after stress in rats"، Prog. Neuropsychopharmacol. Biol. Psychiatry، 34 (4): 652–6، مايو 2010، doi:10.1016/j.pnpbp.2010.03.004، PMID 20226828، S2CID 38959073.
- "Verbal learning and hippocampal dysfunction in schizophrenia: A meta-analysis" (PDF)، Neuroscience and Biobehavioral Reviews، 86: 166–175، مارس 2018، doi:10.1016/j.neubiorev.2017.12.001، PMC 5818020، PMID 29223768، مؤرشف من الأصل (PDF) في 25 يوليو 2018، اطلع عليه بتاريخ 23 نوفمبر 2018.
- "Long-term antipsychotic treatment and brain volumes: a longitudinal study of first-episode schizophrenia"، Archives of General Psychiatry، 68 (2): 128–37، فبراير 2011، doi:10.1001/archgenpsychiatry.2010.199، PMC 3476840، PMID 21300943.
- "Progressive brain changes in schizophrenia related to antipsychotic treatment? A meta-analysis of longitudinal MRI studies"، Neuroscience and Biobehavioral Reviews، 37 (8): 1680–91، سبتمبر 2013، doi:10.1016/j.neubiorev.2013.06.001، PMC 3964856، PMID 23769814.
- "Schizophrenia—what does structural MRI show?"، Tidsskrift for den Norske Laegeforening، 133 (8): 850–3، أبريل 2013، doi:10.4045/tidsskr.12.1084، PMID 23612107.
- "Evidence for oxidative DNA damage in the hippocampus of elderly patients with chronic schizophrenia"، Am J Geriatr Psychiatry، 12 (2): 167–75، 2004، doi:10.1097/00019442-200403000-00008، PMID 15010346.
- بوابة علوم عصبية
- بوابة تشريح
- بوابة طب