قطبية كيميائية
تشير القطبية الكيميائية عادةً إلى فصل الشحنات الكهربائية جزئيا في الجزيء مؤدية إلى أكتسابه لعزم ثنائي القطب أو عزم متعدد القطبية. تترابط الجزيئات القطبية من خلال قوى بين جزيئية قطبية والرابطة الهيدروجينية. تعتمد القطبية الجزئية على اختلاف السالبية الكهربائية للذرات المختلفة المكونة للجزيء. فعلى سبيل المثال يعتبر الماء مركب قطبي بسبب عدم التوازن في التوزيع الإلكتروني في ترابط الهيدروجين مع الأكسجين، بينما يعتبر الميثان مركب غير قطبي بسبب التوازن في التقاسم الإلكتروني بين الكربون والهيدروجين. تؤثر القطبية الكهربائية على العديد من الخصائص مثل التوتر السطحي والانحلالية إضافة إلى نقطتي الغليان والانصهار.
النتائج
تنتج عن نظرية القطبية الكيميائية ظواهر عديدة، فهي تفسر مثلا سبب قدرة بعض الحشرات أن تطفو على سطح الماء، وتفسر سبب تجمد المسطحات المائية من السطح ثم إلى الأسفل. فقطبية جزيئات الماء تجعل لها خواص ذات أهمية.
النظرية
عندما تترابط ذرتين فقد ينجم هذا الترابط عن رابطة لا يكون تقاسم الإلكترونات بشكل متوازن بين الذرتين. حيث تجذب إحدى الذرتين السحابة الإلكترونية باتجاها أكثر من الأخرى ويطلق على ذلك اسم الكهرسلبية. و عدم وجود توازن في توزع الإلكترونات ضمن الروابط يؤدي إلى نشأة القطبية. وبالتالي يمكن تقسيم الجزيئات إلى شوارد موجبة أو شوارد (أيونات) سالبة؛ ويرمز للشوارد الموجبة بـ δ+ ويرمز للشوارد السالبة δ−.
كان أول من أدخل هذا الترميز كريستوفر إينغولد واديث اينغولد في سنة 1926.[1]
تسحب الذرات ذات الكهرسلبية العالية مثل الأكسجين و الفلور و النتروجين الإلكترونات إليها من الذرات ذات الكهرسلبية الأقل. وفي حال الترابط بين هذه الذرات فإن الإلكترونات ستقترب أكثر إلى الذرات ذات الكهرسلبية العالية.
وبالتالي يمكن أن تكون الروابط إما روابط قطبية أو روابط بدون قطبية. وتنتج الروابط بدون القطبية عندما يكون فرق الكهرسلبية بين الذرتين المرتبطتين صفرا. في حين الروابط القطبية تحدث عندما يكون فرق الكهرسلبية كبير بحيث تجذب الذرة ذات الكهرسلبية العالية الإلكترون. لتحديد القطبية رياضياً يتم حساب فرق الكهرسلبية بين الذرتين فإذا كان هذا الفرق بين 0.4 و 1.7 فإن الرابطة تعتبر قطبية.
القطبية في الجزيئات
يمكن وصف جزيئات بأنها ذات «روابط قطبية» أو «روابط لاقطبية».إلا أن هذا التعميم هو أمر نسبي في كثير من الأحيان. ومع ذلك، فإن الخصائص التالية هي نموذجية لمثل هذه الجزيئات.
الجزيئات القطبية
من الأمثلة الشائعة على الجزيئات القطبية المنزلية السكر، والاسم العلمي للسكر سكروز حيث يتكون جزيئه من ارتباط جزيء فركتوز مع جزيء جلوكوز. ويحوي السكروز على العديد من الروابط القطبية بين الأكسجين والهيدروجين (- OH).
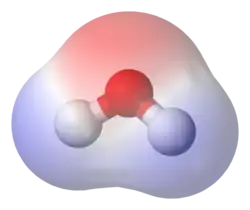
ونظرا للطبيعة القطبية لجزيء الماء (H2O) فهو مذيب جيد. كذلك فالجزيئات القطبية عادة تستطيع الذوبان في الماء.
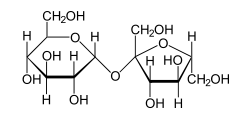 يملك السكروز العديد من قطبيات -OH
يملك السكروز العديد من قطبيات -OH الماء محل قطبي
الماء محل قطبي
- مثال 2 مركب فلوريد الهيدروجين HF هو جزيء قطبي حيث إلكترونات الرابطة تميل باتجاه ذرة الفلور.
- مثال 3 مركب الأمونيا يملك ثلاثة روابط بين ثلاث ذرات هيدروجين وذرة النتروجين؛ ويعتبر قليل القطبية حيث تنزاح الإلكترونات قليلاً إلى ناحية النتروجين. لكن هذا الجزيء يحوي إلكترونين وحيدين يدوران في مدار وتقع هذه النقطة في قمة رباعي الوجوه، وهذه السحابة الإلكترونية لا تشارك في رابطة المركب مما ينتج عنه قطبية قوية لمركب الأمونيا.
- مثال 4 مركب الأوزون يتركب من رابطتين أكسجينتين O-O لاقطبيتين لكن عند إضافة ذرة ثالثة إلى المركب لتشكيل الأوزون نحصل على لا تجانس في الإلكترونات حيث تشارك الذرة المركزية إلكتروناتها مع ذرتين أخرتين، في حين أن كل من الذرتين الطرفيتين تشارك إلكتروناتها مع ذرة واحدة مما يؤدي إلى أن الذرة المركزية تكون شحنتها +1 في حين كل من الطرفيتين -1/2
 يظهر في الشكل ذرة الفلوريد ذات الكهرسلبية الأعلى باللون الأصفر في مركب فلوريد الهيدروجين
يظهر في الشكل ذرة الفلوريد ذات الكهرسلبية الأعلى باللون الأصفر في مركب فلوريد الهيدروجين تبين المنطقة الحمراء في مركب الفوريد الهيدروجين المنطقة المشحونة بشحنة سالبة
تبين المنطقة الحمراء في مركب الفوريد الهيدروجين المنطقة المشحونة بشحنة سالبة الإلكترونين الوحيدين يظهران باللون الأصفر في قمة تركيب رباعي الوجوه في الأمونيا
الإلكترونين الوحيدين يظهران باللون الأصفر في قمة تركيب رباعي الوجوه في الأمونيا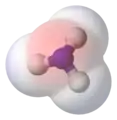 يبين اللون الأحمر الشحنة السالبة في الأمونيا
يبين اللون الأحمر الشحنة السالبة في الأمونيا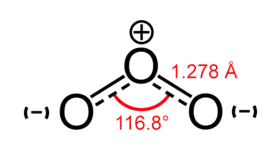 الأوزون
الأوزون
الجزيئات غير القطبية
قد يكون جزيء ما غير قطبي لوجود راوبط لا قطبية عندما يكون هناك تقاسم متساو للإلكترونات بين الذرات أو بسبب الترتيب المتناظر للروابط القطبية (كل رابطتيين تعادلان بعضهما البعض كهربائيا).
من الأمثلة على المركبات غير القطبية نذكر الدهون والزيوت والبنزين. ولذلك معطم الجزيئات غير القطبية هي مركبات غير قابلة للذوبان في الماء عند درجة حرارة الغرفة. لكن العديد من المذيبات العضوية غير القطبية، مثل التربنتين، تكون قادرة على حل المواد القطبية.
عند المقارنة بين جزيء قطبي وغير قطبي لهما نفس الكتلة المولية، يكون للجزيء القطبي عموما نقطة غليان أعلى، بسبب التفاعل بين ثنائي القطب. الشكل الأكثر شيوعا من هذا النوع من التفاعل هو الرابطة الهيدروجينية.
- مثال 4 في مركب الميثان تتوزع الروابط الهيدروجينية لأربع ذرات هيدروجين حول ذرة الكربون على شكل رباعي وجوه، وبما أن كل رابطة تملك قطبية قليلة والتوزيع متناظر فإن مجمل روابط المركب يشكل لاقطبية
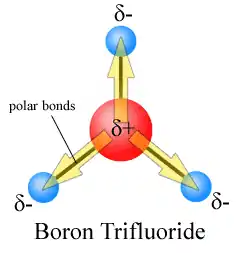
- مثال 5 في مركب ثلاثي فلوريد البورون توجد ثلاث روابط قطبية موزعة هذه الروابط على 120 درجة وبالتالي مجمل هذه الروابط لا يشكل ثنائية قطبية.
- مثال 6 مركب جزيء الأكسجين لا يحوي قطبية بسبب تجانس التوزيع الإلكتروني بين الذرتين
 تتوزع الروابط القطبية في الميثان بشكل متناظر لذلك فإن المحصلة ستكون صفر
تتوزع الروابط القطبية في الميثان بشكل متناظر لذلك فإن المحصلة ستكون صفر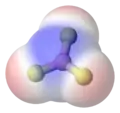 التوزيع الهرمي لذرات مركب ثلاثي فلوريد البورون ستكون محصلته لا قطبية ثنائية
التوزيع الهرمي لذرات مركب ثلاثي فلوريد البورون ستكون محصلته لا قطبية ثنائية
الجزيئات الهجينة
هي عبارة عن جزيئات كبيرة لها نهاية واحدة برابطة قطبية ترتبط مع مجموعة أخرى لها نهاية أخرى غير قطبية وهي مؤثر سطحي جيد. يمكن أن تساعد هذه المركبات في تشكيل المستحلبات المستقرة، أو مزيج من الماء والدهون. كما تؤدي إلى خفض التوتر السطحي بين الزيت والماء بواسطة الامتزاز في السطح التماسي للسائل-سائل.
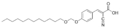 يوجد لهذا المركب المعقد العديد من الروابط القطبية في الجهة اليمنى وروابط غير قطبية في الجهة اليسرى مما يعطي خصائص المؤثر السطحي
يوجد لهذا المركب المعقد العديد من الروابط القطبية في الجهة اليمنى وروابط غير قطبية في الجهة اليسرى مما يعطي خصائص المؤثر السطحي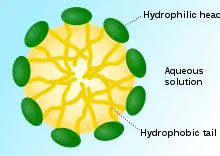
 الدهون الفوسفوليدية الطبيعية الفعالة التي لها وظائف بيولوجية مهمة
الدهون الفوسفوليدية الطبيعية الفعالة التي لها وظائف بيولوجية مهمة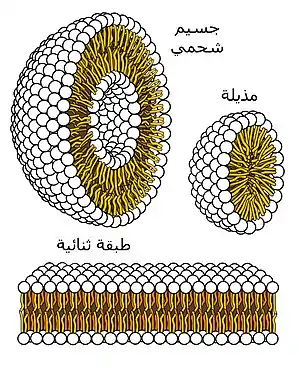 مقطع عرضي التي يمكن أن يشكلها الفوسفوليد والتي يمكن أن تشكل إيونات غروية وهي هامة في تشكيل أغشية الخلايا
مقطع عرضي التي يمكن أن يشكلها الفوسفوليد والتي يمكن أن تشكل إيونات غروية وهي هامة في تشكيل أغشية الخلايا
المراجع
- The Origin of the "Delta" Symbol for Fractional Charges Jensen, William B. J. Chem. Educ. 2009, 86, 545. Link نسخة محفوظة 11 أبريل 2020 على موقع واي باك مشين. [وصلة مكسورة]
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة كيمياء فيزيائية