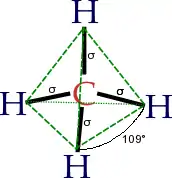
ميثان
الميثان وهو مُركّب كيميائي يعد أبسط الهيدروكربونات، وهو غاز له الصيغة الكيميائية CH4. الميثان النقي ليس له رائحة، ولكن عند استخدامه تجاريا يتم خلطه بكميات ضئيلة من مركبات الكبريت ذات الرائحة المميزة مثل إيثيل مركبتان، مما يمكن من تتبع أثار الميثان في حالة حدوث تسريب.
| ميثان | |
|---|---|
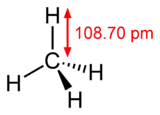 ميثان |
 ميثان |
 ميثان |
 ميثان |
| الاسم النظامي (IUPAC) | |
ميثان | |
| أسماء أخرى | |
غاز المستنقعات | |
| المعرفات | |
| رقم CAS | 74-82-8 |
| بوب كيم (PubChem) | 297 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | CH4 |
| الكتلة المولية | 16.042 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 0.717 كغ/م3 غاز |
| نقطة الانصهار | - 182.5 °س |
| نقطة الغليان | - 161.6 °س |
| الذوبانية في الماء | 3.5 مغ/100 مل ماء عند 17 °س |
| المخاطر | |
| ترميز المخاطر |  F+ F+ |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| نقطة الوميض | - 188 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
وكمكون رئيسي للغاز الطبيعي فإن الميثان أحد أنواع الوقود المهمة. وحرق جزيء واحد من الميثان في وجود الأكسجين ينتج جزيء من ثاني أكسيد الكربون CO2 وجزيئين من الماء H2O.
- CH4 + 2O2 → CO2 + 2H2O
الميثان أيضا أحد غازات الانحباس الحراري وله قدرة على تسخين الجو 25 مرة أشد من تأثير ثاني أكسيد الكربون.
مصادر الميثان
المصادر الطبيعية
يتم استخراج الميثان من الرواسب الجيولوجية حيث يكون مصاحبا لأنواع الوقود الهيدروكربوني الأخرى. كما يمكن الحصول عليه من المصادر الطبيعية:
- تحلل المخلفات العضوية.
- المصادر الطبيعية: المستنقعات 23%
- وقود حفريات 20%
- عملية الهضم في الحيوانات (ماشية) 17%
- قاع البحر توجد كميات ضخمة من الغاز الطبيعي متجمدة تحت قاع البحر. ويقدر الخبراء أن احتياطي هيدرات الميثان الموجودة تحت قاع محيطات وبحار العالم، تبلغ حوالي 3000 غيغاطن، أي حوالي 3 مليار كيلوغرام. وهذا بدوره يعادل ضعف احتياطيات الطاقة المتوفرة في جميع المصادر التقليدية للطاقة كالفحم والنفط والغاز الطبيعي. لذا تتجه بعض الدول مثل الصين واليابان وكوريا الجنوبية والهند والبرازيل والولايات المتحدة، إلى استخراج هيدرات الميثان من أعماق البحار لسد حاجتها المتزايدة من الطاقة.
.jpg.webp)
- البكتريا التي تتواجد أثناء زراعة الأرز.
- تسخين أو حرق الكتلة الحيوية لاهوائيا.
60% من الانبعاثات التي تنتج الميثان ناتجة من الأنشطة البشرية، وخاصة الأنشطة الزراعية. وخلال 200 سنة السابقة، تضاعف تركيز الغاز في الغلاف الجوي من 0.8 إلى 1.6 جزء في المليون.
كما أن الميثان يصنف على أنه كتلة حيوية لأنه يمكن أن ينتج من الحرق اللاهوائي لبعض المواد العضوية.
المصادر الصناعية
يمكن تصنيع الميثان واستخدامه صناعيا وذلك عن طريق التفاعلات الكيميائية مثل تفاعل ساباتيه (Sabatier reaction) أو عملية فيشر-تروبش (Fischer-Tropsch process).
- وطبقا لتقديرات أحد المصادر فإن الميثان الموجود في شكل رسوبي في المحيط يقدر بـعشرة آلاف مليار طن.[3] وتقترح النظريات أن هذه الكميات الضخمة من الميثان يمكن أن تنطلق فجأة مرة أخرى، وتسبب ارتفاعا في درجات الحرارة.
أبسط الهيدروكربونات، الميثان وهو غاز، له الصيغة الكيميائية CH4. الميثان النقي ليس له رائحة، ولكن عند استخدامه تجاريا يتم خلطه بكميات ضئيلة من الكبريت القوي الرائحة. المركبات مثل إثيل مركبتان تمكن من تتبع أثار الميثان في حالة حدوث تسريب.
وكمكون رئيسي للغاز الطبيعي، فإن الميثان أحد أنواع الوقود المهمة. وحرق جزيء واحد من الميثان في وجود الأكسجين ينتج جزيء من ثاني أكسيد الكربون CO2, و2 جزيء من الماء H2O.
CH4 + 2O2 → CO2 + 2H2O الميثان أيضا أحد غازات الصوبة الزجاجية وله عزم تدفئة عام يبلغ 21. ويبلغ المتر المكعب من الميثان 717 جرام.
تفاعلات الميثان
 تفاعل احتراق الميثان؛ حيث توجد 4 ذرات هيدروجين و4 ذرات أكسجين و1 ذرة كربون قبل التفاعل وبعده. الكتلة الكلية بعد التفاعل هي نفسها التي كانت قبل التفاعل.
تفاعل احتراق الميثان؛ حيث توجد 4 ذرات هيدروجين و4 ذرات أكسجين و1 ذرة كربون قبل التفاعل وبعده. الكتلة الكلية بعد التفاعل هي نفسها التي كانت قبل التفاعل.- الاحتراق
يوجد عديد من الخطوات عند احتراق الميثان: يتحول الميثان إلى الجذر ميثيل CH3، والذي يتحول إلى فورمالدهيد (HCHO أو H2CO). ويتحول الفورمالدهيد إلى الجذر فورمال HCO، والذي بدوره يكون أول أكسيد الكربون CO. وهذه العملية يطلق عليها تحلل حراري تأكسدي:
- CH4 + O2 → CO + H2 + H2O
بعد عملية انحلال حراري تاكسدية يتأكسد H2 مشكلاً H2O، ويطلق حرارة. ويحدث هذا بسرعة جدا، في وقت أقل من ميلي ثانية.
- H2 + ½ O2 → H2O
وأخيرا، يتأكسد CO ليكون CO2 وينطلق مزيد من الحرارة. وهذه العملية أبطأ الخطوات وتحتاج بضع ميلي ثواني لتكتمل:
- CO + ½ O2 → CO2
- تنشيط الهيدروجين
إن الرابطة التساهمية القوية بين الكربون-الهيدروجين في الميثان هي واحدة من أقوى الروابط الهيديروجينية، وعلى ذلك فإن استخدامها كمادة اولية في صناعة البتروكيمياويات محدود. ولايزال البحث جاريا عن عامل حفز مناسب لتكسير الرابطة بين C-H في الميثان والألكانات المنخفضة الأخرى.
يتفاعل الميثان مع الهالوجينات المختلفة حسب المعادلة العامة:
- CH4 + X2 → CH3X + HX
ولكن ذلك في الضوء الشمس غير المباشر ويكون هذا التفاعل تفاعل استبدال
الميثان خارج الكرة الأرضية
يُعتقد أن الميثان تم تحديد وجوده في أماكن عديدة في النظام الشمسي. ويعتقد أنه تكوّن خلال العمليات غير العضوية التي كانت تصاحب تطور النظام الشمسي.
- كوكب المشتري؛ يحوي غلافه الجوي على 0.3 % ميثان.
- كوكب المريخ؛ يحوي 10 جزء من البليون. (10 ppb)
- كوكب زحل؛ يحوي غلافه الجوي على 0.4 % ميثان.
- كوكب نيبتون
- قمر تريتون
- كوكب أورانوس
- قمر أريل
- قمر ميرندا
- قمر أوبيرون
- قمر تيتانيا
- قمر أمبريل
- مذنب هالي
- مذنب هياكوتاكي
كما توجد آثار لغاز الميثان في طبقة رقيقة على القمر التابع للأرض. كما أن هناك بعض الاكتشافات حول وجود الميثان في السحابات الموجودة بين النجوم.
استخدامات الميثان
إن المصادر الممكن استعادة واستعمال غاز الميثان منها كطاقة مجدية اقتصادياً تتضمن مناجم الفحم الحجري، وأنظمة الزيت والغاز، ومواقع ردم النفايات، وسماد الحيوانات.
- مناجم الفحم
- من أجل خفض مخاطر الانفجارات، تتم إزالة غاز الميثان من المناجم الموجودة تحت الأرض، قبل، وخلال، أو بعد التعدين. أما الاستعمالات الممكنة والمربحة للميثان من مناجم الفحم فهي: حقن غاز المناجم في شبكات أنابيب توزيع الغاز الطبيعي، أو استعماله لتوليد الطاقة الكهربائية، أو كوقود للمركبات/السيارات.
- مناطق ردميات النفايات
- الطريقة الرئيسية لخفض انبعاثات الميثان من مواقع طمر النفايات تتضمن جمع وحرق أو إعادة استعمال الغاز الناتج عن مواقع ردميات النفايات. تتركز تكنولوجيا استعمال غاز مناطق الردميات على توليد الطاقة الكهربائية والاستعمال المباشر للغاز. يتم توليد الطاقة الكهربائية من خلال توزيع الميثان المجمع بواسطة شبكات الأنابيب كوقود للمحركات أو التوربينات. كما تستعمل تكنولوجيا الاستعمال المباشر غاز مواقع الردميات مباشرة كوقود. بينما تتطلب التكنولوجيات الأخرى تحسين الغاز وتوزيعه على شبكات أنابيب توزيع الغاز الطبيعي.
- أنظمة الزيوت والغاز الطبيعي
- تقع نشاطات تخفيض الانبعاثات هنا في ثلاث فئات: التكنولوجيات أو تحسين المعدات التي تخفض أو تزيل تهوية المعدات والانبعاثات الأخرى، ورفع مستوى الأساليب الإدارية والإجراءات التشغيلية، إضافةً إلى تعزيز الوسائل الإدارية بالاستفادة من التحسينات التكنولوجية. في جميع هذه الحالات، فإن خفض انبعاثات الميثان يوفر غازا أكثر للبيع والاستعمال.
استعمالات أخرى:
- تحضر منه الكثير من المركبات العضوية مثل الكلوروفورم ورابع كلوريد الكربون الذي يستخدم في إطفاء الحرائق وكمذيب أيضا، كما يدخل في صناعات كثيرة مثل صناعة البلاستيك والنايلون والكحولات والفورمالدهيد.
- يكوّن حوالي 80% من الغاز الطبيعي المستخدم كوقود.
- يستخدم في الاحتراق للحصول على الطاقة، فالكيلو جرام منه يعطي 13300 سعر ما يعادل 55594 جول.
- يحضر منه النيتروميثان الذي يستخدم في عمل العقاقير الطبية والمبيدات الحشرية والمفرقعات.
- يستخدم في تحضير غاز الاصطناع.
- غاز الطبخ أو الغاز الطبيعي يتكون 90% من غاز الميثان مع عدد آخر من غازات أخرى.
انظر أيضًا
- قائمة الدول حسب انبعاث غازات الدفيئة
- قائمة الدول حسب انبعاثات ثاني أكسيد الكربون
- الألكانات. أحد أنواع الهيدروكربونات والتي يكون الميثان أبسط أعضائها.
- كلاثيرات ميثان، نوع من أنواع الثلج يحتوى على الميثان.
- مجموعة ميثيل، مجموعة فعالة تشبه الميثان.
- إنتاج الميثان من الفحم
المراجع
- العنوان : methane — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/297 — تاريخ الاطلاع: 19 أكتوبر 2016 — الرخصة: محتوى حر
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/297
- BBC نسخة محفوظة 28 أغسطس 2017 على موقع واي باك مشين.
وصلات خارجية
- بوابة الكيمياء
- بوابة طاقة
- بوابة تنمية مستدامة
- بوابة علم الفلك
