مناعة جماعية
المناعة الجماعية أو مناعة الجماعة أو مناعة القطيع(1) هي شكلٌ من أشكال الحماية غير المُباشرة من مرضٍ معدٍ، وتحدث عندما تكتسبُ نسبةٌ كبيرةٌ من المجتمع مناعةً لعدوًى معينة، إما بسبب الإصابة بها سابقًا أو التلقيح، مما يُوفر حمايةً للأفراد الذين ليس لديهم مناعةٌ للمرض.[1][2] إذا كانت نسبةٌ كبيرةٌ من السكان تمتلك مناعةً لمرضٍ معين، فإنه يُساعد في عدم نقل هؤلاء الأشخاص للمرض، وبالتالي يُحتمل أن تتوقف سلاسل العدوى، مما يؤدي إلى توقف أو إبطاء انتشار المرض.[3] كُلما زادت نسبة الأفراد الذين لديهم مناعةٌ في المجتمع، كلما يقلُ احتمال اختلاط الأفراد الذين لا يمتلكون مناعةً مع أشخاصٍ ناقلين للمرض، مما يُساعد على حمايتهم من العدوى.[1]

قد يمتلكُ الأفراد مناعةً إما بعد الشفاء من عدوًى مُبكرة أو من خلال التلقيح.[3] لا يستطيع بعضُ الأفراد تطوير مناعةً لأسبابٍ طبية، مثل نقص المناعة أو تثبيط المناعة؛ لذلك تعدُ المناعة الجماعية مهمة لهذه الفئة من الأفراد، حيثُ تُعتبر وسيلة حمايةً مصيريةٍ لهم.[4][5] عند الوصول إلى حدٍ مُعين، فإنَّ المناعة الجماعية تقضي تدريجيًا على المرض بين السكان.[5] إذا حصلت إزالة المرض في جميع أنحاء العالم، فإنها قد تؤدي إلى انخفاضٍ دائمٍ في عدد حالات العدوى حتى تصل إلى صفر، وحينها يُسمى بالاستئصال.[6] ساهمت المناعة الجماعية التي أنشئت بواسطة بالتلقيح في استئصال مرض الجدري في عام 1977، كما ساهمت أيضًا في تقليل انتشار العديد من الأمراض الأخرى.[7] لا يُمكن تطبيق المناعة الجماعية على جميع الأمراض، ويُمكن تطبيقه فقط على الأمراض السارية، أي أنَّ المرض قادرٌ على الانتقال من شخصٍ لآخر.[5] مثلًا، مرض الكزاز يُعتبر مرضًا مُعديًا وليس ساريًا، بالتالي لا يُمكن تطبيق المناعة الجماعية عليه.[4]
استخدام مُصطلح المناعة الجماعية أو مناعة القطيع (بالإنجليزية: herd immunity) للمرة الأولى في عام 1923.[1] وقد اعتُرف به ظاهرةً تحدثُ طبيعيًا في ثلاثينيات القرن العشرين، وذلك عندما لوحظ أنه بعد تطويرِ عدد كبيرٍ من الأطفال لمناعةٍ ضد الحصبة، فإنَّ عدد الإصابات الجديدة قد انخفض مؤقتًا، خصوصًا بين الأطفال المُعرضين لخطر الإصابة به.[8] أصبح التلقيح الجماعي لإحداث المناعة الجماعية شائعًا منذ ذلك الوقت، كما أثبت نجاحهُ في منع انتشار العديد من الأمراض المعدية.[9] شكلت معارضة التلقيح تحديًا لالمناعة الجماعية، مما سمح باستمرار حدوث الأمراض التي يمكن الوقاية منها أو عودة ظهورها في المجتمعات التي لديها معدلاتُ تلقيحٍ غيرُ كافيةٍ.[10][11][12]
الآثار
حماية غير المحصنين مناعيًا
لا يستطيعُ بعض الأفراد تطوير مناعةٍ بعد التلقيح الطبي أو لأسبابٍ طبية لا يُمكن تلقيحهم.[4][13][13][14] يُعتبر الأطفال حديثو الولادة صغارًا على تلقي العديد من اللقاحات، إما لأسبابٍ تتعلق بسلامتهم أو لأنَّ المناعة السلبية لديهم تجعلُ اللقاح غير فعالٍ.[15] قد يفقد بعضُ الأفراد المناعة التي كانت لديهم سابقًا، مثل مرضى الإيدز أو اللمفوما أو ابيضاض الدم أو سرطان نخاع العظم أو ضعف الطحال أو بسبب العلاج الكيميائي أو العلاج الإشعاعي، كما قد تكون اللقاحات دون أي فائدةٍ لهم بسبب نقص المناعة لديهم.[4][13][15][16]
عادةً ما تكون اللقاحات غير تامةٍ، حيثُ قد لا تُولد أجهزة المناعة لدى بعض الأفراد استجابةً مناعيةً كافيةٍ للقاحات لتوفير مناعةٍ طويلة الأمد؛ لذلك قد يكون بعض الذين تلقوا اللقاحات منقوصي المناعة.[1][17][18] كما قد تُمنع موانع اللقاح بعض الأفراد من أنَّ يصبحوا مُحصنين مناعيًا،[13] لذلك وعلاوةً إلى عدم كونهم محصنين مناعيًا، فإنَّ الفرد منهم قد يكون أكثر عرضةً للإصابة بمضاعفات العدوى بسبب حالتهم الطبية، ولكنهم قد يظلون محميين إذا كانت نسبةٌ كبيرة من السكان محصنةٌ مناعيًا.[4][13][18][19]
قد يؤدي وجود مستوياتٍ مرتفعةٍ من المناعة في فئةٍ عمريةٍ محددة إلى تكوين مناعة قطيعٍ لمجموعاتٍ عمريةٍ أُخرى.[7] إنَّ تلقيح البالغين ضد السعال الديكي يُقلل من حدوث السعال الديكي عند الرضع الصغار الذي لا يُمكن تلقيحهم، والذين يُعتبرون أكثر عرضةً لخطر مضاعفات المرض.[20][21] يُعتبر هذا الأمر مهمًا خصوصًا لأفراد الأسرة، والذين يمثلون معظم حالات انتقال العدوى إلى الرضع الصغار.[7][18] وبنفس الطريقة، فإنَّ الأطفال الذين يتلقون لقاحاتٍ ضد المكورات الرئوية يُقلل من الإصابة بمرض المكورات الرئوية بين الأشقاء الأصغر سنًا غير المُلقحين طبيًا.[22] كان لتلقيح الأطفال ضد المكورات الرئوية والفيروسات العجلية تأثيرٌ هامٌ في الحد من الحالات التي تدخل المستشفى بسبب المكورات الرئوية والفيروسات العجلية في المستشفيات وذلك في الأطفال الأكبر سنًا والبالغين، والذين لا يتلقون عادةً هذه اللقاحات.[22][23][24] تكون الإنفلونزا أكثر حدةً في كبار السن منها في الفئات العمرية الأصغر، ولكن لقاحات الإنفلونزا تفتقر إلى الفعالية في هذه الفئة السكانية؛ وذلك بسبب ضعف الجهاز المناعي مع التقدم في العمر.[7][25] ولكن على الرغم من ذلك، فقد ثبت أن إعطاء الأطفال في سن المدرسة تحصينًا مناعيًا ضد الإنفلونزا الموسمية، يكون أكثر فعالية من تطعيم كبار السن نفسهم، كما يكون درجة معينة من الحماية لكبار السن.[7][25]
بالنسبة للعداوى المنقولة جنسيًا (STIs)، فإنَّ المستويات العالية من المناعة في جنسٍ واحدٍ تُحفز المناعة الجماعية لكلا الجنسين.[9][26][27] تؤدي اللقاحات ضد الأمراض المنقولة جنسيًا والتي تستهدف جنسًا واحدًا إلى انخفاضٍ كبير في الأمراض المنقولة جنسيًا في كلا الجنسين، وذلك إذا كانت مستويات أخذ اللقاح في الجنس المُستهدف مرتفعةً.[26][27][28] ولكن على الرغم من ذلك، إلا أنَّ المناعة الجماعية لا تمتد تلقيح الإناث إلى الذكور المثليين،[27] أما إذا كان امتصاص اللقاح بين الجنس المُستهدف منخفضًا، فقد يحتاج الجنس الآخر إلى التحصين حتى يمكن حماية الجنس المستهدف بشكل كافٍ.[26][27] تجعل السلوكيات عالية الخطورة القضاء على الأمراض المنقولة جنسيًا أمرًا صعبًا، وذلك على الرغم من أنَّ معظم حالات العدوى تحدث بين الأفراد ذوي المخاطر المُعتدلة، فإنَّ غالبية حالات الانتقال تحدث بسبب الأفراد الذين يشاركون في السلوكيات مرتفعة الخطر.[9] لهذه الأسباب، قد يكون من الضروري في بعض السكان تحصين الأشخاص المعرضين لمخاطر عالية أو الأفراد من كلا الجنسين وذلك لإنشاء المناعة الجماعية.[9][27]
الضغط التطوري
تعملُ المناعة الجماعية نفسها ضغطًا تطوريًا على بعض الفيروسات، مما يؤثر على التطور الفيروسي، حيثُ يشجع إنتاج سلالاتٍ جديدة، ويُشار إليها باسم طفرات الهروب (بالإنجليزية: escape mutants)، حيث تكون قادرةً على الهروب من المناعة الجماعية والانتشار بسهولةٍ أكبر.[29][30] على المستوى الجزيئي، فإنَّ الفيروسات تهربُ من المناعة الجماعية عبر انسياق المستضدات، والذي يحصل عندما تتراكم الطفرات في جزءٍ من جينوم الفيروس والذي يشفر لمولد الضد السطحي للفيروس، وعادةً ما يكون بروتينًا من قفيصة الفيروس، مما يؤدي إلى تغيير في الحاتمة الفيروسية.[31][32] بدلاً من ذلك، يُمكن أن ينتج عن إعادة تصنيف أجزاء الجينوم الفيروسي المُنفصلة، أو الزيحان المستضدي (والذي يكون أكثر شيوعًا عند وجود سلالاتٍ أكثر في الدورة الدموية) أنماطٌ مصليةٌ جديدة.[29][33] عندما يحدثُ أي من هذين، فإنَّ الخلايا التائية الذاكرة لا تتعرف على الفيروس، لذا فإنَّ الأفراد يكونون غيرُ محصنين ضد السلالة المعروفة المهيمنة.[32][33] بالنسبة لكل من الإنفلونزا والنوروفيروس، فإنَّ الأوبئة تُحفز المناعة الجماعية مؤقتًا حتى تظهر سلالة جديدة مهيمنة، مما يتسبب في موجات متتالية من الأوبئة.[31][33] نظرًا لأنَّ هذا التطور يفرض تحديًا على المناعة الجماعية، فإن الأجسام المضادة المستعدلة بشكلٍ واسعٍ واللقاحات الشاملة التي قد توفر حمايةً تتجاوز نمطًا مصليًا مُحددًا قيد التطوير.[30][34][35]
استبدال النمط المصلي
قد يحدث استبدال أو تحويل النمط المصلي إذا انخفض انتشار نمطٍ مصليٍ مٌحددٍ؛ بسبب مستويات عاليةٍ من المناعة، مما يسمح باستبداله بأنماطٍ مصليةٍ أخرى.[36][37] قللت اللقاحات الأولية ضد المكورات الرئوية العقدية بشكلٍ ملحوظٍ من الانتقال الأنفي البلعومي للأنماط المصلية للقاح (VTs)، وتتضمن الأنواع المقاومة للمضادات الحيوية،[22][38] لتُعوض بالكامل عبر زيادة نقل الأنماط المصلية غير اللقاحية (NVTs).[22][36][37] لم يؤدِ ذلك إلى زيادةٍ متناسبة في معدل الإصابة بالمرض، نظرًا لأنَّ الأنماط المصلية غير اللقاحية (NVTs) كانت أقل توغلاً من الأنماط المصلية للقاح (VTs).[36] منذ ذلك الوقت، أُدخلت لقاحات المكورات الرئوية والتي توفر الحماية من الأنماط المصلية الناشئة وقد نجحت في الحدث من ظهورها.[22] لا تزال إمكانية تحول الأنماط المصلية موجودةً، لذلك فإنَّ المزيد من الإستراتيجيات للتعامل مع ذلك تشمل توسيع تغطية الأنماط المصلية للقاح وتطوير اللقاحات التي تستخدم إما الخلايا الكاملة الميتة، والتي تحتوي على مزيدٍ من المستضدات السطحية، أو البروتينات الموجودة في العديد من الأنماط المصلية.[22][39]
استئصال الأمراض

إذا أُقرت المناعة الجماعية وحوفظَ عليها في مجموعةٍ سكانيةٍ لفترةٍ كافية، فإنهُ سيقضى على المرض بالتأكيد، أي لن تحدث المزيد من حالات انتقال العدوى المتوطنة.[5] إذا قُضي على المرض في جميع أنحاء العالم وانخفض عدد الحالات بشكل دائمٍ إلى الصفر، فإنهُ يُمكن الإعلان عن استئصال المرض،[6] وبالتالي يُمكن اعتبار الاستئصال تأثيرًا نهائيًا أو النتيجة النهائية لمبادرات الصحة العامة الهادفة للسيطرة على انتشار الأمراض المعدية.[6][7]
تُوجد عدة فوائدٍ لاستئصال المرض وتتضمن القضاءَ على المرض وقدرته على إحداث الوفاة، وتوفير أموال الأفراد، ومقدمي الرعاية الصحية، والحكومات، وتمكين الموارد المُستخدمة للسيطرة على المرض لاستخدامها في مكانٍ آخر.[6] حتى الآن، قُضي على مرضين باستخدام المناعة الجماعية والتلقيح، وهما طاعون البقر والجدري.[1][7][40] تُبذل حاليًا جهودٌ لاستئصال شلل الأطفال اعتمادًا على المناعة الجماعية، وذلك على الرغم من أنَّ الاضطرابات المدنية وانعدام الثقة في الطب الحديث قد جعلت ذلك صعبًا.[1][41] قد يكون التلقيح الإلزامي مفيدًا للجهود المبذولة لاستئصال المرض، وذلك إذا لم يكن هناك عددٌ كافٍ من الأفراد المُلقحين.[42][43][44][45]
الاستفادة مجانًا
تُعتبر المناعة الجماعية معرضةً لمشكلة الراكب بالمجان (أو المُستفيد بالمجان).[46] يستفيدُ الأفراد الذين يفتقرون إلى المناعة، خاصةً أولئك الذين يُختارون عدم التلقيح، من المناعة الجماعية التي أنشأها أولئك الذين يتمتعون بتحصينٍ مناعي.[46] مع ازدياد أعداد المُستفيدين بالمجان بين السكان، فإنَّ تفشي الأمراض التي يمكن الوقاية منها يُصبح أكثر شيوعًا وأكثر حدة بسبب فقدان المناعة الجماعية.[10][11][12][43][45] يُمكن للأفراد اختيار الاستفادة مجانًا لأسبابٍ مُتعددة، وتتضمن إدراك عدم فعالية اللقاح،[47] معتقدًا أنَّ المخاطر المرتبطة باللقاحات أكبر من تلك المرتبطة بالعدوى،[1][11][12][47] أو عدم الثقة في اللقاحات أو مسؤولي الصحة العامة،[48] بالإضافة إلى تأثير العربة أو التفكير الجماعي،[43][49] والأعراف الاجتماعية أو ضغط الأقران،[47] والمعتقدات الدينية.[11] يُرجح أنَّ بعض الأفراد قد يختارون عدم تلقي اللقاحات إذا كانت معدلات التلقيح عاليةً بما يكفي لإقناع الشخص بأنه قد لا يحتاج إلى التلقيح؛ وذلك لأنَّ نسبة كافية من الآخرين محصنةٌ بالفعل.[1][45]
الآلية
| المرض | الانتقال | عدد التكاثر الأساسي R0 | عتبة المناعة الجماعية (HIT) |
|---|---|---|---|
| الحصبة | الهواء | 12–18 | 92–95% |
| السعال الديكي | قطيرات في الهواء | 12–17[51] | 92–94% |
| الخناق | اللعاب | 6–7 | 83–86% |
| الحصبة الألمانية | قطيرات في الهواء | ||
| الجدري | 5–7 | 80–86% | |
| شلل الأطفال | طريق فموي-شرجي | ||
| النكاف | قطيرات في الهواء | 4–7 | 75–86% |
| السارس (تفشي السارس 2002-2004) | 2–5[52] | 50–80% | |
| كوفيد 19 (جائحة فيروس كورونا 2019–20) | 1.4–3.9[53][54] | 29–74% | |
| إيبولا (وباء إيبولا في غرب أفريقيا) | سوائل الجسم | 1.5–2.5[55] | 33–60% |
| إنفلونزا (جائحة إنفلونزاs) | قطيرات في الهواء | 1.5–1.8[51] | 33–44% |
يعمل الأفراد الذين لديهم مناعة لمرض ما كحاجز ضد انتشاره، ويعملون على إبطاء ومنع انتقال المرض إلى أفراد آخرين.[3] يمكن أن تُكتسب مناعة الفرد عبر عدوى طبيعية أو وسائل اصطناعية مثل اللقاح.[3] حين تكتسب نسبة حاسمة من الجمهرة المناعة ضد المرض، تسمى تلك المناعة عتبة المناعة الجماعية (HIT) أو مستوى المناعة الجماعية (HIL)، وحينها لا يستمر المرض في الانتشار بين السكان ويتوقف المرض المتوطن.[5][29]
يمكن قياس هذه العتبة بضرب R0 - وهوعدد التكاثر الأساسي، أو متوسط حالات العدوى الجديدة المسببة بواسطة كل حالة في جمهرة معرضة للعدوى بالكامل والتي هي متجانسة، أو جمهرة مختلطة جيدا، أي يمكن لكل شخص في هذه الجمهرة الاتصال مع كل فرد آخر معرَّض للعدوى[9][29][42]- وضربه في S وهو نسبة الأفراد في الجمهرة المعرضة للاتقاط العدوى.
يمكن إعادة كتابة S على الشكل (1 - p) حيث p هو نسبة الأفراد الذين لديهم مناعة وp + S يساوي واحد. وبعدها إعادة صياغة المعادلة لمعرفة ماذا يساوي P وحده:
→ →
مع كون p وحده في يسار المعادلة، يمكن الآن كتابته pc لتمثيل النسبة الحاسمة من الجمهرة المطلوبِ اكتسابها للمناعة كي يتوقف انتشار المرض، أو «عتبة المناعة الجماعية».[9] يعمل R0 كقياس لمدى العدوى، لذلك القيم الصغيرة لـR0 تصاحبها قيم صغيرة من عتبات المناعة الجماعية والعكس بالعكس.[29][42] على سبيل المثال عتبة المناعة الجماعية التي عدد التكاثر الأساسي للمرض فيها R0 هو 2 نظريا 50% فقط، في مرضٍ يكون فيه R0 يساوي 10 عتبة المناعة الجماعية فيه تكون 90%.[29]
تفترض هذه الحسابات أن جميع الجمهرة عرضة للعدوى، أي لا يوجد أفراد لديهم مناعة ضد المرض. في الواقع، نسب مختلفة من الجمهرة تملك مناعة ضد أي مرض معين في أي وقت معين.[9] لأخذ ذلك في الحسبان، عدد التكاثر المؤثر Re الذي يكتب كذلك كـRt -متوسط عدد الإصابات بالعدوى في زمن t- يمكن حسابه بضرب R0 في جزء الجمهرة الذي مازال عرضة للعدوى. عندما يُخفض Re ويحافظ عليه أسفل 1، تنخفض عدد الإصابات التي تحدث في الجمهرة تدريجيا حتى يُقضى على المرض.[9][29][56] لو كانت جمهرة ما منيعة ضد مرض ما فإنه فضلا عن عتبة المناعة الجماعية ينخفض كذلك عدد الإصابات بمعدل أسرع، واحتمال حدوث التفشيات يكون أقل، والتفشيات التي تحدث تكون أقل حدة من الحالة التي تكون فيها الجمهرة غير منيعة.[1][9] إذا ارتفع Re وصار أكبر من واحد فحينها لا يكون المرض في حالة مسستقرة ولا في انخفاض، بل ينتشر بسرعة بين الجمهرة ويصيب أعداد أكبر من العادة من الأفراد.[43][56]
افتراض آخر في هذه الحسابات هي أن الجمهرات متجانسةٌ -أو مختلطة جيدا- أي أن كل فرد يتواصل مع كل فرد آخر، لكن في الواقع الجمهرات التي توصف بأنها شبكات اجتماعية وأفراد يميلون إلى التجمع معا، تبقى في اتصال مغلق نسبيا مع عدد محدود من الأفراد الآخرين. في هذه الشبكات، لا يحدث الانتقال سوى بين الأفراد القريبين فيزيائيا أو جغرافيا من بعضهم البعض.[1][42][43] يمكن لشكل وحجم الشبكة على الأرجح تغير عتبة المناعة الجماعية الخاصة بالمرض، ما يجعل انتشاره يزيد أو ينقص.[29][42]
في الجمهرات غير المتجانسة، يعتبر R0 مقياسا لعدد الحالات التي يُحدثها شخص معدٍ «نموذجي»، والذي يعتمد على طريقة تآثر الأفراد مع بعضهم داخل الشبكة الاجتماعية.[1] التآثرات داخل الشبكات أكثر شيوعا منها بين الشبكات، وبالتالي الشبكات الأكثر تآثرا ينتقل المرض فيها بيسر أكبر، وينتج عن ذلك R0 أكبر وعتبة مناعة قطيع أكبر مما هو لدى الشبكات التي أفرادها في تواصل أقل.[1][43] في الشبكات التي تختار أن لا تكون منيعة أو ليست لديها مناعة كافية، يمكن أن تستمر الأمراض فيها رغم عدم تواجدها في شبكات أخرى ذات مناعة أفضل.[43]
تجاوز الحد
قد تتجاوز النسبة التراكمية للأفراد الذين يصابون بالعدوى أثناء تفشي المرض عتبة المناعة الجماعية (HIT)؛ وذلك لأنَّ هذه العتبة لا تمثل النقطة التي يتوقف عندها المرض عن الانتشار، بل النقطة التي يصيب فيها كل شخص مصاب أقل من شخص إضافي في المتوسط. عندما يتم الوصول إلى عتبة المناعة الجماعية، يبدأ عدد الإصابات الإضافية في التلاشي، لكنه لا ينخفض على الفور إلى الصفر. يُعرف الفرق بين النسبة التراكمية للأفراد المصابين والعتبة النظرية للمناعة الجماعية باسم تجاوز الحد (بالإنجليزية: overshoot).[57][58][59]
طرق التعزيز
التلقيح
السبيل الرئيسي لتعزيز مستويات المناعة في جمهرة ما هو عبر التلقيح.[1][60] اعتمد التلقيح في الأصل على ملاحظة أن العاملات في حلب البقر اللواتي تعرضن لجدري البقر كن منيعات ضد الجدري، لذلك بدأت ممارسة تلقيح الناس بجدري البقر كطريقة لمنع إصابتهم بالجدري.[41] توفر اللقاحات المطورة جيدا الحماية بطريقة أكثر أمانا بكثير من الإصابة الطبيعة بالمرض، وذلك لأن اللقاحات في العادة لا تسبب الأمراض التي تحمي ضدها والآثار السلبية الضارة أقل شيوعا بكثير من التعقيدات التي تسببها الإصابات الطبيعية.[61][62]
لا يميز جهاز المناعة بين العدوى الطبيعية واللقاحات ويحدث استجابة نشطة لكليهما، لذلك المناعة المحدَثة عبر التلقيح مماثلة لما كان سيحدث عند الإصابة بالمرض والشفاء منه.[63] لتحقيق المناعة الجماعية عبر التلقيح، يهدف مصنعو اللقاح إلى إنتاج لقاحات ذات معدلات فشل منخفضة وصناع السياسة يهدفون لتشجيع استخدامها.[60] بعد التقديم الناجح لاستخدام اللقاح والانتشار الكبير له، لوحظ انخفاض حاد في حدوث الأمراض التي تحمي ضدها وكذلك عدد الحالات التي أدخلت للمستشفى والوفيات التي تسببها هذه الأمراض.[64][65][66]
بافتراض أن اللقاح فعال 100%، حينها يمكن استخدام المعادلة المستخدمة في حساب عتبة المناعة الجماعية لحساب مستوى التلقيح المطلوب للقضاء على المرض ويرمز له Vc.[1] اللقاحات في العادة غير مثالية لذلك الفعالية E للقاح ما يجب أن تؤخذ في الحسبان:
من هذه المعادلة، يمكن ملاحظة أنه إذا كان E أقل من (1 − 1/R0) حينها من المستحيل القضاء على المرض حتى لو كانت جميع الجمهرة قد أخذت اللقاح.[1] بالمثل، انخفاض المناعة المحدَثة باللقاح كما هو الحال مع لقاحات السعال الديكي، يتطلب مستويات أعلى من التلقيح المعزز للحفاظ على المناعة الجماعية.[1][20] لو توقف مرض عن كونه متوطنا في جمهرة ما، حينها لن تصبح الإصابات الطبيعية مساهمةً في تخفيض نسبة الأفراد المعرضين للمرض، فقط التلقيح هو من يساهم في هذا التخفيض.[9] العلاقة بين التغطية بالتلقيح وفعاليته وحدوث المرض يمكن أن توضَّح بطرح ناتج ضرب فعالية اللقاح ونسبة الأفراد الذين تم تلقيحهم (pv) من معادلة عتبة المناعة الجماعية كما يلي:
يمكن من هذه المعادلة ملاحظة أن (ثبات باقي العوامل) أي ارتفاعٍ سواء في التغطية باللقاح أو فعاليته بما في ذلك أي زيادة في فائض عتبة المناعة الجماعية لمرض ما، يخفض أكثر عدد حالات المرض.[9] يعتمد معدل انخفاض الحالات على R0 الخاص بالمرض، فالأمراض ذات قيم R0 المنخفضة تكون فيها الانخفاضات حادة.[9] للقاحات عادة مضاد استطباب واحد على الأقل لأفراد محددين لأسباب طبية، لكن لو كانت التغطية والفعالية عالية كفاية يمكن لالمناعة الجماعية حماية هؤلاء الأفراد.[14][16][19] فعالية اللقاح أحيانا -وليس دائما- تتأثر بشكل معاكس وسلبي بالمناعة السلبية،[67][68] لذلك يوصى بجرعات إضافية لبعض اللقاحات في حين أن بعض اللقاحات الأخرى لا يجب أن تؤخذ منها جرعات إضافية حتى يفقد الفرد مناعته السلبية.[15][19]
المناعة السلبية
يمكن أن تُكتسَب مناعة الفرد كذلك سلبيا عبر نقل الأجسام المضادة لممراض من فرد لآخر. يمكن أن يحدث هذا طبيعيا كما في حالة الأجسام المضادة الخاصة بالأم -بشكل أساسي الغلوبين المناعي ج- التي تُنقل عبر المشيمة وعبر اللبأ إلى الأجنة وحديثي الولادة،[69][70] أو اصطناعيا عبر حقن أجسام مضادة من مصل أو بلازما فرد عنده مناعة لفرد آخر معرض للعدوى.[63][71] الحماية الناشئة من المناعة السلبية مباشرة الحدوث لكنها تتضائل في غضون أسابيع إلى أشهر، لذلك أي مساهمة لها في المناعة الجماعية تكون مؤقتة.[5][63][72] بالنسبة للأمراض الحادة بشكل خاص بين الأجنة وحديثي الولادة مثل الإنفلونزا والكزاز، يمكن أن تلقح النساء الحوامل ضدها لكي ينقلن الأجسام المضادة للأطفال.[14][73][74] بالمثل، مجموعات الأفراد ذات الخطر المرتفع التي يمكن على الأرجح أن تحدث إصابتها بالعدوى أو التي لها قابلية أكبر في تطوير مضاعفات من العدوى يمكن أن تحصل على الأجسام المضادة من الأفراد الذين لديهم مناعة لمنع العدوى من الانتقال إليهم أو التخفيض من حدة أعراضها.[71]
تحليل التكاليف مقابل الفوائد
تؤخذ المناعة الجماعية في الحسبان غالبا عند إجراء تحليل التكلفة والفائدة لبرامج التلقيح. وتعتبر كعامل خارجي إيجابي لمستويات المناعية العالية، وتُنتج فائدة إضافية من خفض المرض ما كنت لتحدث لو لم تُولَّد المناعة الجماعية بين الجمهرة.[75][76] لذلك إدخال المناعة الجماعية في حسابات التكلفة والفائدة ينتج عنه فعالية تكلفة أو نسب تكلفة وفائدة مفضلتين، وزيادة في حالات المرض التي تم تفاديها بالتلقيح.[76] تشمل الدراسات التصميمية التي أجريت لتقدير فائدة المناعة الجماعية تسجيل حدوث المرض في البيوت التي يكون لأحد أفرادها مناعة -عشوأة جمهرة في منطقة جغرافية واحدة ليتم تلقيحها أو لا- وملاحظة حدوث المرض قبل وبعد برنامج التلقيح المقدم.[77] وبعد ذلك يمكن ملاحظة أن حدوث المرض يمكن أن ينخفض إلى مستوى يتجاوز ما يمكن توقعه من الحماية المباشرة وحدها، وهذا يشير إلى أن المناعة الجماعية تساهم في التخفيض.[77] عندما يؤخذ النمط المصلي في الحسبان فإنه يخفض الفوائد المتوقعة من التلقيح.[76]
التاريخ
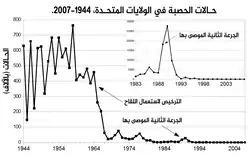
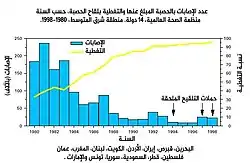
استخدم مصطلح المناعة الجماعية أول مرة سنة 1923 للإشارة إلى مناعة الجمهرة الإجمالية، في بحث يفحص معدل الوفاة بالمرض لدى جمهرات فئرانٍ ذات درجات مناعة مختلفة.[78] اعتُرف أول مرة بأن المناعة الجماعية ظاهرة تحدث طبيعيا في العقد 1930 عندما نشر أ.و.هيدريش بحثا حول وبائية الحصبة في بالتيمور ولوحظ بعد أن أصبح العديد من الأطفال محصنين ضد الحصبة، انخفاض عدد الحالات الجديدة بشكل مؤقت، بما في ذلك بين الأطفال المعرضين للعدوى.[8] على الرغم من معرفة هذا الأمر، لم تكن جهود التحكم في الحصبة والقضاء عليها ناجحة حتى بدأ التلقح واسع النطاق والمكثف باستخدام لقاح الحصبة في العقد 1960.[8] التلقيح المكثف والنقاشات حول القضاء على المرض وتحاليل التكلفة والفائدة ساهمت في انتشار استخدام مصطلح «المناعة الجماعية».[1] في العقد 1970 طُوِّرت المبرهنة التي استُخدمت لحساب عتبة المناعة الجماعية لمرض ما.[1] أثناء حملة القضاء على الجدري في ستينات وسبعينات القرن الماضي، كانت ممارسة التلقيح الحلقي التي كانت المناعة الجماعية جزء منها قد بدأت لتحصين كل شخص في «حلقة» حول فرد مصاب بالعدوى لمنع التفشيات من الانتشار.[79]
منذ تبني التلقيح المكثف والحلقي، نشأت تعقيدات وتحديات لالمناعة الجماعية.[1][60] نمذجة انتشار المرض المعدي كانت تتم في البداية بافتراضات عديدة أهمها أن جميع أفراد الجمهرة عرضة للمرض وأنهم متصلون ببعضهم جيدا، وهو أمر غير صحيح في الواقع، لذلك تم تطوير معادلات أكثر دقة.[1] في العقود الأخيرة وبسبب تصرف المناعة الجماعية كضغط تطوري أو بسبب المناعة الجماعية ضد سلالة واحدة يمكن لسلالة أخرى سابقة الوجود الانتشار بين الأفراد.[31][37] خفّضت الجدلات والخلافات المستجدة أو الجارية حول اللقاحات ومختلف الأسباب لمعارضة التلقيح المناعة الجماعية أو قضت عليها في بعض المجتمعات، وهو ما يسمح للأمراض التي يمكن الوقاية منها بالعودة إلى هذه المجتمعات والاستمرار فيها.[10][11][12]
الهوامش
1. المناعة الجماعية[ِ 1] أو مناعة القَطِيع[ِ 2][ِ 3][ِ 4] أو مناعة قطيعية[ِ 5][ِ 3][ِ 4] (بالإنجليزية: Herd immunity) أو تأثير القطيع (بالإنجليزية: herd effect) أو مناعة المجتمع أو مناعة الجماعة أو مناعة مجتمعية[ِ 6][ِ 7][ِ 8] (بالإنجليزية: community immunity) أو مناعة السكان أو مناعة سكانية (بالإنجليزية: population immunity) أو مناعة اجتماعية (بالإنجليزية: social immunity).
المراجع
باللغة الإنجليزية
- Fine, P.؛ Eames, K.؛ Heymann, D. L. (1 أبريل 2011)، "'Herd immunity': A rough guide"، Clinical Infectious Diseases، 52 (7): 911–16، doi:10.1093/cid/cir007، PMID 21427399، مؤرشف من الأصل في 23 ديسمبر 2016.
- Gordis, L. (14 نوفمبر 2013)، Epidemiology، Elsevier Health Sciences، ص. 26–27، ISBN 978-1455742516، مؤرشف من الأصل في 24 أبريل 2017، اطلع عليه بتاريخ 29 مارس 2015.
- Merrill, R. M. (2013)، Introduction to Epidemiology، Jones & Bartlett Publishers، ص. 68–71، ISBN 978-1449645175، مؤرشف من الأصل في 10 يونيو 2019، اطلع عليه بتاريخ 29 مارس 2015.
- "Herd Immunity"، Oxford Vaccine Group, University of Oxford، مؤرشف من الأصل في 2 أغسطس 2019، اطلع عليه بتاريخ 12 ديسمبر 2017.
- Somerville, M.؛ Kumaran, K.؛ Anderson, R. (19 يناير 2012)، Public Health and Epidemiology at a Glance، John Wiley & Sons، ص. 58–59، ISBN 978-1118308646، مؤرشف من الأصل في 23 أبريل 2017، اطلع عليه بتاريخ 29 مارس 2015.
- Cliff, A.؛ Smallman-Raynor, M. (11 أبريل 2013)، Oxford Textbook of Infectious Disease Control: A Geographical Analysis from Medieval Quarantine to Global Eradication، Oxford University Press، ص. 125–36، ISBN 978-0199596614، مؤرشف من الأصل في 23 أبريل 2017، اطلع عليه بتاريخ 29 مارس 2015.
- Kim, T. H.؛ Jonhstone, J.؛ Loeb, M. (سبتمبر 2011)، "Vaccine herd effect"، Scandinavian Journal of Infectious Diseases، 43 (9): 683–89، doi:10.3109/00365548.2011.582247، PMC 3171704، PMID 21604922.
-
- Hinman, A. R.؛ Orenstein, W. A.؛ Papania, M. J. (1 مايو 2004)، "Evolution of measles elimination strategies in the United States"، The Journal of Infectious Diseases، 189 (Suppl 1): S17–22، doi:10.1086/377694، PMID 15106084.
*Sencer, D. J.؛ Dull, H. B.؛ Langmuir, A. D. (مارس 1967)، "Epidemiologic basis for eradication of measles in 1967"، Public Health Reports، 82 (3): 253–56، doi:10.2307/4592985، JSTOR 4592985، PMC 1919891، PMID 4960501، مؤرشف من الأصل في 18 سبتمبر 2015.
- Hinman, A. R.؛ Orenstein, W. A.؛ Papania, M. J. (1 مايو 2004)، "Evolution of measles elimination strategies in the United States"، The Journal of Infectious Diseases، 189 (Suppl 1): S17–22، doi:10.1086/377694، PMID 15106084.
- Garnett, G. P. (1 فبراير 2005)، "Role of Herd Immunity in Determining the Effect of Vaccines against Sexually Transmitted Disease"، The Journal of Infectious Diseases، 191 (Suppl 1): S97–106، doi:10.1086/425271، PMID 15627236، مؤرشف من الأصل في 23 أكتوبر 2016.
- Quadri-Sheriff, M.؛ Hendrix, K. S.؛ Downs, S. M.؛ Sturm, L. A.؛ Zimet, G. D.؛ Finnell, S. M. (سبتمبر 2012)، "The role of herd immunity in parents' decision to vaccinate children: a systematic review"، Pediatrics، 130 (3): 522–30، doi:10.1542/peds.2012-0140، PMID 22926181، مؤرشف من الأصل في 12 يونيو 2019.
- Dubé, E.؛ Laberge, C.؛ Guay, M.؛ Bramadat, P.؛ Roy, R.؛ Bettinger, J. (أغسطس 2013)، "Vaccine hesitancy: an overview"، Human Vaccines & Immunotherapeutics، 9 (8): 1763–73، doi:10.4161/hv.24657، PMC 3906279، PMID 23584253.
- Ropeik, D. (أغسطس 2013)، "How society should respond to the risk of vaccine rejection"، Human Vaccines & Immunotherapeutics، 9 (8): 1815–18، doi:10.4161/hv.25250، PMC 3906287، PMID 23807359.
- Cesaro, S.; Giacchino, M.; Fioredda, F.; Barone, A.; Battisti, L.; Bezzio, S.; Frenos, S.; De Santis, R.; Livadiotti, S.; Marinello, S.; Zanazzo, A. G.; Caselli, D. (2014)، "Guidelines on vaccinations in paediatric haematology and oncology patients"، Biomed Res. Int.، 2014: 707691، doi:10.1155/2014/707691، PMC 4020520، PMID 24868544.
- Munoz, F. M. (2013)، "Maternal immunization: An update for pediatricians"، Pediatric Annals، 42 (8): 153–58، doi:10.3928/00904481-20130723-09، PMID 23910028.
- National Center for Immunization and Respiratory Diseases (2011)، "General recommendations on immunization – recommendations of the Advisory Committee on Immunization Practices (ACIP)"، MMWR. Recommendations and Reports / Centers for Disease Control، 60 (2): 1–64، PMID 21293327.
- Wolfe, R. M. (2012)، "Update on adult immunizations"، The Journal of the American Board of Family Medicine، 25 (4): 496–510، doi:10.3122/jabfm.2012.04.100274، PMID 22773718.
- Esposito, S؛ Bosis, S؛ Morlacchi, L؛ Baggi, E؛ Sabatini, C؛ Principi, N (2012)، "Can infants be protected by means of maternal vaccination?"، Clinical Microbiology and Infection، 18 Suppl 5: 85–92، doi:10.1111/j.1469-0691.2012.03936.x، PMID 22862749.
- Rakel, D.؛ Rakel, R. E. (2015)، Textbook of Family Medicine، Elsevier Health Sciences، ص. 99, 187، ISBN 978-0323313087، مؤرشف من الأصل في 24 أبريل 2017، اطلع عليه بتاريخ 30 مارس 2015.
- Tulchinsky, T. H.؛ Varavikova, E. A. (26 مارس 2014)، The New Public Health: An Introduction for the 21st Century، Academic Press، ص. 163–82، ISBN 978-0124157675، مؤرشف من الأصل في 23 أبريل 2017، اطلع عليه بتاريخ 30 مارس 2015.
- McGirr, A؛ Fisman, D. N. (2015)، "Duration of Pertussis Immunity After DTaP Immunization: A Meta-analysis"، Pediatrics، 135 (2): 331–43، doi:10.1542/peds.2014-1729، PMID 25560446.
- Zepp, F؛ Heininger, U؛ Mertsola, J؛ Bernatowska, E؛ Guiso, N؛ Roord, J؛ Tozzi, A. E.؛ Van Damme, P (2011)، "Rationale for pertussis booster vaccination throughout life in Europe"، The Lancet Infectious Diseases، 11 (7): 557–70، doi:10.1016/S1473-3099(11)70007-X، PMID 21600850.
- Pittet, L. F.؛ Posfay-Barbe, K. M. (2012)، "Pneumococcal vaccines for children: A global public health priority"، Clinical Microbiology and Infection، 18 Suppl 5: 25–36، doi:10.1111/j.1469-0691.2012.03938.x، PMID 22862432.
- Nakagomi, O؛ Iturriza-Gomara, M؛ Nakagomi, T؛ Cunliffe, N. A. (2013)، "Incorporation of a rotavirus vaccine into the national immunisation schedule in the United Kingdom: A review"، Expert Opinion on Biological Therapy، 13 (11): 1613–21، doi:10.1517/14712598.2013.840285، PMID 24088009.
- Lopman, B. A.؛ Payne, D. C.؛ Tate, J. E.؛ Patel, M. M.؛ Cortese, M. M.؛ Parashar, U. D. (2012)، "Post-licensure experience with rotavirus vaccination in high and middle income countries; 2006 to 2011"، Current Opinion in Virology، 2 (4): 434–42، doi:10.1016/j.coviro.2012.05.002، PMID 22749491، مؤرشف من الأصل في 16 أكتوبر 2019.
- Kim, T. H. (2014)، "Seasonal influenza and vaccine herd effect"، Clinical and Experimental Vaccine Research، 3 (2): 128–32، doi:10.7774/cevr.2014.3.2.128، PMC 4083064، PMID 25003085.
- Lowy, D. R.؛ Schiller, J. T. (2012)، "Reducing HPV-associated cancer globally"، Cancer Prevention Research، 5 (1): 18–23، doi:10.1158/1940-6207.CAPR-11-0542، PMC 3285475، PMID 22219162.
- Lenzi, A؛ Mirone, V؛ Gentile, V؛ Bartoletti, R؛ Ficarra, V؛ Foresta, C؛ Mariani, L؛ Mazzoli, S؛ Parisi, S. G.؛ Perino, A؛ Picardo, M؛ Zotti, C. M. (2013)، "Rome Consensus Conference – statement; human papilloma virus diseases in males"، BMC Public Health، 13: 117، doi:10.1186/1471-2458-13-117، PMC 3642007، PMID 23391351.
- Garland, S. M.؛ Skinner, S. R.؛ Brotherton, J. M. (2011)، "Adolescent and young adult HPV vaccination in Australia: Achievements and challenges"، Preventive Medicine، 53 Suppl 1: S29–35، doi:10.1016/j.ypmed.2011.08.015، PMID 21962468.
- Rodpothong, P؛ Auewarakul, P (2012)، "Viral evolution and transmission effectiveness"، World Journal of Virology، 1 (5): 131–34، doi:10.5501/wjv.v1.i5.131، PMC 3782273، PMID 24175217.
- Corti, D؛ Lanzavecchia, A (2013)، "Broadly neutralizing antiviral antibodies"، Annual Review of Immunology، 31: 705–42، doi:10.1146/annurev-immunol-032712-095916، PMID 23330954.
- Bull, R. A.؛ White, P. A. (2011)، "Mechanisms of GII.4 norovirus evolution"، Trends in Microbiology، 19 (5): 233–40، doi:10.1016/j.tim.2011.01.002، PMID 21310617.
- Ramani, S؛ Atmar, R. L.؛ Estes, M. K. (2014)، "Epidemiology of human noroviruses and updates on vaccine development"، Current Opinion in Gastroenterology، 30 (1): 25–33، doi:10.1097/MOG.0000000000000022، PMC 3955997، PMID 24232370.
- Pleschka, S (2013)، "Overview of Influenza Viruses"، Swine Influenza، Current Topics in Microbiology and Immunology، ج. 370، ص. 1–20، doi:10.1007/82_2012_272، ISBN 978-3642368707، PMID 23124938.
- Han, T؛ Marasco, W. A. (2011)، "Structural basis of influenza virus neutralization"، Annals of the New York Academy of Sciences، 1217: 178–90، doi:10.1111/j.1749-6632.2010.05829.x، PMC 3062959، PMID 21251008.
- Reperant, L. A.؛ Rimmelzwaan, G. F.؛ Osterhaus, A. D. (2014)، "Advances in influenza vaccination"، F1000Prime Reports، 6: 47، doi:10.12703/p6-47، PMC 4047948، PMID 24991424.
- Weinberger, D. M.؛ Malley, R؛ Lipsitch, M (2011)، "Serotype replacement in disease after pneumococcal vaccination"، The Lancet، 378 (9807): 1962–73، doi:10.1016/S0140-6736(10)62225-8، PMC 3256741، PMID 21492929.
- McEllistrem, M. C.؛ Nahm, M. H. (2012)، "Novel pneumococcal serotypes 6C and 6D: Anomaly or harbinger"، Clinical Infectious Diseases، 55 (10): 1379–86، doi:10.1093/cid/cis691، PMC 3478140، PMID 22903767.
- Dagan, R (2009)، "Impact of pneumococcal conjugate vaccine on infections caused by antibiotic-resistant Streptococcus pneumoniae"، Clinical Microbiology and Infection، 15 Suppl 3: 16–20، doi:10.1111/j.1469-0691.2009.02726.x، PMID 19366365.
- Lynch Jp, 3rd؛ Zhanel, G. G. (2010)، "Streptococcus pneumoniae: Epidemiology and risk factors, evolution of antimicrobial resistance, and impact of vaccines"، Current Opinion in Pulmonary Medicine، 16 (3): 217–25، doi:10.1097/MCP.0b013e3283385653، PMID 20375783.
- Njeumi, F؛ Taylor, W؛ Diallo, A؛ Miyagishima, K؛ Pastoret, P. P.؛ Vallat, B؛ Traore, M (2012)، "The long journey: A brief review of the eradication of rinderpest"، Revue Scientifique et Technique (International Office of Epizootics)، 31 (3): 729–46، PMID 23520729.
- Smith, K. A. (2013)، "Smallpox: Can we still learn from the journey to eradication?"، The Indian Journal of Medical Research، 137 (5): 895–99، PMC 3734679، PMID 23760373.
- Perisic, A؛ Bauch, C. T. (2009)، "Social contact networks and disease eradicability under voluntary vaccination"، PLoS Computational Biology، 5 (2): e1000280، doi:10.1371/journal.pcbi.1000280، PMC 2625434، PMID 19197342.
- Fu, F؛ Rosenbloom, D. I.؛ Wang, L؛ Nowak, M. A. (2011)، "Imitation dynamics of vaccination behaviour on social networks" (PDF)، Proceedings of the Royal Society B: Biological Sciences، 278 (1702): 42–49، doi:10.1098/rspb.2010.1107، PMC 2992723، PMID 20667876، مؤرشف من الأصل (PDF) في 04 نوفمبر 2018.
- Wicker, S؛ Maltezou, H. C. (2014)، "Vaccine-preventable diseases in Europe: Where do we stand?"، Expert Review of Vaccines، 13 (8): 979–87، doi:10.1586/14760584.2014.933077، PMID 24958075.
- Fukuda, E.؛ Tanimoto, J. (2014)، Impact of Stubborn Individuals on a Spread of Infectious Disease under Voluntary Vaccination Policy، Springer، ص. 1–10، ISBN 978-3319133591، مؤرشف من الأصل في 24 يونيو 2016، اطلع عليه بتاريخ 30 مارس 2015.
- Barrett, Scott (2014)، "Global Public Goods and International Development"، Too Global To Fail: The World Bank at the Intersection of National and Global Public Policy in 2025، World Bank Publications، ص. 13–18، ISBN 978-1464803109.
- Gowda, C؛ Dempsey, A. F. (2013)، "The rise (and fall?) of parental vaccine hesitancy"، Human Vaccines & Immunotherapeutics، 9 (8): 1755–62، doi:10.4161/hv.25085، PMC 3906278، PMID 23744504.
- Ozawa, S؛ Stack, M. L. (2013)، "Public trust and vaccine acceptance – international perspectives"، Human Vaccines & Immunotherapeutics، 9 (8): 1774–78، doi:10.4161/hv.24961، PMC 3906280، PMID 23733039.
- Parker, A. M.؛ Vardavas, R؛ Marcum, C. S.؛ Gidengil, C. A. (2013)، "Conscious consideration of herd immunity in influenza vaccination decisions"، American Journal of Preventive Medicine، 45 (1): 118–21، doi:10.1016/j.amepre.2013.02.016، PMC 3694502، PMID 23790997.
- Unless noted, R0 values are from: History and Epidemiology of Global Smallpox Eradication نسخة محفوظة 2017-03-17 على موقع واي باك مشين. From the training course titled "Smallpox: Disease, Prevention, and Intervention". The مراكز مكافحة الأمراض واتقائها and the منظمة الصحة العالمية. Slide 17. Retrieved 13 March 2015.
- Biggerstaff, M؛ Cauchemez, S؛ Reed, C؛ Gambhir, M؛ Finelli, L (2014)، "Estimates of the reproduction number for seasonal, pandemic, and zoonotic influenza: A systematic review of the literature"، BMC Infectious Diseases، 14: 480، doi:10.1186/1471-2334-14-480، PMC 4169819، PMID 25186370.
- Wallinga, J؛ Teunis, P (2004)، "Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures"، American Journal of Epidemiology، 160 (6): 509–16، doi:10.1093/aje/kwh255، PMID 15353409.
- "Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia"، نيو إنغلاند جورنال أوف ميديسين، يناير 2020، doi:10.1056/NEJMoa2001316، PMID 31995857.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - "Pattern of early human-to-human transmission of Wuhan 2019 novel coronavirus (2019-nCoV), December 2019 to January 2020"، Euro Surveillance، 25 (4)، يناير 2020، doi:10.2807/1560-7917.ES.2020.25.4.2000058، PMC 7001239، PMID 32019669.
- Althaus, C. L. (2014)، "Estimating the Reproduction Number of Ebola Virus (EBOV) During the 2014 Outbreak in West Africa"، PLoS Currents، 6، doi:10.1371/currents.outbreaks.91afb5e0f279e7f29e7056095255b288، PMC 4169395، PMID 25642364.
- Dabbaghian, V.؛ Mago, V. K. (27 أكتوبر 2013)، Theories and Simulations of Complex Social Systems، Springer، ص. 134–35، ISBN 978-3642391491، مؤرشف من الأصل في 23 أبريل 2017، اطلع عليه بتاريخ 29 مارس 2015.
- Handel, Andreas؛ Longini, Ira M؛ Antia, Rustom (22 مارس 2007)، "What is the best control strategy for multiple infectious disease outbreaks?"، Proceedings of the Royal Society B: Biological Sciences، 274 (1611): 833–837، doi:10.1098/rspb.2006.0015، ISSN 0962-8452، PMC 2093965، PMID 17251095، مؤرشف من الأصل في 9 يونيو 2020،
In general, the number of infecteds grows until the number of susceptibles has fallen to Sth. At this point, the average number of secondary infections created by an infected person drops below 1 and therefore the number of infecteds starts to decrease. However, right at this inflection point, the maximum number of infecteds is present. These infecteds will create on average less than 1, but still more than zero further infections, leading to additional depletion of susceptibles and therefore causing an overshoot.
- Fung, Isaac Chun-Hai؛ Antia, Rustom؛ Handel, Andreas (11 يونيو 2012)، "How to Minimize the Attack Rate during Multiple Influenza Outbreaks in a Heterogeneous Population"، PLoS ONE، 7 (6)، doi:10.1371/journal.pone.0036573، ISSN 1932-6203، PMC 3372524، PMID 22701558، مؤرشف من الأصل في 23 مارس 2020.
- Bergstrom, Carl T.؛ Dean, Natalie (1 مايو 2020)، "Opinion: What the Proponents of 'Natural' Herd Immunity Don't Say"، The New York Times (باللغة الإنجليزية)، ISSN 0362-4331، مؤرشف من الأصل في 3 يونيو 2020، اطلع عليه بتاريخ 30 مايو 2020.
- Rashid, H؛ Khandaker, G؛ Booy, R (2012)، "Vaccination and herd immunity: What more do we know?"، Current Opinion in Infectious Diseases، 25 (3): 243–49، doi:10.1097/QCO.0b013e328352f727، PMID 22561998.
- Maglione, M. A.؛ Das, L؛ Raaen, L؛ Smith, A؛ Chari, R؛ Newberry, S؛ Shanman, R؛ Perry, T؛ Goetz, M. B.؛ Gidengil, C (2014)، "Safety of vaccines used for routine immunization of U.S. Children: A systematic review"، Pediatrics، 134 (2): 325–37، doi:10.1542/peds.2014-1079، PMID 25086160، مؤرشف من الأصل في 30 يناير 2020.
- Demicheli, V؛ Rivetti, A؛ Debalini, M. G.؛ Di Pietrantonj, C (2012)، "Vaccines for measles, mumps and rubella in children"، Cochrane Database of Systematic Reviews، The Cochrane Database of Systematic Reviews، ج. 2، ص. CD004407، doi:10.1002/14651858.CD004407.pub3، PMC 6458016، PMID 22336803.
- Pommerville, J. C. (2 ديسمبر 2014)، Fundamentals of Microbiology: Body Systems Edition، Jones & Bartlett Publishers، ص. 559–63، ISBN 978-1284057102، مؤرشف من الأصل في 23 أبريل 2017، اطلع عليه بتاريخ 30 مارس 2015.
- Papaloukas, O؛ Giannouli, G؛ Papaevangelou, V (2014)، "Successes and challenges in varicella vaccine"، Therapeutic Advances in Vaccines، 2 (2): 39–55، doi:10.1177/2051013613515621، PMC 3991154، PMID 24757524.
- Shann, F (2013)، "Nonspecific effects of vaccines and the reduction of mortality in children"، Clinical Therapeutics، 35 (2): 109–14، doi:10.1016/j.clinthera.2013.01.007، PMID 23375475.
- Visser, A؛ Hoosen, A (2012)، "Haemophilus influenzae type b conjugate vaccines - a South African perspective"، Vaccine، 30 Suppl 3: C52–57، doi:10.1016/j.vaccine.2012.06.022، hdl:2263/20792، PMID 22939022.
- Leuridan, E؛ Sabbe, M؛ Van Damme, P (2012)، "Measles outbreak in Europe: Susceptibility of infants too young to be immunized"، Vaccine، 30 (41): 5905–13، doi:10.1016/j.vaccine.2012.07.035، PMID 22841972.
- Hodgins, D. C.؛ Shewen, P. E. (2012)، "Vaccination of neonates: Problem and issues"، Vaccine، 30 (9): 1541–59، doi:10.1016/j.vaccine.2011.12.047، PMID 22189699.
- Chucri, T. M.؛ Monteiro, J. M.؛ Lima, A. R.؛ Salvadori, M. L.؛ Kfoury Jr, J. R.؛ Miglino, M. A. (2010)، "A review of immune transfer by the placenta"، Journal of Reproductive Immunology، 87 (1–2): 14–20، doi:10.1016/j.jri.2010.08.062، PMID 20956021.
- Palmeira, P؛ Quinello, C؛ Silveira-Lessa, A. L.؛ Zago, C. A.؛ Carneiro-Sampaio, M (2012)، "IgG placental transfer in healthy and pathological pregnancies"، Clinical and Developmental Immunology، 2012: 1–13، doi:10.1155/2012/985646، PMC 3251916، PMID 22235228.
- Parija, S. C. (10 فبراير 2014)، Textbook of Microbiology & Immunology، Elsevier Health Sciences، ص. 88–89، ISBN 978-8131236246، مؤرشف من الأصل في 24 أبريل 2017، اطلع عليه بتاريخ 30 مارس 2015.
- Detels, R.؛ Gulliford, M.؛ Karim, Q. A.؛ Tan, C. C. (1 فبراير 2015)، Oxford Textbook of Global Public Health، Oxford University Press، ص. 1490، ISBN 978-0199661756، مؤرشف من الأصل في 25 أبريل 2016، اطلع عليه بتاريخ 30 مارس 2015.
- Demicheli, Vittorio؛ Barale, Antonella؛ Rivetti, Alessandro (06 يوليو 2015)، "Vaccines for women for preventing neonatal tetanus"، The Cochrane Database of Systematic Reviews (7): CD002959، doi:10.1002/14651858.CD002959.pub4، ISSN 1469-493X، PMID 26144877.
- Swamy, G. K.؛ Garcia-Putnam, R (2013)، "Vaccine-preventable diseases in pregnancy"، American Journal of Perinatology، 30 (2): 89–97، doi:10.1055/s-0032-1331032، PMID 23271378.
- Bärnighausen, T.; Bloom, D. E.; Cafiero-Fonseca, E. T.; O'Brien, J. C. (26 أغسطس 2014)، "Valuing vaccination"، Proc Natl Acad Sci U S A، 111 (34): 12313–1 9، doi:10.1073/pnas.1400475111، PMC 4151736، PMID 25136129.
- Deogaonkar, R.; Hutubessy, R.; van der Putten I.; Evers S.; Jit M. (16 أكتوبر 2012)، "Systematic review of studies evaluating the broader economic impact of vaccination in low and middle income countries"، BMC Public Health، 12: 878، doi:10.1186/1471-2458-12-878، PMC 3532196، PMID 23072714.
- Jit, M.; Newall, A. T.; Beutels, P. (أبريل 2013)، "Key issues for estimating the impact and cost-effectiveness of seasonal influenza vaccination strategies"، Hum Vaccin Immunother، 9 (4): 834–40، doi:10.4161/hv.23637، PMC 3903903، PMID 23357859.
- Topley, W. W. C.؛ Wilson, G. S. (مايو 1923)، "The Spread of Bacterial Infection. The Problem of Herd-Immunity"، The Journal of Hygiene، 21 (3): 243–249، doi:10.1017/s0022172400031478، PMC 2167341، PMID 20474777.
- Strassburg, M. A. (1982)، "The global eradication of smallpox"، American Journal of Infection Control، 10 (2): 53–59، doi:10.1016/0196-6553(82)90003-7، PMID 7044193.
باللغة العربيَّة
- مكتب تنسيق التعريب التابع للمنظمة العربية للتربية والثقافة والعلوم (1441هـ - 2020م)، مُعْجم مُصْطلَحات كُوفِيد-19 (إنجليزي-فرنسي-عربي) (PDF) (ط. الأولى)، الرباط - المغرب، تاريخ النشر: 6 أيار (مايو) 2020م، ص. 28، مؤرشف من الأصل (PDF) في 22 أيار (مايو) 2020م، اطلع عليه بتاريخ 22 أيار (مايو) 2020م.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|تاريخ النشر=،|تاريخ الوصول=،|سنة=، و|تاريخ أرشيف=(مساعدة) - "ترجمة (Herd immunity) في المعجم الطبي الموحد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 26 مارس 2020، اطلع عليه بتاريخ 26 مارس 2020.
- "ترجمة (Herd immunity) في القاموس"، موقع القاموس، مؤرشف من الأصل في 27 مارس 2020، اطلع عليه بتاريخ 26 مارس 2020.
- "ترجمة (Herd immunity) في قاموس المعاني"، قاموس المعاني، مؤرشف من الأصل في 26 مارس 2020، اطلع عليه بتاريخ 26 مارس 2020.
- "ترجمة (Herd immunity) في المعجم الطبي الموحد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 26 مارس 2020، اطلع عليه بتاريخ 26 مارس 2020.
- "ترجمة (community immunity) في المعجم الطبي الموحد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 26 مارس 2020، اطلع عليه بتاريخ 26 مارس 2020.
- "ترجمة (community immunity) في القاموس"، موقع القاموس، مؤرشف من الأصل في 27 مارس 2020، اطلع عليه بتاريخ 26 مارس 2020.
- "ترجمة (community immunity) في موقع المعاني"، قاموس المعاني، مؤرشف من الأصل في 26 مارس 2020، اطلع عليه بتاريخ 26 مارس 2020.
وصلات خارجية
- مُحاكاةٌ بصرية للمناعة الجماعية، بواسطة شين كيليان وتعديل روبرت ويبب.
- بوابة طب
- بوابة إحصاء
- بوابة تمريض