1,4-benzoquinona
La 1,4-benzoquinona también se conoce como p-benzoquinona, 1,4-ciclohexadiendiona o a veces como protoquinona o simplemente como quinona. Es la sustancia más simple del grupo de las p-quinonas. Su fórmula química es C6H4O2.
| 1,4-benzoquinona | ||
|---|---|---|
 Fórmula estructural de la 1,4-benzoquinona. | ||
| Nombre IUPAC | ||
| Cyclohexa-2,5-diene-1,4-diona | ||
| General | ||
| Fórmula semidesarrollada | O=C(C4H4)C=O | |
| Fórmula molecular | C6H4O2 | |
| Identificadores | ||
| Número CAS | 106-51-4[1] | |
| Número RTECS | DK2625000 | |
| ChEBI | 16509 | |
| ChEMBL | CHEMBL8320 | |
| ChemSpider | 4489 | |
| PubChem | 4650 | |
| UNII | 3T006GV98U | |
| KEGG | C00472 C15602, C00472 | |
| Propiedades físicas | ||
| Apariencia | Amarillo (a menudo de color marrón por impurezas de HOC6H4OH*O=CC4H4C=O) | |
| Densidad | 1320 kg/m³; 132 g/cm³ | |
| Masa molar | 1081 g/mol | |
| Punto de fusión | 115 °C (388 K) | |
| Propiedades químicas | ||
| Acidez | - pKa | |
| Solubilidad en agua | 10 g L-1 | |
| Peligrosidad | ||
| Temperatura de autoignición | 636 K (363 °C) | |
| Frases R | R23/25 R36/37/38 R50 | |
| Frases S | S1/2 S7 S16 | |
| Compuestos relacionados | ||
| quinonas | hidroquinona, 1,2-benzoquinona | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Historia
El químico ruso Alejandro Abramowitsch Woskressenskien descubrió la 1,4-benzoquinona durante sus trabajos sobre los compuestos presentes en la corteza de la cinchona. Al oxidar el ácido quínico con dióxido de manganeso (MnO2) en presencia de ácido sulfúrico, obtuvo un nuevo compuesto de color dorado y de olor irritante.
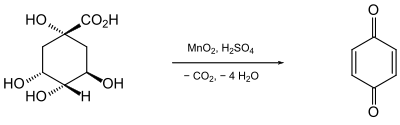
Por su origen a partir del ácido quínico, le dio el nombre de "quinil",[2] que luego se cambió por quinona ya que el sufijo -il está reservado para los radicales.
Síntesis
La 1,4-benzoquinona se puede obtener fácilmente por oxidación de 1,4-dihidroxibenceno (= hidroquinona) con clorato de sodio en presencia de pentóxido de divanadio como catalizador y ácdo sulfúrico como disolvente.[3] También es posible usar dicromato de sodio como oxidante.[4] También es accesible por oxidación de la anilina con dióxido de manganeso o cromato en disolución ácida[5] o a partir de 1,4-diisopropilbenceno y oxidación con oxígeno elemental usando el reagrupamiento de Hook y obteniendo acetona como producto acoplado.[6]
C6H4(CH(CH3)2)2 + 3 O2 → C6H4O2 + 2 O=C(CH3)2 + H2O
La 1,4-dibenzoquinona también se forma en el proceso fotográfico a partir de la hidroquinona cuando esta reduce el Ag+ a Ag metálica.
Propiedades
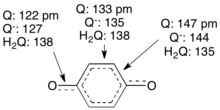
La benzoquinona es un sólido con una elevada presión de vapor. Ya que se reduce fácilmente a la hidroquinona puede ser usado como medio oxidante suave en síntesis orgánica. Su poder oxidante puede ser aumentado por sustituyentes como el cloro p.ej. en la 2,3,5,6-tetracloro-1,4-benzoquinona. La reducción suele pasar por dos reacciones de transferencia de un electrón. Como intermedio se forma una semiquinona H-O-C6H4O.. Esta a pesar de tratarse de un radical es relativamente estable ya que el electrón se deslocaliza por mesomería. En la propia 1-4-dibenzoquinona los enlace simples y dobles se alternan. En la siguiente imagen se pueden comparar las longitudes de enlace entre la quinona Q, la semiquinona Q. y la hidroquinona H2Q.
Usos y aplicaciones
La benzoquinona se usa como precursor de la hidroquinona. En química orgánica se emplea como aceptor de hidrógeno en reacciones de deshidrogenación. En reacciones del tipo Diels-Alder se emplea como dienófilo electrofílico. Como tal reacciona por ejemplo con ciclopentadieno. También se usa como precursor de algunos narcóticos como el tramadol.
Seguridad
La 1,4-benzoquinona interfiere con la respiración celular, es tóxica para las células de la sangre y se sospecha que provoca leucemia. La benzoquinona reacciona rápidamente con macromoléculas como el ADN o las proteínas y productos derivados de tal interacción se detectan en gran parte de la población expuesta. Algunas mezclas de hidrocarburos, incluyendo los combustibles de los automóviles, y el humo del tabaco producen benzoquinona por la oxidación del benceno.[8] En animales se han observado daño en los riñones después de una exposición servera.[5]
Importancia biológica
La benzoquinona es el producto de reacción entre la hidroquinona y el peróxido de hidrógeno. Esta reacción es muy exotérmica, y los "escarabajos bombarderos" la aprovechan para lanzar la mezcla hirviente e irritante sobre posibles atacantes cuando se sienten amenazados.[9] Otros artrópodos como el milpiés también la segregan como protección contra sus depredadores.
Referencias
- Número CAS
- A. Woskressenski: Über die Zusammensetzung der Chinasäure. (= Sobre la composición del ácido quínico) En: Liebigs Annalen der Pharmazie, 17, 257 (1838).
- H. W. Underwood, Jr. and W. L. Walsh "Quinone" año=1936 Volume=16 páginas=73 ColVol=2
- E. B. Vliet "Quinone" año=1922 Volume 2 Páginas=85 ColVol=1
- «1,4-BENZOQUINONE (para-QUINONE)» (pdf). IARC Monograph.
- Gerhard Franz, Roger A. Sheldon "Oxidation" En: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2000 doi 10.1002/14356007.a18_261
- J.-M. Lü, S. V. Rosokha, I. S. Neretin and J. K. Kochi, "Quinones as Electron Acceptors. X-Ray Structures, Spectral (EPR, UV-vis) Characteristics and Electron-Transfer Reactivities of Their Reduced Anion Radicals as Separated vs Contact Ion Pairs" Journal of the American Chemical Society 2006 128, 16708–19.doi 10.1021/ja066471o
- Lin, Y. S.; McKelvey, W.; Waidyanatha, S.; Rappaport, S. M. (2006). «Variability of Albumin Adducts of 1,4-Benzoquinone, a Toxic Metabolite of Benzene, in Human Volunteers». Biomarkers 11 (1): 14-27. PMID 16484134. doi:10.1080/13547500500382975.
- Bernhard Klausnitzer: Käfer. Nikol Verlagsgesellschaft mbH & Co. KG, Hamburg 2005, ISBN 3-937872-15-9.