1-cloro-2-metilpropano
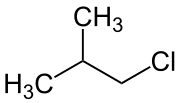
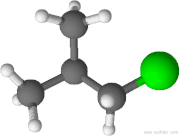
El 1-cloro-2-metilpropano, también llamado cloruro de isobutilo, es un compuesto orgánico de fórmula molecular C4H9Cl. Es isómero del 1-clorobutano pero, a diferencia de este, la cadena carbonada no es lineal.[2][3]
| 1-cloro-2-metilpropano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1-cloro-2-metilpropano | ||
| General | ||
| Otros nombres | Cloruro de isobutilo | |
| Fórmula semidesarrollada | CH3-CH(CH3)-CH2Cl | |
| Fórmula molecular | C4H9Cl | |
| Identificadores | ||
| Número CAS | 513-36-0[1] | |
| ChEMBL | CHEMBL160966 | |
| ChemSpider | 10114 | |
| PubChem | 10554 | |
| UNII | 95E08D17M7 | |
|
CC(C)CCl
| ||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Olor | Dulce | |
| Densidad | 879 kg/m³; 0,879 g/cm³ | |
| Masa molar | 9257 g/mol | |
| Punto de fusión | −131 °C (142 K) | |
| Punto de ebullición | 69 °C (342 K) | |
| Presión de vapor | 118 mmHg | |
| Viscosidad | 0,46 cP | |
| Índice de refracción (nD) | 1,398 | |
| Propiedades químicas | ||
| Solubilidad en agua | 28 mg/L | |
| log P | 2,39 | |
| Familia | Haloalcano | |
| Peligrosidad | ||
| Punto de inflamabilidad | 256 K (−17 °C) | |
| NFPA 704 |
3
2
0
| |
| Temperatura de autoignición | 668 K (395 °C) | |
| Límites de explosividad | 2,0% - 8,8% | |
| Compuestos relacionados | ||
| cloroalcanos | 1-cloro-3-metilbutano | |
| dicloroalcanos | 1,2-dicloro-2-metilpropano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
A temperatura ambiente el 1-cloro-2-metilpropano es un líquido incoloro con un característico olor dulce. Tiene su punto de ebullición a 69 °C y su punto de fusión a -131 °C, unos 9 °C inferiores a los de su isómero 1-clorobutano. Posee una densidad de 0,879 g/cm³ y en estado gaseoso es 3,2 veces más denso que el aire.[2] Su viscosidad a 20 °C es de 0,46 cP,[4] inferior a la del agua y semejante a la del octano.
El valor del logaritmo de su coeficiente de reparto, logP = 2,39, denota que es más soluble en disolventes apolares que en disolventes polares. Así, en agua es prácticamente insoluble, en proporción de 28 mg/L.[2][5][6]
En cuanto a su reactividad, el 1-cloro-2-metilpropano es incompatible con agentes oxidantes fuertes así como con bases fuertes.[4]
Síntesis
Se puede producir 1-cloro-2-metilpropano por cloración de isobutano, obteniéndose una mezcla con 2-cloro-2-metilpropano. La relación entre ambos productos depende de la temperatura: a 600 °C, la proporción de 1-cloro-2-metilpropano alcanza el 80%.[7]
El 1-cloro-2-metilpropano puede también sintetizarse a partir del isobutanol mediante el uso de cloruro de trimetilsililo (TMSCl) y dimetilsulfóxido (DMSO). El rendimiento de la reacción es del 95%.[8] Otra ruta se síntesis parte del ácido isovalérico, por reacción de este con cloruro de litio y acetato de plomo (IV), utilizando benceno como disolvente. En este caso, el rendimiento llega al 99%.[9]
La descomposición catalítica de cloroformiato de isobutilo es otra vía para obtener 1-cloro-2-metilpropano. Como catalizador se usa cloruro de hexabutilguanidinio, siendo el rendimiento aproximado de la reacción de un 99%.[10]
Usos
El 1-cloro-2-metilpropano se ha empleado en reacciones de alquilación de benzamidas. En dicho proceso, catalizado por cobalto, se emplea un reactivo de Grignard para formar 2-alquilbenzamidas, agregándose selectivamente el isobutilo a la posición orto del sustrato de benzamida.[11]
También se utiliza este cloroalcano en la síntesis de fármacos como butetamina[12] e hidrocloruro de olprinona.[13]
Precauciones
Tanto el líquido como los vapores de 1-cloro-2-metilpropano son muy inflamables. Su punto de inflamabilidad es -17 °C y su temperatura de autoignición 668 °C. Al arder puede desprender cloruro de hidrógeno.[4][14]
Véase también
Los siguientes compuestos son isómeros del 1-cloro-2-metilpropano:
Referencias
- Número CAS
- 1-Chloro-2-methylpropane (PubChem)
- 1-Chloro-2-methylpropane (ChemSpider)
- 1-Chloro-2-methylpropane. MSDS (Merck)
- «1-Chloro-2-methylpropane (GESTIS)». Archivado desde el original el 13 de diciembre de 2019. Consultado el 12 de diciembre de 2019.
- 1-Chloro-2-methylpropane (Chemical Book)
- Jeromin, Günter (2006). Organische Chemie: ein praxisbezogenes Lehrbuch. Harri Deutsch Verlag. ISBN 978-3-8171-1732-1.
- Snyder, D.C. (1995). «Conversion of Alcohols to Chlorides by TMSCl and DMSO». J. Org. Chem. 60 (8): 2638-2639. Consultado el 13 de diciembre de 2019.
- Margaretha, P. (2007). «35.1.1.3.3.1 Variation 1: Chlorodecarboxylation in the Presence of Lithium Chloride». Science of Synthesis 35: 51. Consultado el 13 de diciembre de 2019.
- Foulon, F.; Fixari, B.; Picq, D.; Le Perchec, P. (1997). «Catalytic decomposition of alkyl chloroformates by hexabutylguanidinium chloride». Tetrahedron Letters 38 (19): 3387-3390. Consultado el 13 de diciembre de 2019.
- Yi, C.S. (2015). «1.1.7.1 Catalytic Arene C(sp2)—H Alkylation Reactions via C(sp3)—X Bond Cleavage (X = Cl, Br, I)». Science of Synthesis: Catalytic Transformations via C—H Activation 1: 230. Consultado el 13 de diciembre de 2019.
- Buthetamine. Pharmaceutical substances
- Olprinone hydrochloride. Pharmaceutical substances
- «1-Chloro-2-methylpropane. MSDS (Synquest)». Archivado desde el original el 11 de diciembre de 2019. Consultado el 11 de diciembre de 2019.
