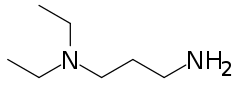
3-dietilaminopropilamina
La 3-dietilaminopropilamina, también llamada N',N'-dietilpropano-1,3-diamina, (3-aminopropil)dietilamina o 1-amino-3-(dietilamino)propano,[2][3] es una diamina de fórmula molecular C7H18N2. Es isómera de la 1,7-heptanodiamina pero, a diferencia de ésta, contiene un solo grupo amino primario, siendo el otro grupo amino terciario.
| 3-dietilaminopropilamina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| N',N'-dietilpropano-1,3-diamina | ||
| General | ||
| Otros nombres |
(3-aminopropil)dietilamina 1-amino-3-(dietilamino)propano 3-aminopropildietilamina N,N-dietil-1,3-propanodiamina N,N-dietil-1,3-diaminopropano N,N-dietilpropilendiamina | |
| Fórmula semidesarrollada | (CH3-CH2)2N-CH2-CH2-CH2-NH2 | |
| Fórmula molecular | C7H18N2 | |
| Identificadores | ||
| Número CAS | 104-78-9[1] | |
| ChemSpider | 54972 | |
| PubChem | 61011 | |
| UNII | JB92D3RAVH | |
|
CCN(CC)CCCN
| ||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro o de color amarillo pálido. | |
| Olor | Pescado. | |
| Densidad | 826 kg/m³; 0,826 g/cm³ | |
| Masa molar | 13 023 g/mol | |
| Punto de fusión | −60 °C (213 K) | |
| Punto de ebullición | 169 °C (442 K) | |
| Presión de vapor | 1,5 ± 0,3 mmHg | |
| Índice de refracción (nD) | 1,442 | |
| Propiedades químicas | ||
| Solubilidad en agua | 9 × 102 g/L | |
| log P | 0,769 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 324,15 K (51 °C) | |
| Compuestos relacionados | ||
| aminas | 1-heptanamina | |
| diaminas |
1,7-heptanodiamina Novoldiamina | |
| triaminas | 1,4,7-heptanotriamina | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
La 3-dietilaminopropilamina es un líquido incoloro o ligeramente amarillo que desprende un olor a pescado. Su densidad es inferior a la del agua (ρ = 0,826 g/cm³).[3][2][4] Tiene un punto de ebullición de 169 °C mientras que su punto de fusión es de -60 °C. Su vapor es 4,4 veces más denso que el aire.[5] Es un compuesto soluble en agua, aunque el valor del logaritmo de su coeficiente de reparto, logP = 0,769, indica que es más soluble en disolventes hidrófobos —como el 1-octanol— que en disolventes hidrófilos.
En cuanto a su reactividad, la 3-dietilaminopropilamina neutraliza ácidos en reacciones exotérmicas formando sales.[4]
Síntesis y usos
La 3-dietilaminopropilamina se puede obtener a partir de etilendiamina y acroleína; otra ruta de síntesis proviene de la reacción entre 3-(dietilamino)propanonitrilo y etanol.[6]
En cuanto a sus usos, esta diamina se emplea como disolvente así como intermediario en síntesis orgánica.[7] También puede ser componente de tintes, pigmentos y adhesivos.[8] En forma diprotonada, esta diamina se ha empleado como agente quelante para formar complejos con iodoplumbato.[9]
Precauciones
La 3-dietilaminopropilamina es un compuesto inflamable que alcanza el punto de inflamabilidad —temperatura mínima a la que los vapores de un fluido se inflaman en presencia de una fuente de ignición— a 51 °C.[3] Sus vapores pueden formar mezclas explosivas con el aire.
Esta sustancia, al ser inhalada o ingerida, puede tener efectos tóxicos. Su contacto puede provocar quemaduras severas en ojos y piel; sus vapores pueden ocasionar mareos y ahogos.[4]
Véase también
Las siguientes poliaminas son isómeras de la 3-dietilaminopropilamina:
- 1,7-heptanodiamina
- N,N,N',N'-tetrametil-1,3-propanodiamina
- N,N'-dietil-1,3-propanodiamina
- N,N-dimetil-1,5-pentanodiamina
- N,N,2,2-tetrametil-1,3-propanodiamina
Referencias
- Número CAS
- 3-Diethylaminopropylamine (PubChem)
- N,N-Diethylpropan-1,3-diamin (ChemSpider)
- 3-Diethylaminopropylamine(104-78-9) (Chemical Book)
- 3-Diethylaminopropylamine (Molbase)
- 3-Diethylaminopropylamine 104-78-9 Synthesis Route (Molbase)
- N,N-Diethyl-1,3-propanediamine, 99% (Alfa Aesar)
- 3-DIETHYLAMINOPROPYLAMINE (Cameo Chemicals)
- Tanlai Yu, Lin Zhang, Junju Shen, Yangbo Fua, Yunlong Fu (2014). «Hydrogen bonds and steric effects induced structural modulation of three layered iodoplumbate hybrids from nonperovskite to perovskite structure». Dalton Transactions 43: 13115-13121. Consultado el 9 de junio de 2016.