Cloruro de hierro(III)
El cloruro de hierro(III) o tricloruro de hierro (tradicionalmente llamado cloruro férrico) es un compuesto químico utilizado a escala industrial perteneciente al grupo de los haluros metálicos, cuya fórmula es FeCl3. También se le denomina equivocadamente percloruro de hierro e incluso percloruro férrico. El color de los cristales de cloruro de hierro(III) dependen del ángulo de visión: cuando reflejan la luz los cristales tienen un color verde oscuro, pero cuando transmiten la luz su color es rojo purpúreo. Por otra parte, el hexahidrato (FeCl3·6 H2O) es de color amarillo o amarillo anaranjado. El cloruro de hierro(III) anhidro es delicuescente y forma una neblina de cloruro de hidrógeno en presencia de aire húmedo. Se observa muy raramente en su forma natural, el mineral molisita, que puede hallarse en algunas fumarolas. El cloruro férrico en solución al 40% se utiliza como coagulante para tratamiento de aguas y efluentes, se comercializa habitualmente a granel.
| Cloruro de hierro(III) | ||
|---|---|---|
-chloride-hexahydrate-sample.jpg.webp) | ||
| Nombre IUPAC | ||
| Cloruro de hierro(III) | ||
| General | ||
| Otros nombres |
Cloruro férrico, Percloruro de hierro, Percloruro férrico, Flores martis, Molisita (mineral) | |
| Fórmula molecular |
Anhidro: FeCl3, hexahidrato: FeCl3·6 H2O | |
| Identificadores | ||
| Número CAS | 7705-08-0[1] | |
| ChEBI | 30808 | |
| ChemSpider | 22792 | |
| DrugBank | 15536 | |
| PubChem | 24380 | |
| UNII | U38V3ZVV3V | |
| Propiedades físicas | ||
| Apariencia | Naranja | |
| Densidad | 2800 kg/m³; 28 g/cm³ | |
| Masa molar | hexahidratado: 270,195 g/mol | |
| Punto de fusión | 310 K (37 °C) | |
| Punto de ebullición | 588 K (315 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 92 g/100 ml (20 °C) | |
| Termoquímica | ||
| ΔfH0sólido | -399,4 kJ/mol | |
| S0sólido | 142.34 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
0
2
2
| |
| Frases R | R22 R38 R41 | |
| Frases S | S26 S39 | |
| Riesgos | ||
| Ingestión | náuseas, vómitos. | |
| Piel | Irritaciones, quemaduras. | |
| Ojos | Irritaciones, quemaduras. | |
| LD50 | (oral rata) 450 mg/kg | |
| Compuestos relacionados | ||
| Otros cationes |
cloruro de sodio cloruro de potasio cloruro de manganeso(III) cloruro de cobalto(III) cloruro de hierro(II) | |
| Otros aniones |
bromuro de hierro(III) ioduro de hierro(III) óxido de hierro(III) sulfuro de hierro(III) sulfato de hierro(III) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Carácter del enlace y propiedades
Es un sólido, bastante volátil pues su enlace es principalmente iónico y por tanto direccional. Forma cristales moleculares de tipo laminar por lo que presenta un aspecto de escamas brillantes de color verde oscuro o rojo púrpura dependiendo del ángulo con el que se mire.[2] Tiene una presión de vapor alta por lo que sus puntos de fusión, ebullición, y sublimación son relativamente bajos debido a que solo hay que romper fuerzas de Van der Waals para pasar de un estado a otro. Si se calienta suavemente, sublima a 280 °C. Si el calentamiento es más rápido, funde a 306 °C. Si no se controla la temperatura, se descompone formando dicloruro de hierro.[2]
El porcentaje de enlace covalente es grande por el poder polarizante del catión. Los cationes de mayor carga, menor tamaño y menor índice de coordinación presentan mayor poder polarizante y mayor tendencia a la hidrólisis). El catión Fe(III) es pequeño y posee gran carga por lo que se hidroliza fácilmente con el agua formando un complejo de coordinación con 6 moléculas de agua, Fe(H2O)63+, de color amarillo; por tanto se deberá tener precaución para la síntesis del tricloruro de hierro de que no entre en contacto con aire o agua.
Disoluciones
Por su carácter covalente, es soluble en disolventes orgánicos. En disolución alcohólica se lo conoce como tintura de hierro.
Cuando se disuelve en agua, el cloruro de hierro(III) sufre hidrólisis y libera calor en una reacción exotérmica. De ello resulta una solución ácida y corrosiva de color marrón que se utiliza como coagulante en el tratamiento de aguas residuales, para la potabilización del agua, y en la industria electrónica para el grabado químico de placas de circuito impreso. Al disolverse en agua, debería precipitar formando hidróxido de hierro(III) Fe(OH)3, insoluble; sin embargo, forma una disolución coloidal de ese compuesto, que presenta el típico color pardo de las disoluciones de sales de hierro(III).[3]
El cloruro de hierro(III) anhidro es un ácido de Lewis bastante débil, y se emplea como catalizador en síntesis orgánica.
Obtención
- Puede obtenerse al pasar cloro gaseoso sobre hierro caliente.[4]
Esta síntesis de laboratorio es directa y se procede al montaje de un aparato donde se lleven a cabo los siguientes procedimientos:
- Se genera el (Cl2) a partir de la reacción redox entre el permanganato de potasio y el
- Se deshidrata el gas generado mediante ácido sulfúrico concentrado.
- La reacción se lleva a cabo en un tubo de combustión donde se pone el hierro que
se quiere que reaccione con el cloro gas y se calienta para favorecer su reacción y que sea más rápida.
- Se utiliza un desecante sólido como puede ser el dicloruro de calcio (CaCl2) para
asegurarse de que si entra algo de aire en el montaje, este no hidrolize al tricloruro.
- Se elimina el gas cloro sobrante que al ser contaminante se transforma en una sal soluble
poniéndolo en contacto con hidróxido de sodio, NaOH. El (Cl2) dismuta (se oxida y se reduce) en medio ácido a cloruro y a hipoclorito. La especie más estable en ese medio es el cloruro, que formará cloruro de sodio, NaCl.
- Para el reciclado del óxido de manganeso formado en la reacción entre el ácido clorhídrico y el permanganato de potasio, se le añade agua y se calienta. De esta forma se obtendrá una sal soluble de cloruro de manganeso(II) (MnCl2) por reacción redox entre el óxido de manganeso(II) y el cloruro.
Para calcular el rendimiento de la síntesis se puede proceder de varias formas:
- Pesando el hierro que no ha reaccionado con un sublimador en una atmósfera inerte.
- Formando el complejo hexaacuo, luego el hidróxido de hierro(III) que se calcina a óxido de hierro(III), pesándolo y calculando el rendimiento mediante la estequiometría de las reacciones llevadas a cabo.
- También se puede obtener introduciendo trozos de hierro bien oxidado en una solución de ácido clorhídrico
- Las disoluciones de cloruro de hierro(III) se producen industrialmente a partir de hierro y de sus óxidos.
- Se disuelve hierro puro en una disolución de cloruro de hierro(III)
- Se disuelve óxido ferroso férrico en ácido clorhídrico:
- Se oxida el cloruro de hierro(II) con cloro
- El cloruro de hierro(II) puede oxidarse con dióxido de azufre:
_chloride_hexahydrate.jpg.webp)
Reacciones
El cloruro de hierro(III), es un ácido de Lewis moderadamente fuerte, formando aductos con bases de Lewis tales como óxido de trifenilfosfina:
FeCl3(OPPh3)2 donde Ph = fenil = C6H5-
Reacciona con otros cloruros para dar el ion tetraédrico FeCl4−, de color amarillo.
Calentado con óxido de hierro(III) a 350 °C, se transforma en oxicloruro de hierro(III):
En medio básico, reacciona con alcoholes para dar complejos dímeros de alcóxidos:
Los oxalatos reaccionan rápidamente con el cloruro de hierro(III) disuelto para dar [Fe(C2O4)3]3−.
El cloruro de hierro(III) es un oxidante suave, capaz de oxidar el cloruro de cobre(I) a cloruro de cobre(II). Agentes reductores como hidrazina convierten el cloruro de hierro(III) en complejos de hierro(II).
Aplicaciones
Industriales
Se utiliza como coagulante para:
- Tratamiento de aguas residuales(efluentes cloacales y efluentes industriales)
- Potabilización de agua (tratamiento de agua de río para obtener agua de consumo).[5]
FeCl3 en medio acuoso ligeramente básico reacciona con el ion hidróxido para formar flóculos de FeO(OH)-, que puede eliminar los materiales en suspensión.
- Fe3+ + 4 OH− → Fe(OH)4− → FeO(OH)2−·H2O
Otro uso importante del FeCl3 es para grabar o decapar el cobre en una reacción redox que oxida el cobre a cloruro de cobre(I) y luego a cloruro de cobre(II) en la producción de circuito impreso.[6]
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
El cloruro de hierro(III) se usa como catalizador de la reacción de adición de etileno con cloro, formando (1,2-dicloroetano), una materia prima importante para producir industrialmente cloruro de vinilo, el monómero para fabricar PVC.
- H2C=CH2 + Cl2 → ClCH2CH2Cl
De laboratorio
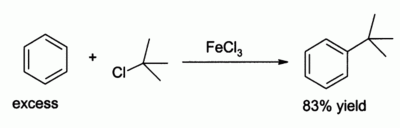
El cloruro de hierro(III) se usa en el laboratorio como ácido de Lewis para reacciones de catálisis tales como cloración y reacción de Friedel-Crafts de compuestos aromáticos. Es menos potente que cloruro de aluminio, pero esta menor fortaleza conduce a veces a rendimientos más altos, como en la alquilación de benceno:
La prueba del cloruro férrico es una prueba colorimétrica tradicional para fenoles, que usa una disolución al 1% de cloruro de hierro(III) que ha sido neutralizada con hidróxido de sodio hasta que se forme una pequeña precipitación de FeO(OH).[7] La mezcla se filtra antes de ser usada. La sustancia orgánica se disuelve en agua, metanol o etanol, luego se añade la disolución neutra de cloruro: —una coloración transitoria o permanente (normalmente púrpura, verde o azul) indica la presencia de un fenol o enol.
Uso en electrónica

Una de sus más importantes aplicaciones es en electrónica para producir placas de circuito impreso en bajas cantidades. El cloruro férrico reacciona con el cobre dando cloruro ferroso y cloruro cúprico como lo muestra la siguiente ecuación :
Tenemos que :
- 2 FeCl3 + Cu0 → 2 FeCl2 + CuCl2
- 2(Fe3+ + e- → Fe2+)
- Cu0 - 2 e- → Cu2+
Hay dos procedimientos para esto:
- Consiste en realizar un dibujo manualmente sobre una plaqueta con una cara de cobre, mediante el uso de un rotulador permanente resistente al ataque de ácidos. También suelen aplicarse diversos métodos más efectivos reemplazando el uso del rotulador, como es el empleo de folios de acetato (también conocidos como "Transparencias"), imprimiendo sobre estos la imagen del circuito prediseñado en un ordenador. Para este método es conveniente utilizar impresoras láser o fotocopiadoras, ya que contienen Tóner, que es resistente al ataque ácido. Una vez impreso el circuito en el acetato, se procede a calentar el cobre de la placa (mediante el uso de una plancha o similar) para posteriormente colocar el acetato sobre ella y adherir el Tóner a él. Para finalizar se introduce la placa en la solución de cloruro férrico.
- El otro método, con resultados de mayor calidad, se basa en el empleo de plaquetas sensibles a la luz. Se cubre la plaqueta con una transparencia (acetato) con el circuito impreso, luego se deja a disposición de una fuente de rayos UV. Y al finalizar este proceso se lo sumerge casi instantáneamente en un revelador y luego en la solución de cloruro férrico.
Para el primer procedimiento se utilizan placas con capa de cobre comunes, mientras que para el segundo se utilizan placas fotosensibilizadas.
De preferencia se calienta la solución a 25 °C previamente, o simultáneamente a través de un baño calefactor. La plaqueta debería flotar sobre la solución si ésta se encuentra en buen estado. Es altamente recomendable, aunque no obligatorio, utilizar una fuente de aire en el recipiente donde vaya la solución, de esta manera se oxigena y el ataque del Cloruro Férrico es más efectivo, además de ayudar a eliminar el residuo de cobre de la placa.
Otros usos
El cloruro de hierro(III) anhidro se usa a veces como reactivo deshidratante en ciertas reacciones.
También se utiliza en modelos de trombosis animal.[8]
Lo usan los fabricantes de cuchillos y espadas artesanales para teñir las hojas y para dar un efecto de contraste al metal y para ver las imperfecciones del mismo.
También se usa para el fotograbado de láminas de cobre para imprimir imágenes fotográficas al aguafuerte o por intaglio y para grabar los cilindros de rotograbado usados en la industria de artes gráficas.
Precauciones
El cloruro de hierro(III) es corrosivo para los metales ferrosos y algunos metales no ferrosos como el cobre y sus aleaciones. Evite el contacto con metales.
El material anhidro es un poderoso agente deshidratante pudiendo provocar quemaduras en la piel, en solución mancha la piel y puede provocar irritación. Use guantes.
Provoca quemaduras por contacto con los ojos. Use gafas de protección.
Las sales de hierro son moderadamente tóxicas por inhalación. NIOSH REL: TWA 1 mg/m3 como Fe.[9] cuando trabaja con sales de hierro en polvo use la campana del laboratorio o use máscara con filtro para polvos.
Referencias
- Número CAS
- Química inorgánica. Enrique Gutierrez Ríos. Editorial Reverté. Barcelona, 1978.ISBN 84-291-7215-7
- Química general moderna. Joseph Babor y José Ibarz. Barcelona, 1973. ISBN 84-7102-997-9
- Tarr, B.R. (1950). «Anhydrous Iron(III) Chloride». Inorganic Syntheses 3: 191-194.
- Water Treatment Chemicals. Akzo Nobel Base Chemicals. 2007. Archivado desde el original el 21 de octubre de 2006. Consultado el 26 de octubre de 2007.
- Greenwood, N.N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed. edición). Oxford: Butterworth-Heinemann.
- Furnell, B.S.; et al. (1989). Vogel's Textbook of Practical Organic Chemistry (5th edition edición). Nueva York: Longman/Wiley.
- Tseng, Michael; Dozier, A.; Haribabu, B.; Graham, U. M. (2006). "Transendothelial migration of ferric ion in FeCl3 injured murine common carotid artery". Thrombosis Research 118 (2): 275–280.doi:10.1016/j.thromres.2005.09.004
- NIOSH Publications (USA); NIOSH POCKET GUIDE TO CHEMICAL HAZARDS; 3rd. ed. 2007
