Crotononitrilo
El crotononitrilo, también llamado 2-butenonitrilo y 1-cianopropeno, es un compuesto orgánico de fórmula molecular C4H5N.[2][3][4] Es un nitrilo lineal de cuatro átomos de carbono con un grupo funcional C≡N en un extremo y un doble enlace entre los carbonos 2 y 3. Este compuesto se presenta en forma de dos isómeros geométricos, cis y trans.
| Crotononitrilo | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| (E)-but-2-enonitrilo | ||
| General | ||
| Otros nombres |
2-butenonitrilo crotonnitrilo 1-cianopropeno cianuro de 1-propenilo | |
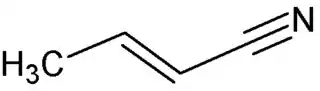
| Fórmula semidesarrollada | CH3-CH=CH-C≡N | |
| Fórmula molecular | C4H5N | |
| Identificadores | ||
| Número CAS | 4786-20-3[1] | |
| Número RTECS | GQ6322000 | |
| ChEBI | 191223 | |
| ChemSpider | 553494 | |
| PubChem | 637921 | |
|
CC=CC#N
| ||
| Propiedades físicas | ||
| Apariencia | Líquido de color amarillo pálido | |
| Densidad | 824 kg/m³; 0,824 g/cm³ | |
| Masa molar | 6709 g/mol | |
| Punto de fusión | −51,5 °C (222 K) | |
| Punto de ebullición | 120 °C (393 K) | |
| Presión de vapor | 43 mmHg | |
| Índice de refracción (nD) | 1,419 | |
| Propiedades químicas | ||
| Solubilidad en agua | 25 g/L | |
| log P | 0,71 | |
| Familia | Nitrilo | |
| Peligrosidad | ||
| Punto de inflamabilidad | 289,15 K (16 °C) | |
| NFPA 704 |
3
3
0
| |
| Compuestos relacionados | ||
| nitrilos |
dimetilaminoacetonitrilo valeronitrilo pivalonitrilo | |
| dinitrilos |
succinonitrilo glutaronitrilo | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
A temperatura ambiente, el crotononitrilo es un líquido de color amarillo claro. Tiene su punto de ebullición a 120 °C y su punto de fusión a -51,5 °C. Posee una densidad inferior a la del agua (ρ = 0,824 g/cm³) y una solubilidad en ella de 25 g/L.[5] El logaritmo de su coeficiente de reparto, logP = 0,71 (valor teórico, no experimental),[3] sugiere que es más soluble en disolventes apolares —como el 1-octanol— que en disolventes polares. En forma de vapor, su densidad es 2,3 veces mayor que la del aire.[4]
En cuanto a su reactividad, el crotononitrilo es incompatible con agentes oxidantes.[6]
Síntesis y usos
El crotononitrilo puede sintetizarse por la desulfenilación electrooxidativa del 3-etilsulfanilbutanonitrilo, aducto de Michael del correspondiente nitrilotiol β-insaturado; dicho proceso tiene lugar por mediación del ion bromonio.[7] Asimismo, el tratamiento de crotonaldehído con iodo en agua amoniacal a temperatura ambiente da lugar a la formación de crotonotrilo, siendo el rendimiento del 58%.[8] Un método adicional para obtener este nitrilo se basa en la electrólisis a corriente constante de crotonamida y trifenilfosfina en diclorometano; el rendimiento con este procedimiento alcanza el 55% aproximadamente.[9]
Se ha investigado el crotononitrilo como posible molécula orgánica presente en el medio interestelar, resultando ser este nitrilo el compuesto más estable que se puede formar en las condiciones que imperan en el espacio interestelar (entre 10 y 1500 K).[10]
El crotononitrilo es conocido por ser tóxico para el sistema vestibular de roedores, característica que comparte con otros nitrilos de bajo peso molecular.[11] En este sentido, las propiedades neurotóxicas del cis-crotononitrilo son mucho más acusadas que las de su isómero trans-crotononitrilo.[12] Se ha especulado que el crotononitrilo y otros nitrilos similares puedan ser la causa de enfermedades humanas como el konzo, el latirismo y la neuropatía atáxica tropical (TAN).[13]
Precauciones
El crotononitrilo es un compuesto fácilmente inflamable —en estado líquido o como vapor— que tiene su punto de inflamabilidad a 16 °C. Es una sustancia tóxica por ingestión que ocasiona irritación en la piel y en los ojos, pudiendo ser severa la irritación en este último caso.[6]
Véase también
Los siguientes compuestos son nitrilos con cuatro átomos de carbono:
- Butironitrilo
- Isobutironitrilo
- Metacrilonitrilo
- Cianuro de alilo
- Cianopropino
Referencias
- Número CAS
- Crotononitrile (PubChem)
- Crotononitrile (ChemSpider)
- Crotononitrile (Chemical Book)
- 2-butenenitrile (EPA)
- Crotononitrile. MSDS (Fisher Scientifc)
- Kimura, Makoto; Matsubara, Shinichi; Sawaki, Yasuhiko; Iwamura, Hiizu (1986). «Electrooxidative desulfenylation of Michael-type thiol adducts of α β-unsaturated esters, ketones, and nitriles». Tetrahedron Letters 27 (35): 4177-4178.
- Talukdar, Sanjay; Hsu, Jue-Liang; Chou, Tzu-Chi; Fang, Jim-Min (2001). «Direct transformation of aldehydes to nitriles using iodine in ammonia water». Tetrahedron Letters 42 (6): 1103-1105.
- Ohmori, Hidenobu; Sakai, Kiyoshi; Nagai, Noriko; Mizuki, Yasuyuki; Masui, Masaichiro (1985). «Reaction of Electrochemically Generated Triphenylphosphine Radical Cation with Amides and Ureas». Chemical and Pharmaceutical Bulletin 33 (1): 373-376.
- M. Lattelais; Y. Ellinger; A. Matraneb; J.-C. Guillemin (2010). «Looking for heteroaromatic rings and related isomers as interstellar candidates». Phys. Chem. Chem. Phys. 12: 4165-4171.
- Saldaña-Ruíz, S., Soler-Martín, C., Llorens, J. (2012). «Role of CYP2E1-mediated metabolism in the acute and vestibular toxicities of nineteen nitriles in the mouse». Toxicol. Letters 208 (2): 125-132. Consultado el 19 de marzo de 2017.
- Valbuena, E., Llorens, J. (2003). «Comparison of cis- and trans-crotononitrile effects in the rat reveals specificity in the neurotoxic properties of nitrile isomers». Toxicol Appl Pharmacol. 187 (2): 89-100. Consultado el 19 de marzo de 2017.
- Llorens, J., Soler-Martín, C., Saldaña-Ruíz, S., Cutillas, B., Ambrosio, S., Boadas-Vaello, P. (2011). «A new unifying hypothesis for lathyrism, konzo and tropical ataxic neuropathy: nitriles are the causative agents». Food Chem Toxicol. 49 (3): 563-570. Consultado el 19 de marzo de 2017.
