Encefalomielitis aguda diseminada
La encefalomielitis diseminada aguda (ADEM por sus siglas en inglés, de Acute disseminated encephalomyelitis) o inflamación leucocítica y hemorrágica del sistema nervioso central es una rara enfermedad autoinmune caracterizada por una repentina y generalizada inflamación del cerebro y la médula espinal. Además de provocar la inflamación del cerebro y la médula espinal, también ataca los nervios del sistema nervioso central y daña su aislamiento de mielina, lo que, como resultado, destruye la materia blanca. A menudo se desencadena por una infección viral o (muy raramente) por vacunas específicas no rutinarias.[1][2][3][4][5][6]
| Encefalomielitis aguda diseminada | ||
|---|---|---|
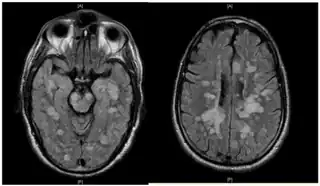 La leucoencefalitis hemorrágica aguda fulminante muestra muchas lesiones. El paciente sobrevivió, pero permaneció en un estado vegetativo persistente | ||
| Especialidad | neurología | |
Ocurre habitualmente en personas sanas, con edades que oscilan entre los 30 y 40 años. En ocasiones, presenta como pródromo una infección respiratoria. La evolución es fulminante, y sin tratamiento, el paciente entra en coma y muere en pocos días.
Los síntomas se parecen a los de la esclerosis múltiple, por lo que la enfermedad en sí misma se clasifica dentro de las enfermedades limítrofes con la esclerosis múltiple. Sin embargo, tiene varias características que la distinguen de la EM.[7] A diferencia de la EM, se presenta generalmente en niños y se caracteriza por una fiebre rápida, aunque los adolescentes y los adultos también pueden contraer la enfermedad. La enfermedad consiste en un solo brote, mientras que la EM se caracteriza por varios brotes (o recaídas), durante un largo período de tiempo. También se distingue por una pérdida de conciencia, coma y muerte, lo cual es muy raro en la EM, excepto en casos severos.[8] Afecta aproximadamente a 8 por cada 1.000.000 de personas por año.[9] Aunque ocurre en todas las edades, la mayoría de los casos reportados son en niños y adolescentes, con una edad promedio alrededor de los 5 a 8 años.[10][11][12][13] La enfermedad afecta a hombres y mujeres casi por igual.[14] Muestra una variación estacional con una mayor incidencia en los meses de invierno y primavera, lo que puede coincidir con un aumento de las infecciones virales durante estos meses.[13] La tasa de mortalidad puede llegar al 5%; sin embargo, la recuperación completa se alcanza en el 50 al 75% de los casos con un incremento en las tasas de supervivencia de hasta el 70 al 90%, con cifras que incluyen también una discapacidad residual menor.[15] El tiempo promedio para recuperarse es de uno a seis meses.
La leucoencefalitis hemorrágica aguda produce múltiples lesiones inflamatorias en el cerebro y la médula espinal, particularmente en la materia blanca. Normalmente se encuentran en la materia blanca subcortical y central y en la unión gris-blanca cortical de ambos hemisferios cerebrales, cerebelo, tronco cerebral y médula espinal,[16] pero la materia blanca periventricular y la materia gris de la corteza, el tálamo y los ganglios basales también pueden estar implicados.
Cuando una persona tiene más de un episodio desmielinizante de leucoencefalitis hemorrágica aguda, la enfermedad se denomina encefalomielitis diseminada recurrente[17] o encefalomielitis diseminada multifásica.[18] También se ha descrito un curso fulminante en adultos.[19]
Signos y síntomas
Tiene un inicio abrupto y un curso monofásico. Los síntomas suelen comenzar de 1 a 3 semanas después de la infección. Los principales síntomas incluyen fiebre, dolor de cabeza, náuseas y vómitos, confusión, problemas de visión, somnolencia, convulsiones y coma. Aunque inicialmente los síntomas suelen ser leves, empeoran rápidamente en el transcurso de horas o días, siendo el tiempo medio hasta la máxima gravedad de unos cuatro días y medio.[20] Otros síntomas son la hemiparesia, la paraparesia y la parálisis de los nervios craneales.[21]
Causas
Desde el descubrimiento de la especificidad de la anti-MOG en el diagnóstico de la esclerosis múltiple[22] se considera que la leucoencefalitis hemorrágica aguda es una de las posibles causas clínicas de la encefalomielitis asociada a anti-MOG.[23]
Sobre cómo aparecen los anticuerpos anti-MOG en el suero del paciente hay varias teorías:
- En aproximadamente dos tercios de las personas puede identificarse un problema antigénico precedente.[14] Algunas infecciones virales que se cree que inducen la enfermedad incluyen el virus de la influenza, dengue,[24] enterovirus, sarampión,[25] paperas, rubéola, varicela zóster, a virus de Epstein-Barr, citomegalovirus, virus del herpes simple, hepatitis A, y coxsackievirus; mientras que las infecciones bacterianas incluyen Mycoplasma pneumoniae, Borrelia burgdorferi, Leptospira, y estreptococos beta-hemolíticos.[26]
- Exposición a las vacunas: La única vacuna que se ha probado que está relacionada con la enfermedad es la forma Semple de la vacuna contra la rabia, pero las vacunas contra la hepatitis B, la tos ferina, la difteria, el sarampión, las paperas, la rubéola, el neumococo, la varicela, la influenza, la encefalitis japonesa y la poliomielitis también han estado relacionadas. La mayoría de los estudios que correlacionan la vacunación con el inicio de la enfermedad utilizan muestras pequeñas o estudios de algunos casos.[cita requerida]Los estudios epidemiológicos a gran escala (por ejemplo, de la vacuna SPR o de la vacuna contra la viruela) no muestran un aumento del riesgo de leucoencefalitis hemorrágica aguda después de la vacunación.[9][27][28][29][20][30][31][32][33][34][35]
- En casos raros, la enfermedad parece ser consecuencia de un trasplante de órganos.[20] El límite superior del riesgo de leucoencefalitis hemorrágica aguda por la vacunación contra el sarampión, si existe, puede estimarse en 10 por millón,[36] que es mucho menor que el riesgo de desarrollar la enfermedad por una infección real de sarampión, que es aproximadamente 1 por cada 1.000 casos. Para una infección de rubéola, el riesgo es de 1 por cada 5.000 casos.[30][37] Algunas de las primeras vacunas, que más tarde se demostró que estaban contaminadas con tejido del SNC del animal huésped, llegaron a tener tasas de incidentes de leucoencefalitis hemorrágica aguda de 1 por cada 600.[27]
Diagnóstico
El término ADEM ha sido utilizado de manera inconsistente en diferentes momentos.[38] Actualmente, la norma internacional comúnmente aceptada para la definición de caso clínico es la publicada por el Grupo Internacional de Estudio de la EM Pediátrica, revisión de 2007.[39]
Dado que la definición es clínica, actualmente se desconoce si todos los casos con ADEM son positivos para autoanticuerpos anti-MOG, pero en cualquier caso parece muy relacionado con el diagnóstico de ADEM.[23]
Tratamiento
No se han realizado ensayos clínicos controlados sobre el tratamiento de la enfermedad, pero el tratamiento estándar es el dirigido a reducir rápidamente la inflamación del SNC. El tratamiento de primera línea ampliamente aceptado es la administración de altas dosis de corticoesteroides intravenosos,[40] como metilprednisolona o dexametasona, seguidas de 3 a 6 semanas de dosis orales de prednisolona gradualmente más bajas. Los pacientes tratados con metilprednisolona han mostrado mejores resultados que los tratados con dexametasona.[20] Las disminuciones orales de menos de tres semanas de duración muestran una mayor probabilidad de recaída,[11][18] y tienden a mostrar resultados más pobres.[cita requerida] Se ha informado de que otras terapias antiinflamatorias e inmunosupresoras muestran efectos beneficiosos, como la plasmaféresis, altas dosis de inmunoglobulina intravenosa (IVIg),[40][41] mitoxantrona y ciclofosfamida. Estas terapias se consideran terapias alternativas, utilizadas cuando los corticoesteroides no pueden utilizarse o no son efectivas.
Hay algunas pruebas que sugieren que los pacientes pueden responder a una combinación de metilprednisolona e inmunoglobulinas si no responden a ninguna de las dos por separado.[42] En un estudio de 16 niños con ADEM, 10 se recuperaron completamente después de una alta dosis de metilprednisolona, un caso grave que no respondió a los esteroides se recuperó completamente después de la terapia con inmunoglobulina intravenosa; los cinco casos más graves -con ADAM y neuropatía periférica grave- fueron tratados con metilprednisolona e inmunoglobulina en dosis altas combinadas, dos permanecieron parapléjicos, uno tenía discapacidades motoras y cognitivas, y dos se recuperaron. Una revisión reciente del tratamiento con inmunoglobulina intravenosa del ADEM (del cual el estudio anterior constituía el grueso de los casos) encontró que el 70% de los niños mostraron una recuperación completa después del tratamiento con IVIg, o IVIg más corticoides.[43] Un estudio del tratamiento con IVIg en adultos con ADEM demostró que la IVIg parece más eficaz para tratar las alteraciones sensoriales y motoras, mientras que los esteroides parecen ser más eficaces para tratar las alteraciones de la cognición, la conciencia y el rigor.[41] Este mismo estudio encontró un sujeto, un hombre de 71 años que no había respondido a los esteroides, que respondió a un tratamiento con IVIg 58 días después de la aparición de la enfermedad.
Pronóstico
La recuperación completa se observa en un 50 a 70% de los casos, con una recuperación de entre el 70 y el 90% con alguna discapacidad residual menor, el tiempo promedio para recuperarse es de uno a seis meses.[15] La tasa de mortalidad puede llegar al 5-10%.[44][45] Los resultados más deficientes están relacionados con la falta de respuesta al tratamiento con esteroides, síntomas neurológicos inusualmente severos o el inicio repentino. Los niños tienden a tener resultados más favorables que los adultos, y los casos que se presentan sin fiebre tienden a tener resultados más deficientes.[46] Este último efecto puede deberse ya sea a los efectos protectores de la fiebre o a que el diagnóstico y el tratamiento se buscan más rápidamente cuando hay fiebre.
La ADEM puede evolucionar hacia la escrerosis múltiple. Se considerará EM si algunas lesiones aparecen en diferentes momentos y áreas del cerebro[47]
Déficits motores
Se estima que los déficits motores residuales permanecen en alrededor del 8 al 30% de los casos, el rango de severidad va desde torpeza leve hasta ataxia y hemiparesia.[26]
Neurocognición
Los pacientes con enfermedades desmielinizantes, como la EM, han mostrado déficits cognitivos incluso cuando existe una mínima discapacidad física.[48] Las investigaciones sugieren que se observan efectos similares después de la ADEM, pero que los déficits son menos severos que los observados en la EM. Un estudio de seis niños con ADEM (edad promedio de presentación 7.7 años) fue probado en un conjunto de pruebas neurocognitivas después de ya llevasen un promedio de 3.5 años de recuperación.[49] Los seis niños quedaron dentro del rango normal en la mayoría de las pruebas, incluyendo el coeficiente intelectual verbal y el coeficiente intelectual para el trabajo, pero quedaron por debajo de lo normal para su edad en al menos una prueba, la de atención compleja (un niño), la de memoria a corto plazo (un niño) y en la de interiorización de la conducta/efecto (dos niños). Los promedios grupales para cada prueba estuvieron todos dentro de la media para su edad, demostrando que, como grupo, eran normales. Estos déficits fueron menos severos que los observados en niños de edades similares con un diagnóstico de EM.[50]
Otro estudio comparó diecinueve niños con antecedentes de ADEM, de los cuales diez tenían cinco años de edad o menos en ese momento (edad promedio de 3,8 años, examinados de nuevo un promedio de 3,9 años más tarde) y nueve eran mayores (edad promedio de 7,7 años en el momento de ADEM, examinados de nuevo un promedio de 2,2 años más tarde) con diecinueve pruebas.[51] Las puntuaciones en las pruebas de CI y los logros educativos fueron menores para el grupo ADEM que había tenido la enfermedad más pronto (promedio de CI 90) en comparación con los grupos de inicio tardío (promedio de CI 100) y los grupos de control (promedio de CI 106), mientras que los niños ADEM de inicio tardío obtuvieron menores puntuaciones en la velocidad de procesamiento verbal. Una vez más, las medias de todos los grupos se encontraban dentro de la media de las pruebas, lo que significa que mientras que los efectos eran estadísticamente fiables, los niños estaban en su conjunto, todavía dentro del rango normal. También hubo más problemas de comportamiento en el grupo de inicio temprano, aunque hay algunos indicios de que esto puede deberse, al menos en parte, al estrés de la hospitalización a una edad temprana.[52][53]
Investigación
La relación entre el ADEM y la encefalomielitis asociada al anti-MOG se está investigando actualmente. Se ha propuesto una nueva entidad llamada MOGDEM.[54]
En cuanto a los modelos animales, el principal modelo animal para la EM, la encefalomielitis autoinmune experimental (EAE) es también un modelo animal para la ADEM.[55] Al ser una enfermedad monofásica aguda, la EAE es mucho más parecida a la ADEM que a la EM.[56]
Referencias
- Dale RC (April 2003). «Acute disseminated encephalomyelitis». Semin Pediatr Infect Dis 14 (2): 90-5. PMID 12881796. doi:10.1053/spid.2003.127225.
- Garg RK (January 2003). «Acute disseminated encephalomyelitis». Postgrad Med J 79 (927): 11-7. PMC 1742586. PMID 12566545. doi:10.1136/pmj.79.927.11.
- Jones CT (November 2003). «Childhood autoimmune neurologic diseases of the central nervous system». Neurol Clin 21 (4): 745-64. PMID 14743647. doi:10.1016/S0733-8619(03)00007-0.
- «Post-vaccination encephalomyelitis: literature review and illustrative case». J Clin Neurosci 15 (12): :1315-1322. Dec 2008. PMID 18976924. doi:10.1016/j.jocn.2008.05.002.
- Rust RS (June 2000). «Multiple sclerosis, acute disseminated encephalomyelitis, and related conditions». Semin Pediatr Neurol 7 (2): 66-90. PMID 10914409. doi:10.1053/pb.2000.6693.
- «Disseminated encephalomyelitis and multiple sclerosis: two different diseases - a critical review». Acta Neurol. Scand. 116 (4): 201-6. October 2007. PMID 17824894. doi:10.1111/j.1600-0404.2007.00902.x.
- Lauren B. Krupp et al. Consensus definitions proposed for pediatric multiple sclerosis and related disorders, 2007 by AAN Enterprises, Inc. Archivado el 9 de febrero de 2015 en Wayback Machine.
- Koelman, Diederik L. H.; Chahin, Salim; Mar, Soe S.; Venkatesan, Arun; Hoganson, George M.; Yeshokumar, Anusha K.; Barreras, Paula; Majmudar, Bittu et al. (31 de mayo de 2016). «Acute disseminated encephalomyelitis in 228 patients A retrospective, multicenter US study». Neurology (en inglés) 86 (22): 2085-2093. ISSN 0028-3878. PMID 27164698. doi:10.1212/WNL.0000000000002723.
- Leake JA, Albani S, Kao AS (August 2004). «Acute disseminated encephalomyelitis in childhood: epidemiologic, clinical and laboratory features». Pediatr. Infect. Dis. J. 23 (8): 756-64. PMID 15295226. doi:10.1097/01.inf.0000133048.75452.dd.
- Hynson JL, Kornberg AJ, Coleman LT, Shield L, Harvey AS, Kean MJ (May 2001). «Clinical and neuroradiologic features of acute disseminated encephalomyelitis in children». Neurology 56 (10): 1308-12. PMID 11376179. doi:10.1212/WNL.56.10.1308.
- Anlar B, Basaran C, Kose G (August 2003). «Acute disseminated encephalomyelitis in children: outcome and prognosis». Neuropediatrics 34 (4): 194-9. PMID 12973660. doi:10.1055/s-2003-42208.
- Schwarz S, Mohr A, Knauth M, Wildemann B, Storch-Hagenlocher B (May 2001). «Acute disseminated encephalomyelitis: a follow-up study of 40 adult patients». Neurology 56 (10): 1313-8. PMID 11376180. doi:10.1212/WNL.56.10.1313.
- Bhatt, P; Bray, L; Raju, S; Chaudhari, R; Bhatt, NS; Donda, K (2019). «Temporal Trends of Pediatric Hospitalizations with Acute Disseminated Encephalomyelitis in the United States: An Analysis from 2006 to 2014 using National Inpatient Sample». Journal of Pediatrics 206: 26-32.e1. PMID 30528761. doi:10.1016/j.jpeds.2018.10.044.
- Koelman, Diederik L. H.; Mateen, Farrah J. (13 de marzo de 2015). «Acute disseminated encephalomyelitis: current controversies in diagnosis and outcome». Journal of Neurology (en inglés) 262 (9): 2013-2024. ISSN 0340-5354. PMID 25761377. doi:10.1007/s00415-015-7694-7.
- Menge T, Kieseier BC, Nessler S, Hemmer B, Hartung HP, Stüve O (June 2007). «Acute disseminated encephalomyelitis: an acute hit against the brain». Curr. Opin. Neurol. 20 (3): 247-54. PMID 17495616. doi:10.1097/WCO.0b013e3280f31b45.
- Wingerchuk DM (May 2003). «Postinfectious encephalomyelitis». Curr Neurol Neurosci Rep 3 (3): 256-64. PMID 12691631. doi:10.1007/s11910-003-0086-x.
- Poser CM (May 2008). «Multiple sclerosis and recurrent disseminated encephalomyelitis are different diseases». Arch. Neurol. 65 (5): 674; author reply 674-5. PMID 18474749. doi:10.1001/archneur.65.5.674-a.
- Dale RC, de Sousa C, Chong WK, Cox TC, Harding B, Neville BG (December 2000). «Acute disseminated encephalomyelitis, multiphasic disseminated encephalomyelitis and multiple sclerosis in children». Brain 123 (12): 2407-22. PMID 11099444. doi:10.1093/brain/123.12.2407.
- Di Pauli Franziska (2015). «Fulminant demyelinating encephalomyelitis». Neurol Neuroimmunol Neuroinflamm 2 (6): e175. PMC 4635550. PMID 26587556. doi:10.1212/NXI.0000000000000175.
- Tenembaum S, Chamoles N, Fejerman N (October 2002). «Acute disseminated encephalomyelitis: a long-term follow-up study of 84 pediatric patients». Neurology 59 (8): 1224-31. PMID 12391351. doi:10.1212/WNL.59.8.1224.
- Allmendinger A, Krauthamer A, Spektor V (2009). «Case of the month». Diagnostic Imaging 31 (12): 10.
- Reindl, M; Di Pauli, F; Rostásy, K; Berger, T (Aug 2013). «The spectrum of MOG autoantibody-associated demyelinating diseases». Nat Rev Neurol 9 (8): 455-61. PMID 23797245. doi:10.1038/nrneurol.2013.118.
- Weber MS, Derfuss T, Brück W (2018). «Anti–Myelin Oligodendrocyte Glycoprotein Antibody–Associated Central Nervous System Demyelination—A Novel Disease Entity?». JAMA Neurol 75 (8): 909-910. doi:10.1001/jamaneurol.2018.1055.
- Kamel MG, Nam NT, Han NH, El-Shabouny AE, Makram AM, Abd-Elhay FA, Dang TN, Hieu NL, Huong VT, Tung TH, Hirayama K, Huy (2017). «Post-dengue acute disseminated encephalomyelitis: A case report and meta-analysis». PLoS Negl Trop Dis 11 (6): e0005715. doi:10.1371/journal.pntd.0005715.
- Fisher, DL; Defres, S; Solomon, T (2015). «Measles-induced encephalitis». QJM 108 (3): 177-182. PMID 24865261. doi:10.1093/qjmed/hcu113.
- Tenembaum S, Chitnis T, Ness J, Hahn JS (April 2007). «Acute disseminated encephalomyelitis». International Pediatric MS Study Group. Neurology 68 (16 Suppl 2): S23-36. PMID 17438235. doi:10.1212/01.wnl.0000259404.51352.7f.
- Hemachudha T, Griffin DE, Giffels JJ, Johnson RT, Moser AB, Phanuphak P (February 1987). «Myelin basic protein as an encephalitogen in encephalomyelitis and polyneuritis following rabies vaccination». N. Engl. J. Med. 316 (7): 369-74. PMID 2433582. doi:10.1056/NEJM198702123160703.
- Hemachudha T, Griffin DE, Johnson RT, Giffels JJ (January 1988). «Immunologic studies of patients with chronic encephalitis induced by post-exposure Semple rabies vaccine». Neurology 38 (1): 42-4. PMID 2447520. doi:10.1212/WNL.38.1.42.
- Murthy JM (September 2002). «Acute disseminated encephalomyelitis». Neurol India 50 (3): 238-43. PMID 12391446.
- Fenichel GM (August 1982). «Neurological complications of immunization». Ann. Neurol. 12 (2): 119-28. PMID 6751212. doi:10.1002/ana.410120202.
- Takahashi H, Pool V, Tsai TF, Chen RT (July 2000). «Adverse events after Japanese encephalitis vaccination: review of post-marketing surveillance data from Japan and the United States. The VAERS Working Group». Vaccine 18 (26): 2963-9. PMID 10825597. doi:10.1016/S0264-410X(00)00111-0.
- Tourbah A, Gout O, Liblau R (July 1999). «Encephalitis after hepatitis B vaccination: recurrent disseminated encephalitis or MS?». Neurology 53 (2): 396-401. PMID 10430433. doi:10.1212/WNL.53.2.396.
- Karaali-Savrun F, Altintaş A, Saip S, Siva A (November 2001). «Hepatitis B vaccine related-myelitis?». Eur. J. Neurol. 8 (6): 711-5. PMID 11784358. doi:10.1046/j.1468-1331.2001.00290.x.
- Sejvar JJ, Labutta RJ, Chapman LE, Grabenstein JD, Iskander J, Lane JM (December 2005). «Neurologic adverse events associated with smallpox vaccination in the United States, 2002-2004». JAMA 294 (21): 2744-50. PMID 16333010. doi:10.1001/jama.294.21.2744.
- Ozawa H, Noma S, Yoshida Y, Sekine H, Hashimoto T (August 2000). «Acute disseminated encephalomyelitis associated with poliomyelitis vaccine». Pediatr. Neurol. 23 (2): 177-9. PMID 11020647. doi:10.1016/S0887-8994(00)00167-3.
- Stratton, Kathleen R.; Howe, Cynthia J.; Johnston Jr., Richard B., eds. (1994). Adverse Events Associated with Childhood Vaccines: Evidence Bearing on Causality. The National Academies Press. pp. 125-126. ISBN 978-0-309-07496-4. Consultado el 6 de diciembre de 2015.
- Miller HG, Stanton JB, Gibbons JL (1956). «Parainfectious encephalomyelitis and related syndromes». Quarterly Journal of Medicine 25 (100): 427-505. PMID 13379602.
- JordanCole et al, Acute Disseminated Encephalomyelitis in Children: An updated review based on current diagnostic criteria, Pediatric Neurology, 3 July 2019, https://doi.org/10.1016/j.pediatrneurol.2019.06.017
- Tenembaum S, Chitnis T, Ness J, Hahn JS (2007). «Acute disseminated encephalomyelitis». Neurology 68 (16 suppl 2): S23-S36. PMID 17438235. doi:10.1212/01.wnl.0000259404.51352.7f.
- Shahar E, Andraus J, Savitzki D, Pilar G, Zelnik N (November 2002). «Outcome of severe encephalomyelitis in children: effect of high-dose methylprednisolone and immunoglobulins». J. Child Neurol. 17 (11): 810-4. PMID 12585719. doi:10.1177/08830738020170111001.
- Ravaglia S, Piccolo G, Ceroni M (November 2007). «Severe steroid-resistant post-infectious encephalomyelitis: general features and effects of IVIg». J. Neurol. 254 (11): 1518-23. PMID 17965959. doi:10.1007/s00415-007-0561-4.
- Straussberg R, Schonfeld T, Weitz R, Karmazyn B, Harel L (February 2001). «Improvement of atypical acute disseminated encephalomyelitis with steroids and intravenous immunoglobulins». Pediatr. Neurol. 24 (2): 139-43. PMID 11275464. doi:10.1016/S0887-8994(00)00229-0.
- Feasby T, Banwell B, Benstead T (April 2007). «Guidelines on the use of intravenous immune globulin for neurologic conditions». Transfus Med Rev 21 (2 Suppl 1): S57-107. PMID 17397768. doi:10.1016/j.tmrv.2007.01.002.
- "Menge et al. 2007"
- Kamel MG, Nam NT, Han NH, El-Shabouny AE, Makram AM, Abd-Elhay FA, Dang TN, Hieu NL, Huong VT, Tung TH, Hirayama K, Huy NT (2017). «Post-dengue acute disseminated encephalomyelitis: A case report and meta-analysis». PLoS Negl Trop Dis 11 (6): e0005715. doi:10.1371/journal.pntd.0005715.
- Lin CH, Jeng JS, Hsieh ST, Yip PK, Wu RM (February 2007). «Acute disseminated encephalomyelitis: a follow-up study in Taiwan». J. Neurol. Neurosurg. Psychiatry 78 (2): 162-7. PMC 2077670. PMID 17028121. doi:10.1136/jnnp.2005.084194.
- Malo-Pion, Caroline; Lambert, Raymond; Décarie, Jean-Claude; Turpin, Sophie (2018). «Imaging of Acquired Demyelinating Syndrome with 18F-FDG PET/CT». Clinical Nuclear Medicine 43 (2): 103-105. PMID 29215409. doi:10.1097/RLU.0000000000001916.
- Foong J, Rozewicz L, Quaghebeur G (January 1997). «Executive function in multiple sclerosis. The role of frontal lobe pathology». Brain 120 (1): 15-26. PMID 9055794. doi:10.1093/brain/120.1.15.
- Hahn CD, Miles BS, MacGregor DL, Blaser SI, Banwell BL, Hetherington CR (August 2003). «Neurocognitive outcome after acute disseminated encephalomyelitis». Pediatr. Neurol. 29 (2): 117-23. PMID 14580654. doi:10.1016/S0887-8994(03)00143-7.
- Banwell BL, Anderson PE (March 2005). «The cognitive burden of multiple sclerosis in children». Neurology 64 (5): 891-4. PMID 15753431. doi:10.1212/01.WNL.0000152896.35341.51.
- Jacobs RK, Anderson VA, Neale JL, Shield LK, Kornberg AJ (September 2004). «Neuropsychological outcome after acute disseminated encephalomyelitis: impact of age at illness onset». Pediatr. Neurol. 31 (3): 191-7. PMID 15351018. doi:10.1016/j.pediatrneurol.2004.03.008.
- Douglas JW (August 1975). «Early hospital admissions and later disturbances of behaviour and learning». Dev Med Child Neurol 17 (4): 456-80. PMID 1158052. doi:10.1111/j.1469-8749.1975.tb03497.x.
- Daviss WB, Racusin R, Fleischer A, Mooney D, Ford JD, McHugo GJ (May 2000). «Acute stress disorder symptomatology during hospitalization for pediatric injury». J Am Acad Child Adolesc Psychiatry 39 (5): 569-75. PMID 10802974. doi:10.1097/00004583-200005000-00010.
- Tatsuro Misu, Kazuo Fujihara, Neuromyelitis optica spectrum and myelin oligodendrocyte glycoprotein antibody‐related disseminated encephalomyelitis, Cli. and exp. neuroimmunology, Volume10, Issue1, February 2019, Pages 9-17, https://doi.org/10.1111/cen3.12491
- Rivers TM, Schwentker FF (1935). «Encephalomyelitis accompanied by myelin destruction experimentally produced in monkeys». J. Exp. Med. 61 (5): 689-701. PMC 2133246. PMID 19870385. doi:10.1084/jem.61.5.689.
- Sriram S, Steiner I (December 2005). «Experimental allergic encephalomyelitis: a misleading model of multiple sclerosis». Ann. Neurol. 58 (6): 939-45. PMID 16315280. doi:10.1002/ana.20743.
- Esta obra contiene una traducción derivada de «Acute disseminated encephalomyelitis» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.