Bacteriófago T7
El bacteriófago T7 (o el fago T7) es un bacteriófago, virus que infecta a las bacterias. Infecta a la mayoría de las cepas de Escherichia coli y depende de estos huéspedes para propagarse. Tiene un ciclo de vida lítico, lo que significa que destruye la célula que infecta. También posee varias propiedades que lo convierten en un fago ideal para la experimentación: su purificación y concentración han producido valores consistentes en análisis químicos; puede volverse no infeccioso por exposición a la luz ultravioleta; y se puede utilizar en la presentación de fagos para clonar proteínas de unión a ARN.[1]
| T7 | ||
|---|---|---|
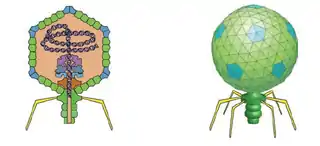 Estructura del bacteriófago T7 | ||
| Taxonomía | ||
| Dominio: | Duplodnaviria | |
| Clase: | Caudoviricetes | |
| Familia: | Autographiviridae | |
| Género: | Teseptimavirus | |
| Especie: | Virus de Escherichia T7 | |
| Clasificación de Baltimore | ||
| Grupo: | I (Virus ADN bicatenario) | |
Descubrimiento
En un estudio de 1945 de Demerec y Fano,[2] T7 se utilizó para describir uno de los siete tipos de fagos (T1 a T7) que crecen líticamente en Escherichia coli;[3] aunque los siete fagos se numeraron arbitrariamente, más tarde se descubrió que los fagos con números impares, o fagos T-impares, compartían características morfológicas y bioquímicas que los distinguen de los fagos T-pares.[4] Antes de ser referido físicamente como T7, el fago se utilizó en experimentos anteriores. El biofísico germano-estadounidense Max Delbrück trabajó con el mismo virus a fines de la década de 1930, llamándolo fago δ, y el microbiólogo franco-canadiense Félix d'Herelle probablemente estudió a su pariente cercano en la década de 1920.[5][3]
Anfitriones
T7 crece en cepas rugosas de Escherichia coli (es decir, aquellas sin polisacárido de antígeno O de longitud completa en su superficie) y algunas otras bacterias entéricas, pero parientes cercanos también infectan cepas lisas e incluso encapsuladas.[6] sss E. coli es más resistente a T7 que a algunos otros fagos similares.
Estructura del vivión


El virus tiene una simetría estructural compleja, con una cápside del fago que es icosaédrica (veinte caras) con un diámetro interno de 55 nm y una cola de 19 nm de diámetro y 28,5 nm de longitud unida a la cápside.[7] La expulsión de proteínas de la cápside tras la infección hace que el virus cambie de estructura cuando ingresa a la célula.[8]
Genoma
El genoma del fago T7 fue uno de los primeros genomas completamente secuenciados y se publicó en 1983.[9][10] La cabeza de la partícula del fago contiene el genoma de ADN bicatenario de aproximadamente 40 kpb que codifica 55 proteínas.[11]
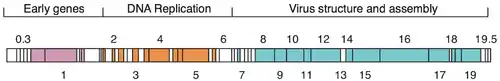
Ciclo de vida
T7 tiene un ciclo de vida de 17 min a 37 °C, es decir, el tiempo desde la infección hasta la lisis de la célula huésped cuando se liberan nuevos fagos. Debido al corto período de latencia, la mayoría de los estudios fisiológicos se realizan a 30 °C, donde las células infectadas se lisan después de 30 min. Sin embargo, se han aislado cepas de T7 de alta aptitud con un período de latencia de solo ~ 11 min a 37 °C creciendo en condiciones óptimas en resultados de medios enriquecidos. Este fago adaptado puede experimentar una expansión efectiva de su población en más de 1013 en una hora de crecimiento.[13]
Infección de bacterias huésped




El fago T7 reconoce ciertos receptores en la superficie de las células de E. coli y se une a la superficie celular mediante las fibras de la cola viral. En algunas cepas de T7, las fibras de la cola se reemplazan con picos de la cola que degradan los antígenos O o K en la superficie celular por medio de la actividad enzimática.
El proceso de adsorción y penetración utiliza lisozimas para crear una abertura dentro de la capa de peptidoglicano de la pared celular bacteriana, lo que permite la transferencia del ADN viral a la bacteria. La cola corta y rechoncha del fago similar a T7 es demasiado corta para abarcar la envoltura celular y, para expulsar el genoma del fago en la célula al inicio de la infección, las proteínas del virión primero deben hacer un canal desde la punta de la cola. en el citoplasma celular.[14] El fago también libera cinco proteínas necesarias para comenzar la replicación del genoma viral y escindir el genoma del huésped.[15] T7 se ha desarrollado para anular varias de las defensas de la bacteria huésped, incluida la pared celular de peptidoglicano y el sistema CRISPR.[15] Una vez que el fago T7 ha insertado el genoma viral, el proceso de replicación del ADN del genoma del hospedador se detiene y comienza la replicación del genoma viral.
En condiciones óptimas, el fago T7 puede completar el proceso lítico en 25 minutos, lo que lleva a la muerte de la célula huésped de E. coli. En el momento de la lisis, el virus puede producir más de 100 descendientes.[15]
Componentes
Gp5 (codificada por el gen gp5 ) es la ADN polimerasa del fago T7. La polimerasa T7 utiliza la tiorredoxina endógena de E. coli, una proteína REDOX, como abrazadera deslizante durante la replicación del ADN del fago (aunque la tiorredoxina normalmente tiene una función diferente). La abrazadera deslizante funciona para mantener la polimerasa en el ADN, lo que aumenta la velocidad de síntesis.[16]
Replicación y reparación del ADN
El fago T7 tiene el replisoma de ADN más simple conocido, que consiste en una helicasa y una primasa que residen en una sola cadena polipeptídica que forma un hexámero en presencia de ADN y ATP o dTTP. La ADN polimerasa de T7, asistida por la tiorredoxina de E. coli, realiza la síntesis de ADN de hebra principal y retrasada.
En el fago T7, las roturas de la doble hebra del ADN probablemente se reparan mediante la inserción de un parche de ADN del donante en un espacio en el sitio de rotura.[17] Esta reparación de roturas de doble hebra es facilitada por la proteína del gen 2.5 que promueve el apareamiento de hebras complementarias homólogas de ADN.[18]
Intermedios replicativos
El ADN intracelular de replicación del fago T7, cuando se estira después de la lisis celular, suele ser más largo que el cromosoma del fago maduro (11 a 15 µM) y puede presentarse en forma de hebras lineales altamente concatenadas de hasta 66 veces la longitud del fago maduro. cromosoma.[19] El ADN en replicación también se puede ver en forma de estructuras de anillos enrollados que parecen corresponder a configuraciones de ADN en bucles múltiples en las que los giros superhélicos, necesarios para la compactación del ADN, se alivian mediante cortes en las hebras tras la lisis celular.
Aplicaciones en biología molecular
La secuencia del promotor de T7 se usa ampliamente en biología molecular debido a su afinidad extremadamente alta por la ARN polimerasa T7 y, por lo tanto, a su alto nivel de expresión.
Se ha utilizado como modelo en biología sintética.[20] El ADN modificado se diseñó para que fuera más fácil trabajar con él de varias maneras: los elementos funcionales individuales se separaron mediante sitios de endonucleasas de restricción para una modificación simple, y los dominios de codificación de proteínas superpuestos se separaron y, cuando fue necesario, se modificaron por un solo par de bases; mutaciones silenciosas. La T7 se ha probado en osteosarcoma humano para tratar células tumorales.
Referencias
- name=":1"
- Demerec M, Fano U (March 1945). «Bacteriophage-Resistant Mutants in Escherichia Coli». Genetics 30 (2): 119-36. PMC 1209279. PMID 17247150.
- Bacteriophages. Academic Press. 31 de diciembre de 2012. pp. 226-. ISBN 978-0-12-394788-8.
- Cammack, Richard; Atwood, Teresa; Campbell, Peter; Parish, Howard; Smith, Anthony; Vella, Frank; Stirling, John, eds. (2006). Oxford Dictionary of Biochemistry and Molecular Biology. Oxford University Press. ISBN 9780191727641. doi:10.1093/acref/9780198529170.001.0001.
- d’Herelle, F. (1926). The Bacteriophage and Its Behavior. Baltimore, MD: Williams & Wilkins
- Molineux, I. J. (2006). Chapter 20: The T7 group. In: The Bacteriophages (R. Calendar, ed.), pp. 277. Oxford University Press, Oxford.
- «Teseptimavirus ~ ViralZone page». viralzone.expasy.org. Consultado el 18 de noviembre de 2019.
- Molineux, Ian J.; Panja, Debabrata (March 2013). «Popping the cork: mechanisms of phage genome ejection». Nature Reviews Microbiology 11 (3): 194-204. ISSN 1740-1534. PMID 23385786. S2CID 205498472. doi:10.1038/nrmicro2988.
- «Genome of bacteriophage T7». Consultado el 18 de mayo de 2011.
- Dunn, J. J.; Studier, F. W. (1983). «Complete nucleotide sequence of bacteriophage T7 DNA and the locations of T7 genetic elements». Journal of Molecular Biology 166 (4): 477-535. PMID 6864790. doi:10.1016/S0022-2836(83)80282-4.
- «Uniprot: reference proteome of bacteriophage T7».
- Häuser, R; Blasche, S; Dokland, T; Haggård-Ljungquist, E; von Brunn, A; Salas, M; Casjens, S; Molineux, I et al. (2012). Bacteriophage protein-protein interactions. Advances in Virus Research 83. pp. 219-98. ISBN 9780123944382. PMC 3461333. PMID 22748812. doi:10.1016/B978-0-12-394438-2.00006-2.
- Heineman, R. H.; Bull, J. J. (2007). «Testing Optimality with Experimental Evolution: Lysis Time in a Bacteriophage». Evolution 61 (7): 1695-1709. PMC 1974807. PMID 17598749. doi:10.1111/j.1558-5646.2007.00132.x.
- Chang, C. Y.; Kemp, P; Molineux, I. J. (2010). «Gp15 and gp16 cooperate in translocating bacteriophage T7 DNA into the infected cell». Virology 398 (2): 176-86. PMC 2825023. PMID 20036409. doi:10.1016/j.virol.2009.12.002.
- «New Details about Bacteriophage T7-Host Interactions». Archivado desde el original el 17 de agosto de 2011.
- Jeffery, Constance J. (1 de enero de 1999). «Moonlighting proteins». Trends in Biochemical Sciences 24 (1): 8-11. ISSN 0968-0004. PMID 10087914. doi:10.1016/S0968-0004(98)01335-8.
- Lai YT, Masker W. Repair of double-strand breaks by incorporation of a molecule of homologous DNA. Mol Microbiol. 2000 Apr;36(2):437-46. PubMed
- Yu M, Masker W. T7 single strand DNA binding protein but not T7 helicase is required for DNA double strand break repair. J Bacteriol. 2001 Mar;183(6):1862-9.PubMed
- Bernstein C, Bernstein H. Coiled rings of DNA released from cells infected with bacteriophages T7 or T4 or from uninfected Escherichia coli. J Virol. 1974 Jun;13(6):1346-55. doi: 10.1128/JVI.13.6.1346-1355.1974. PMID: 4598784; PMCID: PMC355455.
- Chan LY, Kosuri S, Endy D (2005). «Refactoring bacteriophage T7». Molecular Systems Biology 1: E1-E10. PMC 1681472. PMID 16729053. doi:10.1038/msb4100025.
Enlaces externos
- MeSH: T7+Phage (en inglés)
- ViralZone
- New Details about T7-host interactions. Revista de microbios
- T7 reference proteome en Uniprot