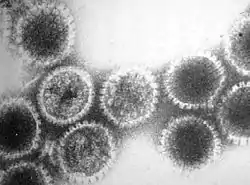
Duplodnaviria
Duplodnaviria es un dominio de virus de ADN que se caracterizan por codificar una proteína exclusiva para la formación de la cápside llamada HK97-MCP y una enzima única llamada terminasa. Incluye a los clásicos caudovirus de procariotas (clase Caudoviricetes) junto con sus descendientes eucariotas; los herpesvirus (orden Herpesvirales) y los mirusvirus (filo Mirusviricota).[1][2]
| Duplodnaviria | ||
|---|---|---|
 Viriones de caudovirus y un herpesvirus. | ||
| Taxonomía | ||
| Dominio: | Duplodnaviria | |
| Clasificación de Baltimore | ||
| Grupo: | I (Virus ADN bicatenario) | |
| Clasificación | ||
| ||
Todos los virus de este dominio tienen genomas de ADN bicatenario y una cápside icosaedrica. Se ha reconocido una relación entre los caudovirus y herpesvirus durante mucho tiempo y esta relación se formalizó en 2019 con la creación del dominio Duplodnaviria. La primera parte de su nombre "duplo" proviene del latín que significa "doble" y "viria" es el sufijo usado para los dominios virales.[2] Los caudovirus son el grupo más predominante del dominio ya que infectan a casi todos los filos de bacterias y arqueas. También infectaron al último antepasado común universal.[3]
Historia
Los caudovirus fueron descubiertos de forma independiente por Frederick Twort en 1915 y Félix d'Herelle en 1917 y han sido el foco de muchas investigaciones desde ese entonces. Las enfermedades en humanos causadas por herpesvirus han sido reconocidas durante gran parte de la historia registrada y la transmisión de persona a persona del virus del herpes simple. El primer herpesvirus descubierto, fue descrito por Émile Vidal en 1898.[2]
Con el tiempo, se encontró que los dos grupos compartían muchas características, y su relación filogenética se formalizó con el establecimiento de Duplodnaviria en 2019. El establecimiento del dominio el mismo año también ha creado un marco para permitir más fácilmente una reorganización importante en Caudoviricetes, que está creciendo fuertemente en especies descubiertas y que puede requerir que los caudovirus sean promovidos a rangos de clases o superior.[2]
Taxonomía
La taxonomía propuesta por el Comité Internacional de Taxonomía de Virus y otros estudios es la siguiente:[1][4]
- Dominio Duplodnaviria
- Reino Heunggongvirae
- Orden Herpesvirales
- Clase Caudoviricetes
- Filo Mirusviricota
- Reino Heunggongvirae
Características
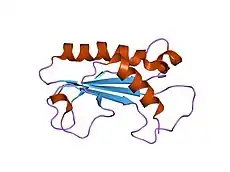
Todos los virus de Duplodnaviria contienen una cápside icosaédrica distinta que se compone de una proteína de la cápside principal que contiene una estructura plegada única denominada pliegue HK97, que lleva el nombre de la estructura plegada del MCP de la especie de bacteriófago Escherichia virus HK97. A pesar de tener una variación significativa a través de Duplodnaviria, la estructura de base de la proteína se conserva entre todas las especies del dominio. Otras proteínas compartidas que involucran la estructura y el ensamblaje de las cápsides incluyen una proteína portal de la que está hecha la apertura de la cápside, una proteasa que vacía la cápside antes de que se inserte el ADN y la enzima terminasa que inserta el ADN en la cápside.[2][5][6][7]
Una vez que los ribosomas de la célula huésped sintetizan la HK97-MCP, la cápside viral se ensambla a partir de ella y las proteínas se unen entre sí. El interior de la cápside contiene proteínas de andamio que guían la construcción geométrica de la cápside. En ausencia de proteínas de armazón separadas, el dominio delta de HK97-MCP, que mira hacia el interior de la cápside, actúa como una proteína de armazón.[5][2][6][7]
Se crea una abertura cilíndrica en la cápside, llamada portal, que sirve como entrada y salida para el ADN viral con proteínas portal en uno de los 12 vértices de la cápside. La proteína del armazón, que puede ser el dominio delta de HK97-MCP, es eliminada del interior de la cápside por la proteasa de maduración de la cápside, que también puede ser parte del armazón, descomponiéndola y reduciéndola a moléculas más pequeñas en un proceso llamado proteólisis que deja vacío el interior de la cápside.[5][2][6][7]
Al mismo tiempo que el ensamblaje de la cápside, se produce la replicación del ADN viral, creando concatémeros, moléculas largas de ADN que contienen numerosas copias del genoma viral. La enzima terminasa, formada por dos subunidades, grande y pequeña, encuentra el ADN viral dentro de la célula a través de la subunidad pequeña, corta los concatémeros y crea los extremos, o terminaciones, de los genomas. La terminasa reconoce una señal de empaquetamiento en el genoma y corta el ácido nucleico, creando un extremo libre al que se une.[5][2][6][7]
La terminasa, ahora unida al concatémero, se adhiere al portal de la cápside y comienza a trasladar el ADN desde el exterior de la cápside hacia el interior, utilizando energía generada a partir de la hidrólisis del ATP por la subunidad grande. A medida que se inserta más ADN en la cápside, la cápside se expande de tamaño, se vuelve más delgada y su superficie se vuelve más plana y angular. Una vez que el genoma está completamente dentro, la terminasa corta el concatémero nuevamente, completando el empaque. La terminasa luego se separa del portal y procede a repetir este proceso hasta que se hayan empaquetado todos los genomas en el concatémero.[5][2][6][7]
Para los caudovirus después del empaquetamiento de ADN, la cola del virión, que se ensambla por separado, se une a la cápside, comúnmente llamada "cabeza" de los caudovirus con cola, en el portal. Los caudovirus también tienen a veces proteínas de "decoración" que se adhieren a la superficie de la cápside para reforzar la estructura de la cápside. Una vez que el virión está completamente ensamblado dentro de la célula huésped, abandona la célula. Los caudovirus abandonan la célula mediante lisis, ruptura de la membrana celular, que causa la muerte celular y los herpesvirus salen por gemación de la membrana de la célula huésped, utilizando la membrana como envoltura vírica que cubre la cápside.[5][2][6][7]
Los virus de Duplodnaviria tienen dos tipos diferentes de ciclos de replicación llamados: ciclo lítico, en el que la infección conduce directamente a la formación de viriones y la salida de la célula huésped, y el ciclo lisogénico, en el que una infección latente retiene el ADN viral dentro de la célula huésped sin formación de virión, ya sea como un episoma o mediante la integración en el ADN de la célula huésped, con la posibilidad de volver al ciclo lítico en el futuro. Los virus que pueden replicarse a través del ciclo lisogénico se denominan virus templados o lisogénicos. Los caudovirus varían en su templanza, mientras que todos los herpesvirus son templados y pueden evitar ser detectados por el sistema inmunitario del huésped, causando infecciones de por vida.[8][9]
Enfermedades y causas
Los caudovirus son ubicuos en todo el mundo y son una de las principales causas de muerte en los procariotas. La infección puede conducir a la muerte celular por lisis, la ruptura de la membrana celular. Como resultado de la lisis, el material orgánico de los procariotas muertos se libera al medio ambiente, lo que contribuye a un proceso llamado derivación viral. Los caudovirus desvían los nutrientes del material orgánico de los niveles tróficos más altos para que puedan ser consumidos por organismos en niveles tróficos más bajos, lo que tiene el efecto de reciclar los nutrientes y promover una mayor diversidad entre la vida marina.[10]
Los herpesvirus están asociados con una amplia gama de enfermedades en animales como una enfermedad del tracto respiratorio en los pollos, una enfermedad respiratoria y reproductiva del ganado y tumores en las tortugas marinas. En los seres humanos, los herpesvirus suelen causar diversas enfermedades epiteliales, como el herpes, la varicela y el sarcoma de Kaposi. Los herpesvirus pueden salir de su estado latente y causar enfermedades, que pueden tener síntomas graves como encefalitis y neumonía.[11][12][13]
Origen y evolución

Se ha sugerido que los virus de este dominio se originaron antes que el último antepasado común universal en protobiontes durante la etapa final del mundo de ARN conocida como "mundo de ADN". Algunos virus de Duplodnaviria (principalmente los cuadovirus) tienen uracilo en su ADN denominado ADN-U, el uracilo es considerado un nucleótido típico del ARN. Este tipo de ADN esta ausente en las células, por lo que dichos virus podrían representar una reliquia de la transición del ARN al ADN de dicho mundo. La fusión de un replicón con una ADN polimerasa, la terminasa, la HK97-MCP y proteínas de dominio DUF1884, hélice-hebra, dodecinas y encapsulinas llevó a la formación de los viriones de Duplodnaviria, que al principio no tendrían la cola contráctil, por lo que esta se habría desarrollado después de LUCA.[3] Los caudovirus son uno de los linajes de virus más antiguos del mundo porque son ubicuos en todo el mundo, solo infectan a los procariotas y tienen un alto nivel de diversidad.[3][14] Los Herpesvirales y Mirusviricota que infectan eucariotas se originaron de los caudovirus de la familia Straboviridae especialmente de un ancestro compartido con su subfamilia Tevenvirinae, basado en la secuencia de aminoácidos. Se ha sugerido que Mirusviricota es un eslabón intermedio entre los caudavirus y los herpesvirus. Los grupos de virus eucariotas llegaron a estos a través de las arqueas y las proteobacterias cuando se dio la endosimbiosis seriada entre estos dos que originarían a los eucariotas.[2][15]
Las virus de Duplodnaviria parecen estar relacionados con los nanocompartimientos de encapsulina, orgánulos procariotas que consisten en compartimientos proteicos esféricos, similares a las cápsides virales y que están involucrados en varios aspectos del metabolismo, en particular protegiendo a las bacterias y arqueas del estrés oxidativo. Los virus de Duplodnaviria pueden estar relacionados con el origen de estas estructuras ya que comparten la proteína homóloga principal y según los análisis filogenéticos de las secuencias proteicas los nanocompartimientos de encapsulina se originaron a partir de las cápsides de los caudovirus.[2]
La subunidad ATPasa de las terminaciones de Duplodnaviria que genera energía para el empaquetamiento del ADN viral tiene el mismo diseño estructural general del pliegue del bucle P de las ATPasas de empaque de los virus del dominio Varidnaviria lo que puede sugerir una relación entre estos.[16]
Referencias
- Morgan Gaïa, Lingjie Meng, Eric Pelletier, Patrick Forterre, Chiara Vanni, Antonio Fernandez-Guerra, Olivier Jaillon, Patrick Wincker, Hiroyuki Ogata, Tom O. Delmont. (2021). Plankton-infecting relatives of herpesviruses clarify the evolutionary trajectory of giant viruses. Biorxiv.
- Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH (18 de octubre de 2019). «Create a megataxonomic framework, filling all principal/primary taxonomic ranks, for dsDNA viruses encoding HK97-type major capsid proteins» (docx). International Committee on Taxonomy of Viruses (en inglés). Consultado el 19 de mayo de 2020.
- Krupovic, M; Dolja, VV; Koonin, EV (14 de julio de 2020). «The LUCA and its complex virome.». Nat Rev Microbiol. PMID 32665595. doi:10.1038/s41579-020-0408-x. Consultado el 16 de agosto de 2020.
- «Virus Taxonomy: 2023 Release». talk.ictvonline.org. International Committee on Taxonomy of Viruses. Consultado el 22 de abril de 2023.
- Duda RL, Oh B, Hendrix RW (9 de agosto de 2013). «Functional domains of the HK97 capsid maturation protease and the mechanisms of protein encapsidation». J Mol Biol 425 (15): 2765-2781. PMC 3709472. PMID 23688818. doi:10.1016/j.jmb.2013.05.002.
- Suhanovsky MM, Teschke CM (May 2015). «Nature's favorite building block: Deciphering folding and capsid assembly of proteins with the HK97-fold». Virology. 479-480: 479-480. PMC 4424165. PMID 25864106. doi:10.1016/j.virol.2015.02.055.
- Rao VB, Feiss M (November 2015). «Mechanisms of DNA Packaging by Large Double-Stranded DNA Viruses». Annu Rev Virol 2 (1): 351-378. PMC 4785836. PMID 26958920. doi:10.1146/annurev-virology-100114-055212.
- «Virus latency». ViralZone. Swiss Institute of Bioinformatics. Consultado el 15 de junio de 2022.
- Weidner-Glunde M, Kruminis-Kaszkiel E, Savanagoudar M (February 2020). «Herpesviral Latency—Common Themes». Pathogens 9 (2): 125. PMC 7167855. PMID 32075270. doi:10.3390/pathogens9020125.
- Wilhelm SW, Suttle CA (October 1999). «Viruses and Nutrient Cycles in the Sea: Viruses play critical roles in the structure and function of aquatic food webs». BioScience 49 (10): 781-788. JSTOR 1313569. doi:10.2307/1313569. Consultado el 15 de junio de 2020.
- Kukhanova MK, Korovina AN, Kochetkov SN (December 2014). «Human herpes simplex virus: life cycle and development of inhibitors». Biochemistry (Mosc) 79 (13): 1635-1652. PMID 25749169. doi:10.1134/S0006297914130124.
- Gershon AA, Breuer J, Cohen JI, Cohrs RJ, Gershon MD, Gilden D, Grose C, Hambleton S, Kennedy PG, Oxman MN, Seward JF, Yamanishi K (2 de julio de 2015). «Varicella zoster virus infection». Nat Rev Dis Primers 1: 15016. PMC 5381807. PMID 27188665. doi:10.1038/nrdp.2015.16. Consultado el 9 de agosto de 2020.
- O'Leary JJ, Kennedy MM, McGee JO (February 1997). «Kaposi's sarcoma associated herpes virus (KSHV/HHV 8): epidemiology, molecular biology and tissue distribution». Mol Pathol 50 (1): 4-8. PMC 379571. PMID 9208806. doi:10.1136/mp.50.1.4.
- Eugene V. Koonin, Mart Krupovic, and Vadim I. Agol, 2021. The Baltimore Classification of Viruses 50 Years Later: How Does It Stand in the Light of Virus Evolution? Archivado el 26 de julio de 2021 en Wayback Machine.. American Society of Microbiogy.
- Andrade-Martínez JS, Moreno-Gallego JL, Reyes A (August 2019). «Defining a Core Genome for the Herpesvirales and Exploring their Evolutionary Relationship with the Caudovirales». Sci Rep 9 (1): 11342. Bibcode:2019NatSR...911342A. PMC 6683198. PMID 31383901. doi:10.1038/s41598-019-47742-z. Consultado el 19 de mayo de 2020.
- Eugene Koonin, Valerian V Doljja (2014). Virus World as an Evolutionary Network of Viruses and Capsidless Selfish Elements. Microbiology and Molecular Biology Reviews.