Intoxicación por paracetamol
La intoxicación por Paracetamol es causada por el uso excesivo o sobredosis de la droga analgésica Paracetamol. Originando principalmente lesiones hepáticas, la intoxicación por paracetamol es una de las causas más comunes de envenenamiento a nivel mundial. En los Estados Unidos y en el Reino Unido es la causa más común de fallo hepático agudo.[1][2]
Es posible que los individuos que se vean afectados por la intoxicación por Paracetamol no tengan síntoma alguno en las primeras 24 horas post sobredosis. Otros individuos pueden tener malestares no específicos, tales como dolor abdominal y náusea. Conforme la enfermedad avanza, se pueden desarrollar síntomas de fallo hepático, tales como: baja azúcar sanguínea, bajo pH sanguíneo, propensión a hemorragias y encelopatía hepática. Algunos de los casos de intoxicación por Paracetamol desaparecerán por sí mismos, sin embargo, existe la probabilidad de que los casos sin tratar culminen en la muerte del individuo afectado.
El daño hepático, o hepatotoxicidad, no es consecuencia del consumo del Paracetamol en sí, sino la consecuencia de la producción del metabolito N-acetil-p-benzoquinoneimina (NAPQI), el cual agota la reserva del antioxidante hepático glutatión, lo cual daña las células hepáticas, pudiendo causar así fallo hepático.[3] Los factores de riesgo para la toxicidad son los siguientes: ingesta excesiva y crónica de alcohol, ayuno, anorexia nerviosa y el uso de fármacos tales como isoniazida.
El objetivo principal del tratamiento es la eliminación del Paracetamol en el cuerpo y el reemplazo del glutatión agotado. El carbón activado puede ser utilizado para aminorar la absorción del Paracetamol, si el paciente se presenta para la aplicación del tratamiento apenas se ha llevado a cabo la sobredosis; el antídoto acetilcisteína actúa como un precursor del glutatión, ayudando así al cuerpo a regenerar el mismo de manera suficiente como para prevenir daño hepático.[3] N-acetilcisteína también puede neutralizar el NAPQI por sí misma. En caso de haber daño hepático severo se requiere un trasplante de hígado.[3] Los pacientes que reciben tratamiento en una etapa temprana tienen una buena probabilidad de recuperarse, mientras que los pacientes que han desarrollado anormalidades en el funcionamiento hepático, tienden a tener un mal desenlace. Los esfuerzos para la prevención de la sobredosis por Paracetamol incluyen la limitación en cuanto a la venta del fármaco y la combinación del mismo con metionina, la cual se convierte en glutatión en el hígado.
Síntomas y señales de la enfermedad
Los síntomas de la intoxicación por paracetamol ocurren en tres fases. La primera fase comienza horas después de la sobredosis y consiste en los siguientes síntomas: náusea, vómito, sudoración y palidez.[4] Los pacientes afectados no tienden a desarrollar dichos síntomas sino hasta después de unas 24 horas post envenenamiento. En casos poco convencionales, tras sobredosis masivas, los pacientes pueden desarrollar síntomas relacionados con acidosis metabólica y coma durante las primeras horas del envenenamiento.[5][6]
La segunda fase ocurre entre las 24 y 72 horas posteriores a la sobredosis y consiste principalmente en síntomas relacionados con un incremento del daño hepático. En general, el daño se lleva a cabo en los hepatocitos mientras se metaboliza el paracetamol. El paciente puede experimentar dolor en el cuadrante derecho superior. El daño hepático creciente tiende a alterar los marcadores bioquímicos del funcionamiento hepático tales como: INR y aumento de los niveles de las transaminasas hepáticas ALT y AST.[7] Durante esta fase el paciente puede experimentar fallo hepático agudo causado por síndrome hepatorenal o bien síndrome de disfunción de órganos múltiples. En algunos casos, el fallo hepático agudo tiende a ser la principal manifestación clínica de la intoxicación; en esos casos se ha asumido que el metabolismo tóxico NAPQI se produce en mayor cantidad en los riñones que en el hígado.[8]
La tercera fase de la intoxicación se presenta entre el tercer y el quinto día post sobredosis y es caracterizado por necrosis hepática masiva, la cual desencadena fallo hepático con complicaciones tales como: defectos de coagulación, hipoglicemia, fallo renal, encefalopatía hepática, edema cerebral, sepsis, fallo múltiple de órganos y la muerte.[4] Si el paciente sobrevive a la tercera fase, la necrosis hepática sigue su curso y la funcionalidad tanto hepática como renal vuelve a la normalidad en cuestión de algunas semanas. La severidad de la intoxicación por paracetamol depende de la dosis y de si el paciente recibe un tratamiento adecuado.[9]
Causa
La dosis tóxica de paracetamol es altamente variable, por lo general la dosis máxima para un adulto saludable es de 3 gramos, al ser administrado el fármaco en dosis mayores se corre el riesgo de intoxicación. En un adulto, dosis únicas sobre los 10 gramos o bien 200 mg/kg de masa corporal, tienden a tener un alto grado de probabilidad de causar intoxicación; también puede ocurrir cuando el consumo de múltiples dosis pequeñas, rebasan los niveles máximos permitidos por día. Al consumir un dosis de 1 gramo de paracetamol cuatro veces al día durante un periodo de dos semanas, los pacientes pueden esperar un incremento en los niveles hepáticos de alanina transaminasas de aproximadamente tres veces el nivel convencional; sin embargo es poco probable que este régimen de consumo cause fallo hepático.[10][11] Estudios han demostrado que la presencia de niveles de citotoxicidad significativos en pacientes que han consumido dosis superiores a las convencionales por periodos de 3 a 4 días,[12] es un hecho poco común.[11] La sobredosis aguda de paracetamol en los infantes rara vez causa enfermedad o la muerte y es extremadamente poco común el que estos lleguen a niveles en los cuales requieran tratamiento, siendo la mayor causa de intoxicación en los niños la ingesta crónica de dosis mayores a la convencional.[13] Las dosis intravenosas tienen que ser menores a las que se administran vía oral, fuera de ello todo lo demás debe ser igual.[14] En individuos poco convencionales la intoxicación por paracetamol puede verse ocasionada por el uso convencional del fármaco, esto puede ser debido a diferencias idiosincrásicas en la expresión y actividad de ciertas enzimas en una de las distintas vías metabólicas que se relacionan con el fármaco.[15]
Factores de riesgo
Un número de factores pueden incrementar potencialmente el riesgo de la intoxicación por paracetamol[16]. El consumo crónico y excesivo del alcohol puede inducir CYP2E1, lo cual incrementa la toxicidad potencial del paracetamol.[17] En un estudio conducido en pacientes con daño hepático, el 64% reportó ingesta de alcohol en cantidades superiores a los 80 gramos diarios, mientras que el 35% reportó una ingesta de 60 gramos diarios o menos.[18][19] El que el alcohol deba de ser considerado como un factor de riesgo es un asunto de debate por parte de algunos toxicólogos clínicos. Para los consumidores crónicos del alcohol, la ingesta aguda de alcohol al momento de la sobredosis puede tener un efecto protector, mientras que para los consumidores no crónicos, no lo tiene.[18][20]
El ayuno es un factor de riesgo, posiblemente debido al agotamiento de las reservas hepáticas de glutatión.[11] El uso concomitante del inhibidor de CYP2E1, isoniazida, incrementa el riesgo de hepatotoxicidad, a pesar de que se desconoce si la inducción de 2E1 se relaciona a la hepatotoxicidad en este caso.[21][22] El uso concomitante de otros fármacos que inducen enzimas CYP, tales como carbamazepina, fenitoína y barbitúricos, se han reportado como factores de riesgo.[23]
Fisiopatología
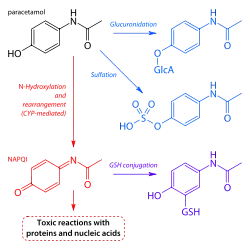
Cuando se ingiere en dosis terapéuticas normales, el paracetamol ha demostrado ser seguro, dado que al seguir las indicaciones sobre dosificación terapéutica, el fármaco se convierte mayoritariamente en metabolitos no tóxicos a través del metabolismo de fase II mediante la conjugación con sulfato y glucorónido, siendo una pequeña porción oxidada a través del sistema enzimático p450.[7] Los citocromos p450 2E1 y 3A4 convierten aproximadamente 5% del paracetamol a un metabolismo intermediario altamente reactivo, conocido como N-acetil-p-benzoquinonaimina (NAPQI).[3][7][24][25][26] Bajo condiciones convencionales, el NAPQI se descodifica mediante la conjugación con glutatión para así formar cisteína y conjugados de ácido mercaptúrico.[3][27]
En caso de haber una sobredosis de paracetamol, las vías de sulfato y glucorónido se saturan y más paracetamol se desvía al sistema de citocromo p450 para producir NAPQI.[3][28] Como resultado de lo anterior, las reservas hepatocelulares de glutatión se agotan debido al incremento en la demanda del mismo; NAPQI por ende permanece en su forma tóxica dentro del hígado y reacciona con moléculas de la membrana celular, lo cual provoca daño y muerte hepatocítica, desencadenando a la larga en necrosis hepática aguda.[27] En estudios animales, el glutatión hepático debe de estar por debajo del 70% del nivel normal para que pueda ocurrir la hepatotoxicidad.[24]
Diagnóstico
El historial de una persona que ha consumido paracetamol es un instrumento preciso para el diagnóstico,[29] sin embargo la manera más efectiva para diagnosticar el envenenamiento, es obtener el nivel de paracetamol en la sangre. Un nomograma de fármacos desarrollado en 1975, llamado el nomograma Rumack-Matthew, estima el riesgo de toxicidad con respecto a la concentración sérica del paracetamol en un periodo determinado de tiempo post consumo.[4] Para determinar el riesgo de hepatotoxicidad, el nivel de paracetamol se rastrea con ayuda del nomograma mediante el uso del gráfico de niveles de paracetamol sérico con respecto al tiempo y esto es aparentemente el mejor indicador de daño hepático potencial. Si se obtiene el nivel de paracetamol durante las primeras 4 horas post ingesta, se corre el riesgo de subestimar la cantidad sistémica del fármaco, puesto que el paracetamol puede no haber sido absorbido por completo por el tracto gastrointestinal, por lo cual no es una acción recomendable.[10]
Evidencia clínica o bioquímica de la hepatotoxicidad puede manifestarse en un periodo de tiempo de uno a cuatro días, o en casos severos puede hacerlo en 12 horas.[30] Flacidez en el cuadrante derecho superior puede ocurrir y tiende a ayudar a realizar el diagnóstico.[30] Los estudios de laboratorio pueden mostrar la presencia de necrosis hepática a través de niveles elevados de AST, ALN, bilirrubina y tiempos de coagulación prolongados, en particular un tiempo de protrombina elevado.[31] Tras la sobredosis de paracetamol, cuando los niveles de AST y ALT superan los 1000 IU/L, se puede diagnosticar hepatotoxicidad inducida por paracetamol. En algunos casos, los niveles de AST y ALT pueden superar los 10,000 IU/L.[32]
Prevención
Combinación con otros agentes
Una estrategia que se ha implementado para reducir el daño por sobredosis de paracetamol es el venderlo pre-combinado en tabletas con un emético[33] o bien un antídoto.
La tableta Paradote que se vendía en el Reino Unido combinaba 500mg de paracetamol con 100mg de metionina,[34] un aminoácido utilizado en el tratamiento de sobredosis de paracetamol.[11]
Hasta el momento no ha habido estudios sobre la efectividad del paracetamol cuando se administra en conjunto con su antídoto de mayor uso, acetilcisteína.[35]
Calcitriol, el metabolito activo de la vitamina D3, aparenta ser un catalizador de la síntesis de glutatión[36] debido a que se ha demostrado que incrementa los niveles de glutatión en cultivos primarios de astrocitos de ratas, en un 42% lo cual significa un incremento en las concentraciones de glutatión de 29nmol/mg a 41 nmol/mg. En un periodo de tiempo de 24 a 48 horas post administración, el calcitriol demostró seguir teniendo una influencia en los niveles de glutatión, inclusive hasta 96 horas post administración.[37] Se ha propuesto que la administración de calcitriol inyectado puede mejorar los resultados del tratamiento.
Limitación de la disponibilidad
La limitación de la disponibilidad de las tabletas de paracetamol ha sido una estrategia que se ha intentado implementar en algunos países. En el Reino Unido, las ventas de aparador de paracetamol han sido limitadas a cajas de tabletas de 32 x 500 mg en farmacias y cajas de tabletas de 16 x 500 mg en comercios que no son farmacias. Los boticarios pueden proveer hasta con 100 tabletas a aquellos pacientes con condiciones crónicas, bajo su propia discreción.[38][39] En Irlanda, los límites son 24 y 12 tabletas, respectivamente.[40] Estudios subsecuentes sugieren que estas intervenciones han tenido un efecto significativo en la reducción de las muertes por intoxicación causada por sobredosis de paracetamol.[41]
Un método sugerido para la prevención es el hacer que el paracetamol sea un medicamento de consumo controlado, lo que significa que sólo se puede obtener mediante el uso de prescripciones o bien el retirarlo del mercado.[33] Cabe mencionar que las sobredosis representan un problema minoritario, por ejemplo un 0,08% de la población en el Reino Unido (alrededor de 50.000 personas) sufre de sobredosis de paracetamol anualmente. Hay que tener en mente que el paracetamol es un fármaco seguro y efectivo, tomado por millones de pacientes sin complicación alguna, sin mencionar que medicamentos alternativos para el tratamiento de dolores, tienden a ser más tóxicos cuando se llega a presentar una sobredosis, como por ejemplo la aspirina, o bien tienden a ser asociados con efectos adversos tras su uso, como es el caso de los fármacos antinflamatorios no esteroides.[42]
Reemplazos del paracetamol
Un precursor biosintético del glutatión, el paracetamol éster profármaco con ácido L-piroglutámico (PCA), ha sido sintetizado para reducir la hepatotoxicidad del paracetamol y mejorar la biodisponibilidad. Los estudios toxicológicos de distintos ésteres de paracetamol demuestran que el L-5-oxo-pirrolidina-2-paracetamol carboxilato reduce la toxicidad tras la aplicación de una sobredosis de paracetamol en ratones. El grupo de ratones que fue tratado con la dosis equivalente de paracetamol demostró un decremento significativo de glutatión del 35%. El LD50 oral demostró ser mayor a 2000 mg/kg, mientras que el LD50 intraperitoneal fue de 1900 mg/kg, estos resultados en conjunto con los datos de hidrólisis y biodisponibilidad demuestran que este éster es un candidato potencial de profármaco de paracetamol.[43]
Tratamiento
Descontaminación gástrica
En los adultos, el tratamiento inicial para la sobredosis de paracetamol es la descontaminación gastrointestinal. La absorción del paracetamol en el tracto gastrointestinal se lleva a cabo en dos horas bajo circunstancias normales, por lo cual la descontaminación es de gran utilidad si se realiza dentro de este periodo de tiempo. El lavado gástrico, mejor conocido como bombeo estomacal, puede ser una opción, si la cantidad ingerida representa un peligro potencial para la vida del paciente y tiene que ser realizada durante la primera hora post ingesta.[44] El carbón activado es una de las técnicas de descontaminación gastrointestinal más común ya que absorbe[45] el paracetamol, al reducir su absorción gastrointestinal; también el administrar carbón activado representa un riesgo menor de aspiración que el representado por el lavado gástrico.[46]
Parece que se obtiene más provecho de la aplicación del carbono activado, si ésta se lleva a cabo en un periodo de tiempo de 30 minutos a 2 horas post ingesta.[47][48] La administración de este método en un periodo tardío puede ser considerado en pacientes que tienen un vaciado gástrico retardado debido a drogas ingeridas en conjunto o siguiendo la ingesta de paracetamol de liberación sostenida o prolongada. El carbón activado también debería de ser administrado si las drogas co-consumidas garantizan descontaminación.[30] Hubo titubeo al administrar carbón activado en casos de sobredosis de paracetamol, dado que también podría absorber el antídoto oral acetilcisteína.[49] Estudios han demostrado que se absorbe 39% menos acetilcisteína si se administra en conjunto con el carbón activado.[50][51] Existen recomendaciones contradictorias en cuanto a la administración del carbón activado y si la dosis de acetilcisteína debe de ser modificada tras ello.
El inducir el vómito mediante el uso de jarabe de ipecac no tiene papel alguno en la sobredosis de paracetamol porque el vómito que induce retrasa la administración efectiva de del carbón activado y acetilcisteína oral.[10] El daño hepático es extremadamente raro tras ingestión aguda accidental en niños menores de 6 años de edad.[11]
Acetilcisteína
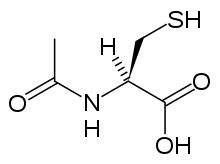
La acetilcisteína, también conocida como N-acetilcisteína o NAC, reduce la toxicidad del paracetamol al surtir los depósitos corporales del antioxidante glutatión, el cual reacciona con el metabolismo tóxico NAPQI para evitar que éste dañe las células y pueda ser excretado de manera segura.[52] El NAC tendía a ser administrado tras un nomograma de tratamiento, pero el uso del nomograma como evidencia ya no es recomendado, debido a que el uso de los factores de riesgo como base de esta metodología representaba imprecisiones y dificultades para la detección en la práctica clínica.[53] A pesar de que hay estudios que demuestran que los efectos adversos del uso de la metionina y cisteamina son mayores que los de la acetilcisteína, se les ha utilizado con el mismo propósito.[54]
Se ha demostrado que la acetilcisteína es un antídoto altamente efectivo en pacientes que reciben el tratamiento 8 horas post ingesta. Si el paciente presenta menos horas post ingesta, entonces el antídoto reduce significativamente el riesgo de hepatotoxicidad seria y asegura su supervivencia.[55] Es necesario mencionar que, a pesar de ser un antídoto efectivo 8 horas post ingesta, hay una disminución significativa en cuanto a su efectividad, debido a que la cascada de eventos tóxicos hepáticos ya comenzó y el riesgo de necrosis hepática aguda y muerte incrementan de manera dramática.[11] En la práctica clínica, si el paciente se presenta pasadas las 8 horas post sobredosis de paracetamol, el uso de carbón activado no es útil y se debe de comenzar con el tratamiento de aceticisteína.
En Estados Unidos, se consideran igualmente efectivas las vías de administración oral e intravenosa, sin embargo la vía intravenosa es la única vía recomendada en la práctica británica y australoasiática.[56][57] La acetilcisteína se aplica en una dosis de 140 mg/kg seguida por dosis de 70mg/kg cada 4 horas hasta completar las 17 dosis. Si el paciente vomita dentro de la primera hora después de haber tomado una dosis, ésta se tiene que repetir.[58][59] La acetilcisteína tiende a ser rechazada en la forma de aplicación oral, debido principalmente a su sabor y olor desagradable, los cuales pueden inducir náusea y vómito.[56]
La acetilcisteína intravenosa se aplica como una infusión continua por un periodo de 20 horas hasta que se alcanza una dosis total de 300mg/kg, teniendo como principal ventaja el reducir los tiempos de estadía en los hospitales y el permitir la administración de carbón activado para reducir la absorción del paracetamol.[60] Las dosis intravenosas varían principalmente debido al peso del paciente: para pacientes que pesan menos de 20 kg la dosis inicial es de 150mg/kg en diluyente de 3mL/kg administrada por un periodo de una hora, la segunda dosis es de 50 mg/kg en diluyente de 7ml/kg durante cuatro horas y la tercera y última dosis es de 100mg/kg en 14 mL/kg de diluyente durante 16 horas.[59]
El efecto adverso más común del tratamiento con aceticisteína son las reacciones anafilactoides, las cuales se manifiestan por lo general en forma de salpullido, hipotensión y falta de aliento.[61] Las reacciones adversas tienden a ser más comunes en los pacientes que reciben tratamiento intravenoso, con una incidencia del 4% al 23% de los pacientes. En ocasiones particulares, estos efectos adversos pueden llegar a representar una amenaza para la vida del paciente, sobre todo en pacientes con asma.[62][63]
Trasplante de hígado
En pacientes que han desarrollado fallo hepático fulminante o en los que se espera que fallezcan por fallo hepático, el tratamiento principal es el trasplante de hígado, el cual tiene que ser realizado en un centro especializado.[33] El criterio que se usa comúnmente para el trasplante de hígado se desarrolló en el hospital del King’s College en Londres y dicta que los pacientes deberían de someterse a un trasplante si el pH sanguíneo arterial es menor a 7.3 tras la resucitación de fluidos o si el paciente tiene encefalopatía de grado 3 o 4, un tiempo de protrombina superior a los 100 segundos y niveles de creatinina es superiores a 300mmol/L en un periodo de 24 horas.[64] Otra medida sería el trasplante parciales de hígado, teniendo la ventaja de ayudar al paciente a regenerar su propio hígado. Una vez que se recupera la función hepática, se comienza el uso de drogas inmunosupresoras, el cual tiene que mantenerse por el resto de la vida del paciente.[65][66]
Pronóstico
La tasa de mortalidad de la intoxicación por paracetamol incrementa dos días post ingestión y alcanza su punto máximo en el cuarto día (96 horas después), posteriormente decrementa. La acidemia es el factor de mortalidad más importante y puede indicar la necesidad de un trasplante. Se ha reportado una tasa de mortalidad del 95% en pacientes que no reciben un trasplante y tienen un pH sanguíneo menor a 7.3. Otros indicadores de un mal pronóstico para el paciente son: insuficiencia renal, encefalopatía hepática, incremento en el tiempo de protrombina y un nivel elevado de ácido láctico en la sangre.[64][67] Los pacientes que tienen un mal pronóstico tienden a ser los mismos a los cuales se les recomienda un trasplante de hígado.[68] Los pacientes que no mueren, tienden a recuperarse por completo y a tener una calidad de vida convencional.[69]
Epidemiología
El paracetamol se encuentra en muchos compuestos, disponibles en venta de anaquel y también como medicamentos de prescripción, debido a su disponibilidad amplia y su toxicidad relativamente alta, hay un potencial alto de sobredosis.[70] El carácter tóxico del paracetamol es una de las mayores causas de envenenamiento a nivel mundial, también es la causa más común de sobredosis en los Estados unidos, Reino unido, Australia y Nueva Zelanda. Cabe mencionar que en el Reino Unido y Estados Unidos es una de las causas más comunes de fallo hepático agudo.[1][2]
En Gales e Inglaterra, se estiman aproximadamente 41.200 casos de envenenamiento por paracetamol entre 1989 y 1990, con una tasa de mortalidad del 40%. Se calcula que se producen alrededor de 150 a 200 muertes y de 15 a 20 trasplantes de hígado como resultado del envenenamiento en estas mismas regiones del Reino Unido.[61] El envenenamiento por paracetamol es la causa más común de las llamadas a los centros de control de venenos en Estados Unidos, sin mencionar las visitas a salas de emergencia, hospitalizaciones y muertes por fallo hepático agudo en este país.[71] Un estudio realizado por el CDC sobre el fallo hepático agudo, reveló que en los Estados Unidos el paracetamol es la causa del mismo en el 41% de todos los casos en adultos y del 25% de todos los casos en niños.[72]
Referencias
- Larson AM, Polson J, Fontana RJ, Davern TJ, Lalani E, Hynan LS, Reisch JS, Schiødt FV, Ostapowicz G, Shakil AO, Lee WM; Acute Liver Failure Study Group. (December 2005). «Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study». Hepatology (Baltimore, Md.) 42 (6): 1364-72. PMID 16317692. doi:10.1002/hep.20948.
- Ryder SD, Beckingham IJ (February 2001). «Other causes of parenchymal liver disease». BMJ (Clinical research ed.) 322 (7281): 290-2. PMC 1119531. PMID 11157536. doi:10.1136/bmj.322.7281.290.
- Metabolism of acetaminophen (paracetamol), acetanilide and phenacetin
- Rumack B, Matthew H (1975). «Acetaminophen poisoning and toxicity». Pediatrics 55 (6): 871-76. PMID 1134886.
- Zezulka A, Wright N (September 1982). «Severe metabolic acidosis early in paracetamol poisoning». British medical journal (Clinical research ed.) 285 (6345): 851-2. PMC 1499688. PMID 6811039. doi:10.1136/bmj.285.6345.851.
- Roth B, Woo O, Blanc P (April 1999). «Early metabolic acidosis and coma after acetaminophen ingestion». Annals of Emergency Medicine 33 (4): 452-6. PMID 10092726. doi:10.1016/S0196-0644(99)70312-4.
- Heard KJ (July 2008). «Acetylcysteine for Acetaminophen Poisoning». The New England Journal of Medicine 359 (3): 285-92. PMC 2637612. PMID 18635433. doi:10.1056/NEJMct0708278.
- Boutis K, Shannon M (2001). «Nephrotoxicity after acute severe acetaminophen poisoning in adolescents». Journal of toxicology. Clinical toxicology 39 (5): 441-5. PMID 11545233. doi:10.1081/CLT-100105413.
- Linden CH, Rumack BH (February 1984). «Acetaminophen overdose». Emergency medicine clinics of North America 2 (1): 103-19. PMID 6394298.
- Dart RC, Erdman AR, Olson KR, Christianson G, Manoguerra AS, Chyka PA, Caravati EM, Wax PM, Keyes DC, Woolf AD, Scharman EJ, Booze LL, Troutman WG; American Association of Poison Control Centers (2006). «Acetaminophen poisoning: an evidence-based consensus guideline for out-of-hospital management». Clinical toxicology (Philadelphia, Pa.) 44 (1): 1-18. PMID 16496488. doi:10.1080/15563650500394571.
- Daly FF, Fountain JS, Murray L, Graudins A, Buckley NA (March 2008). «Guidelines for the management of paracetamol poisoning in Australia and New Zealand—explanation and elaboration. A consensus statement from clinical toxicologists consulting to the Australasian poisons information centres». The Medical journal of Australia 188 (5): 296-301. PMID 18312195.
- Daly FF, O'Malley GF, Heard K, Bogdan GM, Dart RC (October 2004). «Prospective evaluation of repeated supratherapeutic acetaminophen (paracetamol) ingestion». Annals of Emergency Medicine 44 (4): 393-8. PMID 15459622. doi:10.1016/j.annemergmed.2004.05.005.
- Dart RC, Bailey E (2007). «Does therapeutic use of acetaminophen cause acute liver failure?». Pharmacotherapy 27 (9): 1219-30. PMID 17723075. doi:10.1592/phco.27.9.1219.
- Vuppalanchi R, Liangpunsakul S, Chalasani N (March 2007). «Etiology of new-onset jaundice: how often is it caused by idiosyncratic drug-induced liver injury in the United States?». Am. J. Gastroenterol. 102 (3): 558-62; quiz 693. PMID 17156142. doi:10.1111/j.1572-0241.2006.01019.x.
- «Father claims overdose medics 'killed his daughter'». BBC News. 4 de febrero de 2011.
- C, Dr (6 de febrero de 2020). «Is It Dangerous to Use Paracetamol and Alcohol?». Meds News – Health And Medicine Information (en inglés). Consultado el 28 de septiembre de 2023.
- Zimmerman HJ, Maddrey WC (1995). «Acetaminophen (paracetamol) hepatotoxicity with regular intake of alcohol: analysis of instances of therapeutic misadventure». Hepatology 22 (3): 767-73. PMID 7657281. doi:10.1002/hep.1840220312.
- Dargan PI, Jones AL (2002). «Should a lower treatment line be used when treating paracetamol poisoning in patients with chronic alcoholism?: a case against». Drug safety : an international journal of medical toxicology and drug experience 25 (9): 625-32. PMID 12137557. doi:10.2165/00002018-200225090-00002.
- Buckley NA, Srinivasan J (2002). «Should a lower treatment line be used when treating paracetamol poisoning in patients with chronic alcoholism?: a case for». Drug safety : an international journal of medical toxicology and drug experience 25 (9): 619-24. PMID 12137556. doi:10.2165/00002018-200225090-00001.
- Schmidt LE, Dalhoff K, Poulsen HE (April 2002). «Acute versus chronic alcohol consumption in acetaminophen-induced hepatotoxicity». Hepatology 35 (4): 876-82. PMID 11915034. doi:10.1053/jhep.2002.32148.
- Crippin JS (April 1993). «Acetaminophen hepatotoxicity: potentiation by isoniazid». The American journal of gastroenterology 88 (4): 590-2. PMID 8470644.
- Nolan CM, Sandblom RE, Thummel KE, Slattery JT, Nelson SD (1994). «Hepatotoxicity associated with acetaminophen usage in patients receiving multiple drug therapy for tuberculosis». Chest 105 (2): 408-11. PMID 7508362. doi:10.1378/chest.105.2.408.
- Bray GP, Harrison PM, O'Grady JG, Tredger JM, Williams R (July 1992). «Long-term anticonvulsant therapy worsens outcome in paracetamol-induced fulminant hepatic failure». Human & Experimental Toxicology 11 (4): 265-70. PMID 1354974. doi:10.1177/096032719201100405.
- Richardson, JA (July–September 2000). «Management of acetaminophen and ibuprofen toxicoses in dogs and cats». Journal of Veterinary Emergency and Critical Care 10 (4): 285-291. doi:10.1111/j.1476-4431.2000.tb00013.x. Archivado desde el original el 22 de noviembre de 2008.
- Rumbeiha WK, Lin YS, Oehme FW (November 1995). «Comparison of N-acetylcysteine and methylene blue, alone or in combination, for treatment of acetaminophen toxicosis in cats». American journal of veterinary research 56 (11): 1529-33. PMID 8585668.
- Mitchell JR, Jollow DJ, Potter WZ, Gillette JR, Brodie BB (October 1973). «Acetaminophen-induced hepatic necrosis. IV. Protective role of glutathione». The Journal of Pharmacology and Experimental Therapeutics 187 (1): 211-7. PMID 4746329. Archivado desde el original el 28 de agosto de 2021. Consultado el 15 de abril de 2016.
- Dai Y, Cederbaum AI (June 1995). «Cytotoxicity of acetaminophen in human cytochrome P4502E1-transfected HepG2 cells». The Journal of Pharmacology and Experimental Therapeutics 273 (3): 1497-505. PMID 7791125. Archivado desde el original el 28 de agosto de 2021. Consultado el 15 de abril de 2016.
- Camilleri, R (June 2015). «A meta-analysis of the reliability of the history in suspected poisoning.». The Journal of emergency medicine 48 (6): 679-84. PMID 25827782. doi:10.1016/j.jemermed.2014.12.067.
- Farrell, Susan E (3 de octubre de 2007). «Toxicity, Acetaminophen». emedicine. Consultado el 9 de noviembre de 2008.
- Bartlett D (June 2004). «Acetaminophen toxicity». Journal of emergency nursing: JEN : official publication of the Emergency Department Nurses Association 30 (3): 281-3. PMID 15192687. doi:10.1016/j.jen.2004.01.023.
- Jones AL (March 2000). «Recent advances in the management of late paracetamol poisoning». Emergency medicine Australasia 12 (1): 14-21. doi:10.1046/j.1442-2026.2000.00088.x.
- Dargan PI, Jones AL (April 2003). «Management of paracetamol poisoning». Trends in pharmacological sciences 24 (4): 154-7. PMID 12706999. doi:10.1016/S0165-6147(03)00053-1.
- Heptonstall JP (April 2006). «Time to make paracetamol with methionine available». BMJ (Clinical research ed.) 332 (7544): 795. PMC 1420701. PMID 16575097. doi:10.1136/bmj.332.7544.795-b.
- Chang, Matthew. «Acetaminophen in Combination With N-Acetylcysteine (NAC) Versus Placebo in Treating Fever». Consultado el 17 de noviembre de 2012.
- Garcion, E; Wion-Barbot, N; Montero-Menei, C; Berger, F; Wion, D (2002). «New clues about vitamin D functions in the nervous system». Trends in Endocrinology and Metabolism 13 (3): 100-5. PMID 11893522. doi:10.1016/S1043-2760(01)00547-1.
- Garcion, E.; Sindji, L.; Leblondel, G.; Brachet, P.; Darcy, F. (2002). «1,25-Dihydroxyvitamin D3 Regulates the Synthesis of γ-Glutamyl Transpeptidase and Glutathione Levels in Rat Primary Astrocytes». Journal of Neurochemistry 73 (2): 859-866. PMID 10428085. doi:10.1046/j.1471-4159.1999.0730859.x.,
- Hughes B, Durran A, Langford NJ, Mutimer D (August 2003). «Paracetamol poisoning—impact of pack size restrictions». Journal of clinical pharmacy and therapeutics 28 (4): 307-10. PMID 12911683. doi:10.1046/j.1365-2710.2003.00497.x. Archivado desde el original el 21 de julio de 2012. Consultado el 15 de abril de 2016.
- Sheen CL, Dillon JF, Bateman DN, Simpson KJ, Macdonald TM (September 2002). «Paracetamol toxicity: epidemiology, prevention and costs to the health-care system». QJM : monthly journal of the Association of Physicians 95 (9): 609-19. PMID 12205339. doi:10.1093/qjmed/95.9.609.
- Laffoy M, Scallan E, Byrne G (2001). «Paracetamol availability and overdose in Ireland». Irish medical journal 94 (7): 212-4. PMID 11693213.
- BMJ 2013;346:f403, http://www.bmj.com/content/346/bmj.f403
- Jones A (2002). «Over-the-counter analgesics: a toxicology perspective». Am J Ther 9 (3): 245-57. PMID 11941384. doi:10.1097/00045391-200205000-00010.
- Bousquet E, Marrazzo A, Puglisi G, Spadaro A (1996). «Synthesis, physical properties, toxicological studies and bioavailability of L-pyroglutamic and L-glutamic acid esters of paracetamol as potentially useful prodrugs». J Pharm Pharmacol 48 (5): 479-85. PMID 8799871. doi:10.1111/j.2042-7158.1996.tb05958.x.
- Vale JA, Kulig K; American Academy of Clinical Toxicology; European Association of Poisons Centres and Clinical Toxicologists (2004). «Position paper: gastric lavage». Journal of toxicology. Clinical toxicology 42 (7): 933-43. PMID 15641639. doi:10.1081/CLT-200045006.
- Spiller HA, Sawyer TS (August 2007). «Impact of activated charcoal after acute acetaminophen overdoses treated with N-acetylcysteine». The Journal of emergency medicine 33 (2): 141-4. PMID 17692765. doi:10.1016/j.jemermed.2007.02.016.
- Buckley NA, Whyte IM, O'Connell DL, Dawson AH (1999). «Activated charcoal reduces the need for N-acetylcysteine treatment after acetaminophen (paracetamol) overdose». Journal of toxicology. Clinical toxicology 37 (6): 753-7. PMID 10584587. doi:10.1081/CLT-100102452.
- Isbister G, Whyte I, Dawson A (2001). «Pediatric acetaminophen overdose». Journal of toxicology. Clinical toxicology 39 (2): 169-72. PMID 11407504. doi:10.1081/CLT-100103834.
- Buckley NA, Whyte IM, O'Connell DL, Dawson AH (1999). «Activated charcoal reduces the need for N-acetylcysteine treatment after acetaminophen (paracetamol) overdose». Journal of toxicology. Clinical toxicology 37 (6): 753-7. PMID 10584587. doi:10.1081/CLT-100102452.
- Renzi FP, Donovan JW, Martin TG, Morgan L, Harrison EF (June 1985). «Concomitant use of activated charcoal and N-acetylcysteine». Annals of Emergency Medicine 14 (6): 568-72. PMID 3994080. doi:10.1016/S0196-0644(85)80781-2.
- Ekins BR, Ford DC, Thompson MI, Bridges RR, Rollins DE, Jenkins RD (November 1987). «The effect of activated charcoal on N-acetylcysteine absorption in normal subjects». The American journal of emergency medicine 5 (6): 483-7. PMID 3663288. doi:10.1016/0735-6757(87)90166-5.
- Spiller HA, Krenzelok EP, Grande GA, Safir EF, Diamond JJ (March 1994). «A prospective evaluation of the effect of activated charcoal before oral N-acetylcysteine in acetaminophen overdose». Annals of Emergency Medicine 23 (3): 519-23. PMID 8135427. doi:10.1016/S0196-0644(94)70071-0.
- Piperno E, Berssenbruegge DA (October 1976). «Reversal of experimental paracetamol toxicosis with N-acetylcysteine». Lancet 2 (7988): 738-9. PMID 61415. doi:10.1016/S0140-6736(76)90030-1.
- «Paracetamol overdose: new guidance on treatment with intravenous acetylcysteine». Drug Safety Update (Medicines and Healthcare Products Regulatory Agency (MHRA)) 6 (2): A1. September 2012. Archivado desde el original el 27 de octubre de 2012.
- Alsalim W, Fadel M (July 2003). «Oral methionine compared with intravenous n-acetyl cysteine for paracetamol overdose». Emergency medicine journal : EMJ 20 (4): 366-7. PMC 1726135. PMID 12835357. doi:10.1136/emj.20.4.366.
- Keays R, Harrison P, Wendon J, Forbes A, Gove C, Alexander G, Williams R (1991). «Intravenous acetylcysteine in paracetamol induced fulminant hepatic failure: a prospective controlled trial». BMJ 303 (6809): 1026-9. PMC 1671790. PMID 1954453. doi:10.1136/bmj.303.6809.1026.
- Kanter MZ (October 2006). «Comparison of oral and i.v. acetylcysteine in the treatment of acetaminophen poisoning». American Journal of Health-System Pharmacy 63 (19): 1821-7. PMID 16990628. doi:10.2146/ajhp060050.
- Schwarz, E; Cohn, B (2014). «Is Intravenous Acetylcysteine More Effective Than Oral Administration for the Prevention of Hepatotoxicity in Acetaminophen Overdose?». Annals of Emergency Medicine 63 (1): 79-80. doi:10.1016/j.annemergmed.2013.07.002.
- Woo OF, Mueller PD, Olson KR, Anderson IB, Kim SY (April 2000). «Shorter duration of oral N-acetylcysteine therapy for acute acetaminophen overdose». Annals of Emergency Medicine 35 (4): 363-8. PMID 10736123. doi:10.1016/S0196-0644(00)70055-2.
- «Acetaminophen Overdose and NAC Dosing». MDCalc. Consultado el 10 de febrero de 2014.
- Buckley N, Whyte I, O'Connell D, Dawson A (1999). «Oral or intravenous N-acetylcysteine: which is the treatment of choice for acetaminophen (paracetamol) poisoning?». Journal of toxicology. Clinical toxicology 37 (6): 759-67. PMID 10584588. doi:10.1081/CLT-100102453.
- Buckley N, Eddleston M (December 2005). «Paracetamol (acetaminophen) poisoning». Clinical evidence (14): 1738-44. PMID 16620471.
- Prescott LF, Park J, Ballantyne A, Adriaenssens P, Proudfoot AT (August 1977). «Treatment of paracetamol (acetaminophen) poisoning with N-acetylcysteine». Lancet 2 (8035): 432-4. PMID 70646. doi:10.1016/S0140-6736(77)90612-2.
- Bailey B, McGuigan MA (June 1998). «Management of anaphylactoid reactions to intravenous N-acetylcysteine». Annals of Emergency Medicine 31 (6): 710-5. PMID 9624310. doi:10.1016/S0196-0644(98)70229-X.
- O'Grady JG, Alexander GJ, Hayllar KM, Williams R (August 1989). «Early indicators of prognosis in fulminant hepatic failure». Gastroenterology 97 (2): 439-45. PMID 2490426.
- Jaeck D, Boudjema K, Audet M, Chenard-Neu MP, Simeoni U, Meyer C, Nakano H, Wolf P (2002). «Auxiliary partial orthotopic liver transplantation (APOLT) in the treatment of acute liver failure». Journal of gastroenterology. 37 Suppl 13: 88-91. PMID 12109674. doi:10.1007/BF02990107.
- Lodge JP, Dasgupta D, Prasad KR, Attia M, Toogood GJ, Davies M, Millson C, Breslin N, Wyatt J, Robinson PJ, Bellamy MC, Snook N, Pollard SG (February 2008). «Emergency subtotal hepatectomy: a new concept for acetaminophen-induced acute liver failure: temporary hepatic support by auxiliary orthotopic liver transplantation enables long-term success». Annals of Surgery 247 (2): 238-49. PMID 18216528. doi:10.1097/SLA.0b013e31816401ec.
- Bernal W, Donaldson N, Wyncoll D, Wendon J (February 2002). «Blood lactate as an early predictor of outcome in paracetamol-induced acute liver failure: a cohort study». Lancet 359 (9306): 558-63. PMID 11867109. doi:10.1016/S0140-6736(02)07743-7.
- Pereira LM, Langley PG, Hayllar KM, Tredger JM, Williams R (1992). «Coagulation factor V and VIII/V ratio as predictors of outcome in paracetamol induced fulminant hepatic failure: relation to other prognostic indicators». Gut 33 (1): 98-102. PMC 1373872. PMID 1740285. doi:10.1136/gut.33.1.98.
- Ding GK, Buckley NA (September 2008). «Evidence and consequences of spectrum bias in studies of criteria for liver transplant in paracetamol hepatotoxicity». QJM : monthly journal of the Association of Physicians 101 (9): 723-9. PMID 18606611. doi:10.1093/qjmed/hcn077.
- Sheen C, Dillon J, Bateman D, Simpson K, Macdonald T (2002). «Paracetamol toxicity: epidemiology, prevention and costs to the health-care system». QJM : monthly journal of the Association of Physicians 95 (9): 609-19. PMID 12205339. doi:10.1093/qjmed/95.9.609.
- Lee WM (July 2004). «Acetaminophen and the U.S. Acute Liver Failure Study Group: lowering the risks of hepatic failure». Hepatology 40 (1): 6-9. PMID 15239078. doi:10.1002/hep.20293.
- Bower WA, Johns M, Margolis HS, Williams IT, Bell BP (November 2007). «Population-based surveillance for acute liver failure». The American journal of gastroenterology 102 (11): 2459-63. PMID 17608778. doi:10.1111/j.1572-0241.2007.01388.x.
Otras lecturas
- «Use Only as Directed». This American Life. Episodio 505. Public Radio International. WBEZ. 20 de septiembre de 2013. http://www.thisamericanlife.org/radio-archives/episode/505/use-only-as-directed. Consultado el 24 de septiembre de 2013.
- Gerth, Jeff; T. Christian Miller (20 de septiembre de 2013). «Use Only as Directed». ProPublica. Consultado el 12 de octubre de 2013.
- Miller, T. Christian; Jeff Gerth (20 de septiembre de 2013). «Dose of Confusion». ProPublica. Consultado el 12 de octubre de 2013.