Maraviroc
Maraviroc (nombre de la marca: Selzentry, o Celsentri, fuera de EE. UU. ) es un medicamento usado contra la infección del VIH.
| Maraviroc | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
|
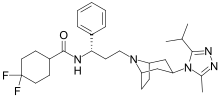
4,4-difluoro-N-{(1S)-3-[3-(3-isopropil- 5-metil-4H-1,2,4-triazol-4-yl)- 8-azabiciclo [3.2.1] oct-8-il]-1- fenilpropil} ciclohexanecarboxamida | ||
| Identificadores | ||
| Número CAS | Plantilla:Cascite&Units=SI Plantilla:Cascite | |
| Código ATC | J05AX09 | |
| PubChem | 3002977 | |
| ChemSpider | 2273675 | |
| UNII | MD6P741W8A | |
| Datos químicos | ||
| Fórmula | C29H41N5F2O | |
| Peso mol. | 513.666 g/mol | |
|
FC5(F)CCC(C(=O)N[C@H](c1ccccc1)CCN2[C@H]4CC[C@@H]2CC(n3c(nnc3C(C)C)C)C4)CC5
| ||
|
InChI=1S/C29H41F2N5O/c1-19(2)27-34-33-20(3)36(27)25-17-23-9-10-24(18-25)35(23)16-13-26(21-7-5-4-6-8-21)32-28(37)22-11-14-29(30,31)15-12-22/h4-8,19,22-26H,9-18H2,1-3H3,(H,32,37)/t23-,24+,25?,26-/m0/s1
Key: GSNHKUDZZFZSJB-HLMSNRGBSA-N | ||
| Farmacocinética | ||
| Biodisponibilidad | 23%[1] | |
| Metabolismo | Hígado | |
| Vida media | 16 h[2] | |
| Datos clínicos | ||
| Cat. embarazo | Los estudios en animales no han demostrado efectos adversos sobre el feto, pero no hay estudios clínicos adecuados y bien controlados hechos en embarazadas. Puede emplearse con vigilancia médica. (EUA) | |
| Estado legal | POM (UK) ℞-only (EUA) | |
| Vías de adm. | Oral | |
Mecanismo de acción
Maraviroc es un inhibidor de entrada. Concretamente, maraviroc bloquea el gp120 (lazo V3), el cual normalmente se asocia con la quimiocina receptora CCR5. El VIH es entonces incapaz de unirse a los macrófagos humanos.[3] Dado que el VIH puede utilizar otro co-receptor, el CXCR4, una prueba de tropismo de VIH, como el análisis "Trofile", debe de ser realizada para determinar si el medicamento será efectivo.[4]
Desarrollo y aprobación
Maraviroc, originalmente denominado como UK-427857, fue desarrollado por la compañía Pfizer en unos laboratorios del Reino Unido localizados en Sandwich (Kent). El 24 de abril de 2007, la NDA, grupo asesor de la FDA (Administración de Alimentos y Medicamentos), evaluó Maviroc y por unanimidad dieron el visto bueno del nuevo medicamento.[5] El 6 de agosto de 2007, el fármaco recibió total aprobación por parte de la FDA para el uso con pacientes tratados previamente.[6]
El 24 de septiembre de 2007, Pfizer anunció que la Comisión Europea había aprobado Maraviroc. Expertos en el sector pronosticaron una recaudación de $500 millones para el 2011.[7]
Eficacia
Dos ensayos clínicos aleatorios y controlados con placebo, conocidos como "MOTIVATE 1 & 2", compararon 209 pacientes recibiendo terapia optimizada más un placebo; con 426 pacientes que recibieron terapia optimizada, más 150 mg de maraviroc una vez al día; y 414 pacientes que recibieron terapia optimizada, más 150 mg de maraviroc dos veces al día. A las 48 semanas, el 55% de los participantes que recibieron maraviroc una vez al día y el 60% de los participantes que recibieron el medicamento dos veces al día, alcanzaron una carga viral inferior a 400 copias/mL, en comparación con el 26% de los que tomaron placebo. Alrededor del 44% de los que lo tomaron una vez al día y el 45% del grupo que lo tomaron dos veces al día, tenían una carga viral inferior a 50 copias/mL, en comparación con, aproximadamente, el 23% de los que recibieron placebo. Además, los que recibieron el inhibidor de entrada tuvieron un incremento, en término medio, de las células CD4, de 110 células/µL en el grupo de una vez al día, 106 células/µL en el grupo de dos veces al día, y 56 células/µL en el grupo placebo.[8][9][10]
Seguridad
Los ensayos MOTIVATE no mostraron diferencias clínicamente relevantes en materia de seguridad entre los grupos de maraviroc y el placebo. Sin embargo, los investigadores cuestionan la seguridad a largo plazo del bloqueo del CCR5, un receptor, cuya función en el individuo sano no está completamente entendida.[8]
Véase también
- Discovery and development of CCR5 receptor antagonists
Referencias
- Abel S, Russell D, Whitlock LA, Ridgway CE, Nedderman AN, Walker DK (abril de 2008). «Assessment of the absorption, metabolism and absolute bioavailability of maraviroc in healthy male subjects». British Journal of Clinical Pharmacology 65 (Suppl 1): 60-7. PMC 2311408. PMID 18333867. doi:10.1111/j.1365-2125.2008.03137.x.
- Abel S, Back DJ, Vourvahis M (2009). «Maraviroc: pharmacokinetics and drug interactions». Antiviral Therapy 14 (5): 607-18. PMID 19704163.
- Levy JA (enero de 2009). «HIV pathogenesis: 25 years of progress and persistent challenges». AIDS 23 (2): 147-60. PMID 19098484. doi:10.1097/QAD.0b013e3283217f9f.
- Biswas P, Tambussi G, Lazzarin A (mayo de 2007). «Access denied? The status of co-receptor inhibition to counter HIV entry». Expert Opinion on Pharmacotherapy 8 (7): 923-33. PMID 17472538. doi:10.1517/14656566.8.7.923.
- Gay News From 365Gay.com
- Krauskopf, Lewis (6 de agosto de 2007). «Pfizer wins U.S. approval for new HIV drug». Reuters. Consultado el 6 de agosto de 2007.
- Reuters, Europe gives final approval to Pfizer HIV drug
- Stephenson J (abril de 2007). «Researchers buoyed by novel HIV drugs: will expand drug arsenal against resistant virus». JAMA 297 (14): 1535-6. PMID 17426263. doi:10.1001/jama.297.14.1535.
- Emmelkamp JM, Rockstroh JK (octubre de 2007). «CCR5 antagonists: comparison of efficacy, side effects, pharmacokinetics and interactions--review of the literature». European Journal of Medical Research 12 (9): 409-17. PMID 17933722.
- «Maraviroc reduces viral load in naive patients at 48 weeks». AIDS Patient Care and STDs 21 (9): 703-4. septiembre de 2007. PMID 17941136.
Enlaces externos
- BBC News story: Drug 'stops HIV's entry to cells'
- Maraviroc data at aidsmap (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Maraviroc early access program
- New HIV Drug Recommended for Approval
- MeSH: maraviroc (en inglés)