Neisseria meningitidis
Neisseria meningitidis,[1] generalmente denominada meningococo, es una bacteria gramnegativa que puede causar meningitis y otras formas de enfermedad meningocócica, por ejemplo meningococemia, un tipo de sepsis potencialmente mortal. Esta bacteria se conoce como coco porque es redonda y más específicamente como diplococo porque tiende a formar pares. Alrededor del diez por ciento de los adultos son portadores de meningococos en la nasofaringe.[2][3][4] Como patógeno exclusivamente humano N. meningitidis es la principal causa de meningitis bacteriana en niños y adultos jóvenes y provoca deterioro del desarrollo y muerte en el diez por ciento de los casos. Los meningococos producen la única forma conocida de meningitis bacteriana epidémica, sobre todo en África y Asia. N. meningitidis, que se transmite por contacto directo a través de la saliva y las secreciones respiratorias emitidas en forma de gotitas por los pacientes infectados al toser, estornudar, besar y morder juguetes, para infectar las células se adhiere a ellas con sus filamentos largos y delgados llamados pili y con la intermediación de las proteínas expuestas en la membrana Opa y Opc,[5][nota 1] además de con sus diversos factores de virulencia.
| Neisseria meningitidis | ||
|---|---|---|
 Micrografía de N. meningitidis. | ||
| Taxonomía | ||
| Dominio: | Bacteria | |
| Filo: | Proteobacteria | |
| Clase: | Betaproteobacteria | |
| Orden: | Neisseriales | |
| Familia: | Neisseriaceae | |
| Género: | Neisseria | |
| Especie: |
N. meningitidis Albrecht & Ghon 1901 | |
Clasificación
Las neiserias son cocos gramnegativos aerobios que suelen disponerse por pares y en forma de granos de café. Son microorganismos oxidasa-positivos. Desde el punto de vista de su patogenicidad las especies de esta bacteria se pueden clasificar en patógenas —Neisseria meningitidis y Neisseria gonorrhoeae— y no patógenas —Neisseria sicca, Neisseria mucosa, Neisseria lactamica, etc.— Las especies de Neisseria no patógenas forman parte de la flora habitual de las vías respiratorias y en algunas ocasiones se comportan como patógenos.[11]
Como son diplococos que no crecen en medios comunes, sobre la base de las características de su desarrollo los meningococos también pueden clasificarse como microorganismos delicados con necesidades nutritivas particulares.[12] Se los cultiva en medios muy enriquecidos porque su capacidad metabólica no es muy completa y en consecuencia requieren nutrientes especiales.[12] Los medios de cultivo indicados para el desarrollo satisfactorio de N. meningitidis son el medio de Thayer-Martin, agar chocolate o agar sangre, todos enriquecidos con vitaminas, minerales y moléculas energéticas. En síntesis, se los debe clasificar como bacterias exigentes.[12]
Los meningococos también se clasifican con métodos serológicos basados en la estructura de la cápsula polisacárida.[4] Se han descrito trece cápsulas distintas desde los puntos de vista químico y antigénico. Algunas cepas, a menudo las que causan portación nasofaríngea asintomática, no son agrupables y carecen de cápsula.[4] Casi todos los casos de enfermedad invasiva son causados por uno de cinco serogrupos: A, B, C, W e Y. La importancia relativa de cada serogrupo depende de la ubicación geográfica y de otros factores, entre ellos la edad.[4] Por ejemplo, históricamente el serogrupo A ha sido una causa importante de enfermedad en África subsahariana pero su aislamiento es raro en los Estados Unidos.[4] Otra forma de clasificación de los meningococos se basa en ciertas proteínas de la membrana externa. La subtipificación molecular mediante técnicas de laboratorio especializadas (p. ej., electroforesis en gel de campo pulsado)[13] puede proporcionar información epidemiológica útil.[4]
En cuanto a la morfología celular la de N. meningitidis es idéntica a la de N. gonorrhoeae. La única característica estructural que diferencia a estas dos especies es la presencia de una cápsula polisacárida en la primera. Según su estructura y sus tipos antigénicos N. meningitidis se clasifica, sobre la base de sus polisacáridos capsulares, en doce serogroupos, algunos de los cuales se subdividen de acuerdo con la presencia de proteínas de la membrana externa y antígenos lipopolisacáridos.[14]
Los polisacáridos capsulares de los meningococos sirven de base para el agrupamiento de estos microorganismos. Se han identificado doce serogrupos (A, B, C, H, I, K, L, X, Y, Z, 29E y W135). Los serogrupos asociados con enfermedad humana más importantes son A, B, C, Y y W135. Las proteínas de adherencia e invasión de clase 5 Opa y Opc[15] comparten una homología del veintidós por ciento. Las Opa (del inglés colony opacity-associated proteins o proteínas asociadas con la opacidad de la colonia) son adhesinas con un papel fundamental en la interacción con el endotelio y el epitelio de las mucosas por lo que están implicadas en la virulencia.[16][17] Las proteínas de la membrana externa de los meningococos han recibido el nombre de proteínas de clase 1 a clase 5. Las proteínas de clases 2 y 3 funcionan como porinas y son análogas a las Por gonocócicas. Las de las clases 4 y 5 son análogas a las Rmp y a las Opa , respectivamente. Los meningococos de los serogrupos B y C han sido subdivididos sobre la base de determinantes serotípicos[nota 2] localizados en las proteínas de clases 1 y 3. Algunos serotipos se asocian con la mayor parte de los casos de enfermedad meningocócica mientras que otros ubicados dentro del mismo serogrupo rara vez causan enfermedad.[14] Todas las cepas del grupo A conocidas poseen los mismos antígenos serotípicos proteicos en la membrana externa. Otro sistema de serotipificación se basa en la diversidad antigénica de los lipooligosacáridos meningocócicos, los tipos de los cuales son independientes de los serotipos proteicos, aunque a menudo se observan ciertas combinaciones juntas.[14]
Consideraciones históricas
En el siglo XVI se describió por primera vez una enfermedad que recuerda la enfermedad meningocócica.[19] Esta última fue descrita por Vieusseux en 1805 durante un brote que causó treinta y tres muertes en las cercanías de Ginebra, Suiza.[20] Un tiempo después (en 1884) los anatomopatólogos italianos Ettore Marchiafava y Angelo Celli describieron por primera vez la bacteria como micrococos ovalados intracelulares en una muestra de líquido cefalorraquídeo (LCR).[21] Finalmente, en 1887 Anton Weichselbaum la aisló del líquido cefalorraquídeo obtenido de seis de ocho pacientes con meningitis bacteriana[19] y la llamó Diplococcus intracellularis meningitidis.[21]
Los procesos patológicos que causa N. meningitidis abarcan un espectro que va desde una sepsis oculta con recuperación rápida hasta una enfermedad fulminante.[22] Antes de la década de 1920 la enfermedad meningocócica era fatal hasta en el setenta por ciento de los casos.[23] El tratamiento con suero de caballos inmunizados, introducido a principios de este siglo por Jochmann en Alemania y Flexner en los Estados Unidos, pudo reducir la mortalidad de casi cien por ciento a treinta por ciento.[23][24] El descubrimiento de las sulfamidas y otros agentes antimicrobianos llevó a un descenso aun mayor en las tasas de letalidad. A pesar del tratamiento con agentes antimicrobianos apropiados y atención médica óptima durante los últimos veinte años las tasas globales de letalidad se han mantenido relativamente estables en alrededor del nueve al doce por ciento, con una tasa de hasta el cuarenta por ciento entre los pacientes con sepsis meningocócica.[25] Del once al diecinueve por ciento de los que sobreviven a la enfermedad meningocócica quedan con secuelas como pérdida de audición, discapacidad neurológica o pérdida de una extremidad.[26]
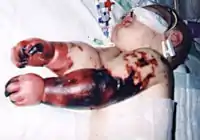

Epidemiología
N. meningitidis es una de las principales causas de enfermedad, deterioro del desarrollo y muerte en la infancia en los países industrializados y también ha sido causa de epidemias en África y en Asia. En los Estados Unidos cada año contraen la infección por N. meningitidis alrededor de dos mil quinientas a tres mil quinientas personas, lo que representa una frecuencia de aproximadamente uno de cada 100 000 habitantes. Los niños menores de cinco años están expuestos al mayor riesgo, seguidos por los adolescentes en edad de escuela secundaria. En el cinturón africano de la meningitis antes de la introducción de una vacuna en 2010 las tasas llegaban a uno de cada mil a uno de cada cien habitantes.[27] La incidencia de enfermedad meningocócica es más alta entre los lactantes (niños menores de un año), cuyo sistema inmunitario es relativamente inmaduro. En los países industrializados hay un segundo pico de incidencia en los adultos jóvenes que viven en dormitorios universitarios o fuman.[28]
Las infecciones meningocócicas ocurren en todo el mundo como enfermedades endémicas.[29] Los estudios epidemiológicos realizados con métodos moleculares modernos han revelado la existencia de algunos clones de meningococos patógenos de difusión mundial. Se cree que la aparición de la enfermedad meningocócica invasiva no está determinada únicamente por la introducción de una nueva cepa bacteriana virulenta sino también por otros factores que potencian la transmisión.[30]
De los cinco serogrupos comunes (A, B, C, Y y W135) que explican cerca del noventa por ciento de las infecciones causadas por N. meningitidis el A, el B y el C dan cuenta de la mayor parte de los casos de enfermedad meningocócica en todo el mundo, con predominio de los serogrupos A y C en Asia y África y de los serogrupos B y C como causa de la mayoría de los casos en Europa y América.[29][31] En los últimos años ha habido un aumento del número de casos causados por el serogrupo Y; por ejemplo, en el período comprendido entre 1996 y 1998 el serogrupo Y fue la causa de la tercera parte de los casos registrados en los Estados Unidos.[32] Israel y Suecia son los únicos países, aparte de los Estados Unidos, que han informado un aumento de los casos de enfermedad secundaria a la infección causada por el serogrupo Y(ET-508).[22][31] El serogrupo W-135, que actualmente explica solo el cuatro por ciento de los casos registrados en los Estados Unidos, se informó en el quince al veinte por ciento de los aislamientos recibidos por los CDC entre 1978 y 1980.[33] En 2000 un brote internacional registrado entre los peregrinos que regresaban de La Meca y sus contactos cercanos, entre ellos cuatro estadounidenses, se debió al serogrupo W135.[34] Hace poco el serogrupo W135 se asoció con un brote entre los peregrinos del Hajj así como con una gran epidemia en Burkina Faso en 2002 y 2003.[35][36]
Las tasas de enfermedad meningocócica epidémica varían de menos de 1-3/100 000 en muchas naciones desarrolladas a 10-25/100 000 en algunos países en desarrollo. Esta diferencia en las tasas de ataque refleja la diferencia en las propiedades patogénicas de las cepas prevalentes de N. meningitidis y las diferencias en las condiciones socioeconómicas y ambientales. La proporción de casos causados por cada serogrupo varía según el grupo etario; más de la mitad de los casos registrados entre los lactantes de menos de un año son causados por el serogrupo B.
Se han identificado epidemias debidas a cepas de N. meningitidis pertenecientes a por lo menos siete grupos clonales. Las cepas pertenecientes al complejo clonal ET-37, cuyo origen se remonta a 1917 y que a menudo expresan el polisacárido capsular del serogrupo C pero también pueden expresar los serogrupos B, W-135 e Y, se encuentran en todo el mundo.[29] Estas cepas han sido informadas en los Estados Unidos, Brasil y China. Otra variante de ET-37 designada ET-15 surgió a fines de la década de 1980 en los Estados Unidos y en la década de 1990 en otros países; estas cepas causaron brotes en Israel, la República Checa, Australia, Inglaterra y Canadá.[29][37] Durante los últimos treinta años hubo epidemias en Europa y en América pero no alcanzaron los niveles muy altos de incidencia de las epidemias registradas en otras partes del mundo. A fines de la década de 1970 surgió una cepa del serogrupo B perteneciente a un grupo clonal conocido como ET-5 y causó brotes en el noroeste de Europa, en América Central y en América del Sur.[38] Después de haber sido descritas por primera vez en los Países Bajos en 1980, en Europa surgieron cepas del serogrupo B pertenecientes a otro complejo clonal designado linaje III (ET-24 y ET-25).[39] La enfermedad por meningococos del serogrupo B causó el sesenta y ocho por ciento de los casos comunicados en Europa entre 1993 y 1996 y también ha causado brotes en los países desarrollados, con tasas de ataque de cinco a cincuenta casos por cada 100 000 personas.[31][38]
Los brotes más grandes y más recurrentes se han registrado en la zona semiárida del África subsahariana. En los países africanos que conforman el "cinturón de la meningitis", una región de la sabana que se extiende desde Etiopía en el este hasta Senegal en el oeste, la enfermedad causada por meningococos del serogrupo A ha sido una amenaza recurrente para la salud pública durante al menos cien años.[40][41] En 1996, el mayor brote jamás registrado ocurrió en el cinturón de la meningitis; el número total de casos notificados a la Organización Mundial de la Salud (probablemente una subestimación considerable) fue 152 813, con 15 783 muertes.[41] La respuesta de estos países a la epidemia agotó las existencias internacionales de la vacuna. En 1997, después de los grandes brotes registrados en África en el período comprendido entre 1995 y 1996, se creó el Grupo Internacional de Coordinación (GIC) del suministro de vacunas para controlar la meningitis epidémica. Los principales objetivos de ICG son garantizar el acceso rápido y equitativo a las vacunas, al material de inyección y al cloranfenicol oleoso y asegurar su uso adecuado cuando las existencias son limitadas. El ICG está compuesto por socios de las Naciones Unidas, incluida la OMS, organizaciones no gubernamentales, socios técnicos y el sector privado.
Asia ha sido foco de algunas de las principales epidemias de enfermedad meningocócica en los últimos treinta años (China en 1979 y 1980, Vietnam en 1977, Mongolia en 1973-1974 y 1994-1995, Arabia Saudita en 1987 y Yemen en 1988).[42] Los brotes más importantes, que se originaron en el norte de China y se extendieron hacia el sur y más tarde a todo el mundo, fueron causados por dos clones del serogrupo A.[29][42] Uno de esos clones se propagó al subcontinente indio en 1983 y 1987 y entre 1987 y 1996 se desplazó a través del Medio Oriente y provocó una epidemia entre los peregrinos durante el Haj, con diseminación de la cepa virulenta del grupo A de La Meca al resto del mundo.[43][29][42] En 1985 Bután también se vio afectado por la meningitis y entre septiembre de 1985 y marzo de 1986 se informaron doscientos cuarenta y siete casos con cuarenta y una muertes.[19] Durante el período de 1982 a 1984 se registraron mil cuatrocientos setenta y cinco casos en el valle de Katmandú, Nepal, con una mortalidad y una morbilidad máximas en niños menores de un año. Las cepas del serogrupo B son comunes en los países en desarrollo y la mayor parte de ellas pertenecen a unos pocos complejos clonales, identificados como ET-5, linaje III, grupo A4 y ET-37.[29]
En la Argentina se notificaron 858 casos de meningitis bacteriana durante 2012 y 821 casos en 2013. La tasa de incidencia de enfermedad meningocócica fue de 0,37/100 000 habitantes con 148 casos notificados en 2012 y de 0,44/100 000 habitantes con 175 casos notificados en 2013. Se debe tener en cuenta que en los últimos años la disponibilidad de una mejor metodología diagnóstica y de mejores circuitos de información podría haber determinado un mayor número de casos notificados, aunque como se ve las tasas de incidencia se mantienen estables.[44]
Genoma
Se ha determinado la secuencia de al menos ocho genomas completos de cepas de Neisseria meningitidis y se ha establecido que codifican aproximadamente 2100 a 2500 proteínas.[45]
El genoma de la cepa MC58 (serogrupo B) tiene 2 272 351 pares de bases. Cuando se lo secuenció en 2000 se determinó que contenía 2158 marcos de lectura abiertos (ORF, del inglés open reading frame) y en 1158 (53,7 %) de ellos se identificó una función biológica. Se hallaron tres islas principales de transferencia genética horizontal de ADN y se determinó que dos de ellas codificaban proteínas implicadas en la patogenicidad mientras que la tercera isla solo codificaba proteínas hipotéticas. Los genes con variación de fase (un mecanismo que ayuda al patógeno a evadir el sistema inmunitario del huésped) eran más numerosos que los hallados en cualquier agente patógeno conocido hasta entonces.[46]
El genoma de la cepa H44/76 tiene 2,18 Mb y codifica 2480 marcos de lectura abiertos, en comparación con los 2,27 Mb y los 2465 marcos de lectura abiertos correspondientes a la cepa MC58.[45] Ambas cepas tienen un contenido de GC de 51,5 %.[45] En una comparación con MC58 se determinó que cuatro genes solo están presentes en H44/76 y nueve genes solo lo están en MC58. De todos los marcos de lectura abiertos en H44/76, 2317 (93 %) muestran más del 99 % de identidad de secuencia.[45]
La secuencia completa del genoma de la cepa NMA510612 (serogrupo A) consiste en un cromosoma circular con un tamaño de 2 188 020 pares de bases y un contenido medio de GC del 51,5 %. El cromosoma poseería cuatro operones ARNr, ciento sesenta y tres elementos de secuencias de inserción (IS), cincuenta y nueve ARNt y 2462 marcos de lectura abiertos.[47]
Transformación genética
Transformación genética es el nombre del proceso por el cual una célula bacteriana receptora capta ADN de una célula vecina y lo integra en el genoma por recombinación. En N. meningitidis la transformación del ADN requiere la presencia de secuencias cortas (9-10 mers con residencia en regiones codificantes) del ADN donante. Esas secuencias se denominan secuencias de captación de ADN (DUS, del inglés DNA uptake sequences) y su reconocimiento específico está mediado por una pilina de tipo IV.[46] En N. meningitidis las secuencias de captación de ADN se producen con una densidad significativamente mayor en los genes que intervienen en la reparación y la recombinación del ADN (así como en la restricción-modificación y la replicación) que en otros grupos de genes. La sobrerrepresentación de secuencias de captación de ADN en los genes de reparación y recombinación del ADN puede reflejar el beneficio de mantener la integridad de la maquinaria de reparación y recombinación del ADN mediante la captación preferencial de los genes de mantenimiento del genoma, que podrían sustituir a sus homólogos dañados en la célula receptora.[48]
N. meningitidis coloniza la mucosa de la nasofaringe, que es rica en macrófagos. Tras su activación, los macrófagos producen superóxido (O2-) y peróxido de hidrógeno (H2O2) de modo que es probable que N. meningitidis encuentre estrés oxidativo durante su ciclo vital.[49] En consecuencia, un beneficio importante de la transformación genética de esta bacteria puede ser el mantenimiento de la maquinaria celular de recombinación y reparación que elimina daños oxidativos del ADN del tipo de los causados por el oxígeno reactivo. Esto es compatible con la idea más general de que la transformación beneficia a los patógenos bacterianos porque facilita la reparación de daños del ADN producidos por las defensas oxidativas del huésped durante la infección.[50]
Patogenia y fisiopatología
La meningitis clínica surge en gran parte de la respuesta del huésped a la presencia del microorganismo en el líquido cefalorraquídeo. Los estudios realizados en animales han proporcionado mucha información sobre las secuelas fisiopatológicas de la meningitis —específicamente, sobre los factores del patógeno y del huésped que conducen a inflamación meníngea, edema cerebral y daño neurológico permanente—.[51]
La infección es secundaria a la aspiración de partículas infecciosas que se adhieren a las células epiteliales de la mucosa de la nasofaringe y la orofaringe, atraviesan la barrera de la mucosa e ingresan en la circulación. Si las bacterias transportadas en la sangre no son eliminadas podrán entrar en el sistema nervioso central (SNC) y causar meningitis,[14] una enfermedad que en la mayor parte de los casos es de origen hematógeno por lo que la patogenia implica una secuencia de acontecimientos relacionados con la expresión de factores de virulencia bacterianos que superan los mecanismos de defensa del huésped y permiten que el patógeno alcance el sistema nervioso central, lo invada y se replique en él.[52]
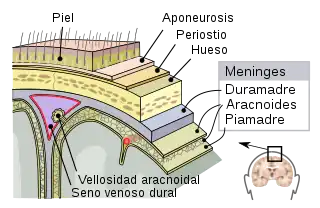
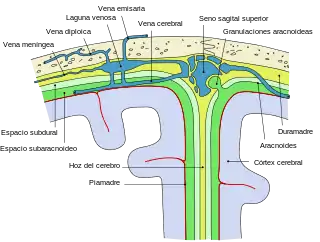
Después del ingreso y la replicación de la bacteria en el sistema nervioso central su pared libera componentes en el espacio subaracnoideo y se pone en marcha la cascada inflamatoria. Esa inflamación es la causa principal de los fenómenos fisiopatológicos que contribuyen al síndrome clínico de la meningitis bacteriana, que son el aumento de la permeabilidad de la barrera hematoencefálica con desarrollo de edema cerebral, la alteración de la circulación del líquido cefalorraquídeo con la aparición de hidrocefalia o higroma subdural, el compromiso cerebrovascular por microtrombosis o vasculitis y, con una participación determinante en la mortalidad, la morbilidad neurológica y las secuelas finales, el incremento de la presión intracraneal y la alteración del flujo sanguíneo cerebral.[51][53]
Como ya se dijo, la nasofaringe humana es el único reservorio conocido de N. meningitidis. Los meningococos se diseminan a través de las gotitas respiratorias (gotitas de Pfflüge)[nota 3] emitidas al hablar o al toser por las personas que han colonizado[4] y la aspiración de las partículas infecciosas explica la transmisión.[14] Los microorganismos aspirados se adhieren a las células cilíndricas no ciliadas del epitelio de la nasofaringe en un proceso de adhesión mediado por los pili (y es posible que también por otros componentes de la membrana externa) y se multiplican allí. En una pequeña proporción (inferior al uno por ciento) de las personas colonizadas el meningococo penetra en las células de la mucosa e ingresa en la circulación, desde la que se disemina a muchos órganos. En alrededor del cincuenta por ciento de los casos[4] de bacteriemia los microorganismos atraviesan la barrera hematoencefálica hasta llegar al líquido cefalorraquídeo y causar una meningitis purulenta. El antecedente de infección de las vías respiratorias superiores puede ser un factor contribuyente.[4]
El mecanismo de invasión de las células de la mucosa es semejante al utilizado por N. gonohrroeae pero, después de ser internalizados, los meningococos permanecen en una ubicación apical de la célula epitelial y no se sabe bien por qué vía acceden al espacio subepitelial. Los trímeros de las proteínas de clases 2 y 3 tienen la capacidad de traslocarse de células intactas e insertarse en la membrana de las células eucariotas para formar canales dependientes del voltaje, un proceso que puede ser importante en la invasión.[14]
Anatomía patológica y estudio necrópsico
La infección produce un exudado purulento que es mayor a nivel de las cisternas basales y ocupa todo el espacio subaracnoideo. La piamadre protege al sistema nervioso central de la formación de abscesos. Sin embargo, en el cerebro subyacente no invadido se produce una sucesión de congestión - edema - isquemia.[55] Ese exudado provoca la obstrucción del espacio subaracnoideo a la circulación del líquido cefalorraquídeo, lo que puede llegar a complicarse con pioventriculitis, hidrocefalia o ambas cosas. Cuando se comprometen los vasos se producen infartos por arteritis o tromboflebitis. También pueden afectarse los pares craneales con paresia o parálisis resultantes.[55] En la etapa inicial la médula espinal y el cerebro se encuentran congestionados y tumefactos. Pese a que existen zonas en las que no se encuentra gran cantidad de exudado, las leptomeninges se ven opacas y congestionadas. Cuando el proceso es fulminante o de larga evolución, la inflamación se extiende a la superficie ependimaria o incluso se disemina hacia la médula espinal. En el espacio subaracnoideo el exudado es rico en neutrófilos y hay cantidades variables de fibrina. En las áreas más afectadas el exudado sustituye por completo al espacio subaracnoideo.[56] Por el contrario, en las áreas menos comprometidas solo contiene células el tejido que rodea los vasos sanguíneos leptomeníngeos. Puede haber vasculitis cuando las infecciones son fulminantes y las células inflamatorias infiltran las paredes de las venas leptomeníngeas. Por otro lado, la arteritis no es una complicación frecuente salvo que el proceso sea prolongado. Esto se debe a la diferencia de resistencia a la sepsis, que es mayor en las arterias y menor en las venas. Las oclusiones venosas producen un infarto hemorrágico de la corteza y de la sustancia blanca subyacente, lo que puede provocar convulsiones resistentes al tratamiento. En los casos terminales es posible observar una aracnoiditis fibrosa densa que es más evidente en la base del cerebro.[57]
En una carta dirigida a una revista médica española[58] se afirma que según los datos del Centro Nacional de Epidemiología, en la temporada 2003-2004 la tasa de enfermedad meningocócica en España fue de 1,81 casos por 100 000 habitantes (casos confirmados), con una letalidad de 11,1 %. Según los mismos autores[58] en ocasiones la evolución de la infección es atípica (con síntomas mínimos o inespecíficos) y debido a su particular grado de agresividad puede evolucionar en muy pocas horas hacia el coma, el shock y la muerte, sin dar tiempo a establecer el diagnóstico. En estos casos es obligatorio realizar una autopsia pues el análisis microbiológico de las muestras del estudio necrópsico será clave para la detección temprana del agente infeccioso.[59][58] Esa autopsia será judicial cuando el paciente muera en su domicilio sin haber asistido a un centro sanitario y no se encuentre una causa clara de muerte en un principio o bien cuando se requiera una investigación pericial ante una denuncia por presunta mala praxis. Los encargados de esta investigación son los servicios de patología forense de los institutos de medicina legal (IML) en colaboración con el Instituto Nacional de Toxicología y Ciencias Forenses de España (INTCF).[58]
Siempre según los mismos autores,[58] el propósito de la carta enviada a la revista médica que se comenta aquí es difundir entre la comunidad científica la necesidad de disponer de un protocolo de investigación del estudio necrópsico ante la sospecha de esas infecciones, tanto en el ámbito médico legal (autopsias judiciales) como en el hospitalario (autopsias clínicas) porque esos análisis representan la única forma posible de conocer la incidencia real de los casos fatales de meningitis bacteriana e infección meningocócica y realizar una correcta profilaxis en los contactos. El protocolo que proponen ha sido elaborado por el INTCF en colaboración con los IML e incluye pautas de intervención precisas y rápidas que permiten la respuesta coordinada inmediata de los distintos profesionales (médicos clínicos, forenses, patólogos, microbiólogos y médicos de sanidad) y las instituciones relacionadas (IML, INTCF, consejerías de Sanidad, centros asistenciales y Centro Nacional de Microbiología).[60] Además, la incorporación reciente de las técnicas de biología molecular al laboratorio forense ha aportado nuevas estrategias de análisis que han obviado, al menos en parte, las limitaciones de las técnicas microbiológicas tradicionales.[61]
El estudio microbiológico propuesto en el protocolo consta de técnicas presuntivas y confirmatorias. Las técnicas presuntivas, que son rápidas y sensibles, consisten en la detección de antígenos de bacterias que suelen causar infecciones fulminantes e incluyen la aglutinación con látex, la inmunocromatografía y el ELISA.[60] Las técnicas confirmatorias son el diagnóstico molecular y el cultivo microbiológico. El diagnóstico molecular incluye la reacción en cadena de la polimerasa (PCR) en tiempo real, que es una técnica muy específica, sensible y rápida (dos-tres horas) cuyo empleo se propone para la detección de genes específicos de N. meningitidis (ctrA y siaD), S. pneumoniae (ply) y H. influenzae serotipo b (bexA) pero sobre todo para la detección del serogrupo de N. meningitidis, un dato necesario para el posterior tratamiento de los contactos. Además, la PCR permite la detección del microorganismo aunque este ya no se encuentre en forma viable en la muestra y por ende no se pueda aislar en un cultivo, algo relativamente frecuente en las muestras forenses. Por su parte, el cultivo bacteriano permite detectar microorganismos para los que no se han desarrollado técnicas moleculares en el laboratorio, así como caracterizar la cepa aislada con fines epidemiológicos.[60]
La puesta en práctica de este protocolo ya ha permitido detectar infecciones no diagnosticadas ante mortem, entre ellas la enfermedad meningocócica, así como proceder, tras su comunicación a las autoridades sanitarias, a la profilaxis de los contactos.[58]
Pruebas de susceptibilidad antimicrobiana
Hay dos métodos para realizar las pruebas de susceptibilidad antibiótica, a saber, el método de difusión en disco y el método de concentración inhibitoria mínima (CIM) (concentración más baja de un antimicrobiano que inhibe el crecimiento de un microorganismo después de su incubación).[62] El término susceptible significa que el microorganismo es inhibido por una concentración de agente antimicrobiano que se puede alcanzar en la sangre con la dosis normalmente recomendada del agente antimicrobiano e implica que una infección causada por ese microorganismo se puede tratar adecuadamente con ese agente antimicrobiano. El término resistente indica que el microorganismo es resistente a las concentraciones del agente antimicrobiano que pueden alcanzarse con dosis normales e implica que una infección causada por ese microorganismo no puede ser tratada con éxito con ese agente antimicrobiano.[62]
Factores de riesgo
Existen factores que favorecen la diseminación y la colonización, entre ellos el hacinamiento y el humo del tabaco o de la leña;[63] también se han descrito factores de riesgo vinculados con el huésped y asociados con el desarrollo de la enfermedad meningocócica, como infecciones virales, deficiencias de factores del complemento (C3, C5-9)[64] y otras alteraciones del sistema inmunitario.[65]
Manifestaciones clínicas
Los síntomas más frecuentes son rigidez de nuca, fiebre elevada, fotosensibilidad, confusión, cefalea y vómitos. Incluso cuando la enfermedad se diagnostica en una fase temprana y recibe tratamiento adecuado, del cinco al diez por ciento de los pacientes fallecen, por lo general en las primeras veinticuatro a cuarenta y ocho horas posteriores a la aparición de los síntomas.[66] La meningitis bacteriana puede producir daño cerebral, sordera o discapacidad de aprendizaje en el diez al veinte por ciento de los sobrevivientes. Una forma menos frecuente pero aún más grave de enfermedad causada por meningococos es la septicemia meningocócica, que se caracteriza por una erupción cutánea hemorrágica y colapso circulatorio rápido.[66]
El espectro de presentaciones varía según la secuencia de acontecimientos fisiopatológicos y los factores vinculados con el agente y con el huéped. Por ejemplo, los pacientes con enfermedad meningocócica invasiva pueden presentarse con: (1) bacteriemia sin shock (meningococemia leve aguda), (2) bacteriemia con shock pero sin meningitis (meningococemia fulminante), (3) bacteriemia con shock y meningitis, (4) meningitis sola y (5) meningococemia crónica benigna.[42] Si se clasifica a los pacientes en grupos basados en la duración de la enfermedad antes de la hospitalización, el sitio, la gravedad y el pronóstico la adopción de las decisiones clínicas será más fácil, en particular para la institución inmediata de medidas de sostén vital de efectividad máxima.[42]
La infección meníngea resultante de la diseminación hematógena del microorganismo ocurre en alrededor del cincuenta al cincuenta y cinco por ciento de los pacientes y es similar a otras formas de meningitis purulenta aguda. N. meningitidis puede ser aislada de la circulación sanguínea en hasta el setenta y cinco por ciento de los casos pero la meningococemia se produce en solo el cinco al veinte por ciento de los pacientes.[32] Los primeros síntomas son determinados por la entrada repentina de meningococos en el torrente sanguíneo de modo que pueden sugerir una meningococemia fulminante. Las lesiones cutánes hemorrágicas características (petequias) solo se desarrollan en el ochenta por ciento de los pacientes y se tornan evidentes recién doce a dieciocho horas después de los primeros síntomas de la enfermedad. El líquido cefalorraquídeo puede ser normal.[19] Las secuelas neurológicas, que varían de sordera neurosensorial, retraso mental, espasticidad o convulsiones a trastornos de la concentración, se observan en el ocho al veinte por ciento de los sobrevivientes.[67]
En menos del uno por ciento de los pacientes, en su mayoría adultos, la presentación consiste en uno o más episodios de fiebre elevada, artralgia o artritis y una erupción recurrente, síndrome que se denomina meningococemia benigna crónica.[42] Algunos autores ya mencionados[19] opinan que no se entiende cómo es posible que estos pacientes toleren la presencia de bacterias potencialmente letales en su torrente sanguíneo durante varias semanas. En esos casos se desarrollan episodios recurrentes de fiebre que duran de algunos días a varias semanas y en alrededor del veinte por ciento de ellos finalmente aparecerá una meningitis. Los hemocultivos realizados durante los episodios febriles no siempre son positivos y cuando los pacientes se encuentran afebriles por lo general son negativos. Se desconoce la fuente del microorganismo durante los episodios febriles recurrentes.[19]
Diagnóstico
El diagnóstico de la meningitis meningocócica puede establecerse a partir de la exploración física, seguida de una punción lumbar que de ser positiva mostrará un líquido cefalorraquídeo purulento. En ocasiones el examen microscópico de dicho líquido permitirá detectar la bacteria. El diagnóstico es confirmado por el cultivo positivo de la sangre o del líquido cefalorraquídeo, las pruebas de aglutinación o la reacción en cadena de la polimerasa (PCR). La identificación de los serogrupos y el antibiótico son importantes para definir las medidas de control.[66]
Dado que existe un riesgo de mortalidad cercano al quince por ciento dentro de las doce horas posteriores a la aparición de la infección, es crucial comenzar a realizar las pruebas diagnósticas lo antes que se pueda pero sin esperar los resultados para iniciar la terapia con antibióticos.[68][69][70][71]
Tan pronto como sea posible se enviará al laboratorio una pequeña cantidad de líquido cefalorraquídeo para su análisis. El diagnóstico se sospechará cuando se observen diplococos gramnegativos en la tinción de Gram de una muestra de líquido cefalorraquídeo centrifugada; a veces se encontrarán diplococos en el interior de los leucocitos. La identificación microscópica tomará alrededor de una a dos horas después de la llegada de la muestra al laboratorio.[72]
La prueba diagnóstica de referencia es el aislamiento microbiológico de N. meningitidis mediante el cultivo de un líquido corporal estéril, que puede ser líquido cefalorraquídeo o sangre.[27] El diagnóstico se confirmará cuando se observe que el microorganismo se ha desarrollado, lo que sucede más a menudo en una placa de agar chocolate pero también en agar de Thayer-Martin. Para diferenciar las bacterias que hayan crecido de otras especies se tomará una pequeña cantidad de una colonia y se la someterá a las pruebas de oxidasa y catalasa, en las cuales todas las especies de Neisseria de importancia clínica muestran una reacción positiva; luego se realizará una prueba de fermentación de los hidratos de carbono con maltosa, sacarosa y glucosa, en la que si se trata de N. meningitidis se observará fermentación de la glucosa y la maltosa. Por último, la serología determinará el subgrupo de las cepas de N. meningitidis, un dato importante para la vigilancia epidemiológica que a menudo solo es posible obtener en laboratorios especializados.[73] Si bien esta etapa diagnóstica no tiene implicancias clínicas, es de alto valor epidemiológico pues define el perfil de las cepas circulantes en una determinada población.[73]
Con las pruebas anteriores se necesitarán por lo menos cuarenta y ocho a setenta y dos horas para el cultivo del microorganismo y hasta una semana más para la serotipificación. El cultivo puede fallar (lo que sucede a menudo) debido a la administración preventiva de antibióticos o al transporte inapropiado de las muestras porque el microorganismo es en extremo susceptible a los antibióticos y exigente en sus requerimientos de temperatura, CO2 y medios de cultivo.[74]
La reacción en cadena de la polimerasa, que se utiliza cada vez más, sobre todo en los países industrializados, puede identificar rápidamente el microorganismo y funciona incluso después de la administración de antibióticos.[27]
Tratamiento
Las personas con infección confirmada por N. meningitidis deben ser hospitalizadas de inmediato para recibir tratamiento con antibióticos.[71] Como la enfermedad meningocócica puede diseminarse con gran rapidez, lo habitual es que si los síntomas son lo bastante sospechosos se administre una dosis de antibiótico por vía intramuscular en la primera oportunidad posible, incluso antes de la hospitalización.[27] Para tratar una infección meningocócica que se sospecha o se ha comprobado por cultivo deben administrarse cefalosporinas de tercera generación (cefotaxima, ceftriaxona) antes de disponer de los resultados de sensibilidad a los antibióticos.[71] También debe considerarse el tratamiento empírico si la punción lumbar destinada a obtener líquido cefalorraquídeo para pruebas de laboratorio no puede efectuarse dentro de los treinta minutos posteriores al ingreso al hospital.[52] Es posible que el tratamiento con antibióticos afecte los resultados de las pruebas de microbiología pero el diagnóstico puede efectuarse sobre la base de los hemocultivos y el examen clínico.[75] Numerosos estudios han demostrado que la antibioticoterapia previa no altera de manera significativa el recuento de leucocitos en líquido cefalorraquídeo ni la proteinorraquia y la glucorraquia (concentraciones de glucosa y proteínas en el LCR).[76][77]
Los autores de una publicación[78] en la que se describen los efectos de un tratamiento antibiótico completo de corto plazo sobre el líquido cefalorraquídeo de sesenta y ocho niños estudiados de forma retrospectiva determinaron que en sesenta y cinco de esos niños el tratamiento antibiótico intravenoso completo administrado durante cuarenta y cuatro a sesenta y ocho horas no había alterado la bioquímica ni la citología del líquido cefalorraquídeo, que conservaba su carácter "bacteriano". A partir de esos resultados los autores llegaron a la conclusión de que las probabilidades de que un tratamiento antibiótico parcial distorsionara un líquido cefalorraquídeo "bacteriano" eran aun menores.[78]
En otro estudio realizado para establecer la importancia de la positividad persistente para patógenos de los cultivos de líquido cefalorraquídeo obtenido de bebés y niños con meningitis bacteriana tratados con las nuevas cefalosporinas[76] se observó que las convulsiones, los derrames subdurales y la hemiparesia eran mucho más frecuentes durante la hospitalización en los pacientes en los que se había demorado la esterilización del líquido cefalorraquídeo.[76] En los niños en los que los cultivos habían seguido siendo positivos había existido una incidencia mayor de alteraciones neurológicas en el momento del alta hospitalaria (cuarenta y cinco por ciento en comparación con diecinueve por ciento) y en el seguimiento (cuarenta y uno por ciento contra trece por ciento) y de deficiencia auditiva moderada a profunda (treinta y cinco por ciento contra quince por ciento) que en los niños con esterilización rápida del líquido cefalorraquídeo.[76]
Cuando la punción lumbar se retrasa o la tinción de Gram del líquido cefalorraquídeo no es diagnóstica es esencial administrar un tratamiento empírico dirigido contra los patógenos más probables sobre la base de la edad y el estado fisiológico subyacente del paciente.[79] En la mayor parte de los casos se recomienda una cefalosporina de amplio espectro (cefotaxima o ceftriaxona) suplementada con ampicilina en los lactantes menores de tres meses y en los adultos de más de cincuenta años.[79] En todos los pacientes el tratamiento deberá modificarse cuando se disponga de los resultados del cultivo de líquido cefalorraquídeo y de las pruebas de susceptibilidad antimicrobiana.[79]
Según el mismo autor,[79] dado el potencial de morbilidad neurológica y de mortalidad de este cuadro es importante iniciar el tratamiento antibiótico enseguida y la acusación de falta de tratamiento inmediato de la meningitis bacteriana es un motivo común de juicio por mala praxis.[79] Uno de los factores que más contribuyen al retraso del diagnóstico y la terapia es la decisión de realizar una tomografía computarizada de cráneo antes de la punción lumbar.[80] Esa práctica deriva de los informes publicados en las décadas de 1950 y 1960 acerca del deterioro neurológico pospunción lumbar en pacientes con aumento de la presión intracraneal o lesiones ocupantes intracraneales.[79] Los que proponen que las imágenes se obtengan primero argumentan que las lesiones ocupantes intracraneales pueden no ser clínicamente evidentes, que la antibioticoterapia empírica se puede iniciar antes de la obtención de las imágenes y que el retraso de la punción lumbar no afecta la precisión del diagnóstico ni los resultados. En cambio, los que se oponen sostienen que la obtención sistemática de imágenes antes de la punción lumbar desperdicia tiempo y recursos y se realiza en lugar de obtener una historia clínica exacta y realizar una exploración física completa. Cuando se sospecha una meningitis aguda solo los pacientes con coma, edema de papila o hallazgos neurológicos focales requieren imágenes craneales antes de la punción lumbar.[79] Si se indica la obtención de imágenes conviene que se realicen hemocultivos, se inicie la antibioticoterapia empírica y se efectúe la punción lumbar inmediatamente después de la tomografía si no hay lesión ocupante intracraneal.[79] El comienzo de la antibioticoterapia una a dos horas antes de la punción lumbar no disminuirá la sensibilidad diagnóstica si el cultivo del líquido cefalorraquídeo se efectúa en conjunto con el análisis de dicho líquido para detectar antígenos bacterianos y con los hemocultivos.[75]
En los pacientes con lesiones cutáneas sugestivas de meningitis meningocócica la antibioticoterapia debe ser iniciada de inmediato. Si no es posible, se la puede demorar como mucho treinta minutos para realizar la tinción de Gram del líquido cefalorraquídeo e instituir la terapia antibiótica previa si está indicada.[69][70]
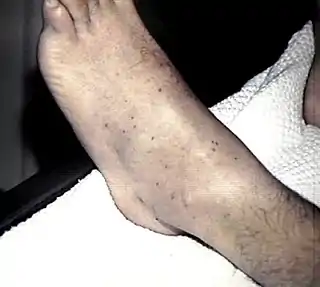
La evolución de la meningitis aguda meningocócica (y de otra etiología) puede ser fulminante y el comienzo del tratamiento antibiótico empírico antes de que se desarrolle el proceso inflamatorio sistémico puede ser un factor determinante de la supervivencia y de la morbilidad.[69] En un paciente con un cuadro agudo de lesiones purpúricas o alteración de la conciencia se administrará una primera dosis de antibiótico (ceftriaxona o cefotaxima) de forma inmediata (y si es necesario ambulatoria) sin esperar al traslado ni a la obtención de muestras para cultivo.[69] Esta recomendación puede ser objeto de críticas, entre otros motivos por la posibilidad de diagnósticos falsos positivos y el enmascaramiento del proceso real del paciente. Si bien es cierto que varias enfermedades virales poco importantes pueden asociarse con petequias y fiebre, ante un niño con fiebre y petequias es razonable considerar la posibilidad de meningococemia hasta descartarla. La crítica más importante que se le formula a esta indicación es el bajo rendimiento de las pruebas microbiológicas en muestras obtenidas tras iniciar el tratamiento (además de que el tratamiento inadecuado de la infección en general y de la sepsis en particular ha sido relacionado con un pronóstico más desfavorable). Se ha sugerido que después de la administración parenteral de antimicrobianos el líquido cefalorraquídeo se esterilizaría en unas dos o tres horas e incluso más rápido (en el caso del meningococo en menos de una hora). No obstante, casi todos los datos sobre resultados falsos negativos de los cultivos de líquido cefalorraquídeo provienen de estudios realizados in vitro o de estudios clínicos retrospectivos.[69] En un estudio prospectivo se llegó a la conclusión de que si bien la probabilidad de negativización de las pruebas microbiológicas aumenta con el tratamiento previo las características citológicas y bioquímicas no se alteran de manera significativa. En otros estudios la reacción en cadena de la polimerasa demostró que la proporción de aislamientos de ADN de N. meningitidis en el líquido cefalorraquídeo es similar entre los pacientes tratados y no tratados antes de la hospitalización, por lo que en caso de duda y si resulta imprescindible aclarar el diagnóstico una prueba basada en la PCR podría resolver la incertidumbre.[69]
Los pacientes con meningitis bacteriana a menudo permanecen hospitalizados mientras dura el tratamiento antimicrobiano administrado por vía intravenosa pero en casos seleccionados el tratamiento antimicrobiano ambulatorio puede ser apropiado y por ende determinar una disminución de los costos de hospitalización, un menor riesgo de desarrollo de infecciones nosocomiales y una mejor calidad de vida.[81][82] Aunque han surgido preocupaciones acerca del riesgo potencial de complicaciones graves en pacientes con meningitis bacteriana, las complicaciones (cuando se producen) suelen aparecer dentro de los primeros dos o tres días de tratamiento y son rarísimas una vez transcurridos tres o cuatro días de antibioticoterapia apropiada. De todos modos, la selección de los pacientes que van a recibir tratamiento antimicrobiano ambulatorio para la meningitis bacteriana debe realizarse con cuidado y con un seguimiento médico estricto.[71]
Prevención
Todas las personas que hayan estado en contacto con un paciente infectado durante los siete días anteriores al comienzo de los síntomas deberán recibir quimioprofilaxis para evitar la infección. La quimioprofilaxis está indicada especialmente en los niños pequeños, en las personas que cuidan al paciente, en las que están o han estado en contacto con él en la guardería o en la escuela a la que asiste y en cualquier persona que haya estado expuesta directamente al paciente a través de besos, utensilios compartidos o intervenciones médicas como la reanimación boca a boca. Toda persona que haya comido, dormido o permanecido en la casa del paciente durante los siete días anteriores al inicio de los síntomas o que se haya sentado junto al paciente en un vuelo de avión o en un salón de clases durante ocho horas o más también deberá recibir quimioprofilaxis. El agente de elección es la rifampicina —en general por vía oral— durante algunos días.[27]
Vacunación
Las vacunas elaboradas con polisacáridos, disponibles desde hace más de treinta años, pueden ser bivalentes (grupos A y C), trivalentes (grupos A, C y W) o tetravalentes (grupos A, C, Y y W135).[66] No es posible desarrollar vacunas contra el grupo B basadas en polisacáridos por el mimetismo antigénico de estos con los polisacáridos del tejido nervioso humano. La primera vacuna contra el grupo B (NmB), integrada por una combinación de cuatro componentes proteínicos, salió a la luz en 2014.[66] Las vacunas conjugadas contra el meningococo del grupo C están disponibles desde 1999 y se utilizan ampliamente. En 2005 se autorizó en los Estados Unidos, Canadá y Europa una vacuna conjugada tetravalente (grupos A, C, Y y W135) para niños y adultos.[66]
Las tasas más altas de enfermedad se registran en el amplio cinturón de la meningitis del África subsahariana, que va del Senegal al oeste hasta Etiopía al este (veintiséis países). Esos países son Benín, Burkina Faso, Burundi, Camerún, Chad, Costa de Marfil, Eritrea, Etiopía, Gambia, Ghana, Guinea, Guinea-Bissau, Kenya, Malí, Mauritania, Níger, Nigeria, República Centroafricana, República Democrática del Congo, Ruanda, Senegal, Sudán, Sudán del Sur, Tanzania, Togo y Uganda. El riesgo de epidemias de meningitis meningocócica varía en cada uno de los veintiséis países y de un país a otro.[66]
En diciembre de 2010 se introdujo en todo Burkina Faso y en algunas regiones de Malí y el Níger (las restantes regiones se incluyeron en 2011) una nueva vacuna conjugada contra los meningococos del grupo A destinada a personas de uno a veintinueve años. Hasta el mes de enero de 2015 esta nueva vacuna había sido administrada a doscientos diecisiete millones de personas en quince países (Benín, Burkina Faso, Camerún, Chad, Costa de Marfil, Etiopía, Gambia, Ghana, Malí, Mauritania, Níger, Nigeria, Senegal, Sudán y Togo).[66]
La vacuna conjugada contra los meningococos del grupo A posee varias ventajas con respecto a las vacunas de polisacáridos. Por ejemplo, induce una respuesta inmunitaria superior y más duradera contra los meningococos del grupo A, reduce la portación de la bacteria en la garganta y por lo tanto su transmisión, se espera que ofrezca protección de largo plazo no solo a las personas vacunadas sino también a sus familiares y a otras personas que de lo contrario hubieran estado expuestas a la meningitis, tiene un precio inferior al de otras vacunas contra los meningococos (cuesta alrededor de 0,60 dólares por dosis mientras que los precios de otras vacunas antimeningocócicas oscilan entre 2,50 y 117 dólares por dosis) y se espera que sea especialmente efectiva en la protección de los niños menores de dos años, que no responden a las vacunas convencionales de polisacáridos. Además, como es termoestable puede utilizarse en cadenas con temperaturas controladas. Más de dos millones de personas en cuatro países han recibido la vacuna sin necesidad de recurrir al hielo en los puestos de vacunación.[66]
Se prevé que los veintiséis países africanos considerados en peligro de registrar epidemias de meningitis hayan introducido la vacuna a más tardar en 2016. Además se espera que la elevada cobertura del grupo etario al que va destinada (personas de uno a veintinueve años) elimine la epidemia de infección por meningococos del grupo A de esta región de África.[66]
Estados Unidos
En los Estados Unidos hay tres vacunas disponibles desde 2008 para prevenir la enfermedad meningocócica en niños de dos años o mayores y las tres son eficaces contra los mismos serogrupos: A, C, Y y W-135. Desde la década de 1970 se dispone de una vacuna antimeningocócica basada en polisacáridos (MPSV4) que además de ser la única vacuna contra el meningococo autorizada para personas mayores de cincuenta y cinco años también se puede utilizar desde los dos años hasta los cincuenta y cinco si las vacunas antimeningocócicas conjugadas (MCV4) no se hallan disponibles o están contraindicadas. En los Estados Unidos hay dos vacunas antimeningocócicas conjugadas de uso autorizado. La primera de ellas fue autorizada en 2005 y la segunda lo fue en 2010. Las vacunas conjugadas son las preferidas para las personas de dos a cincuenta y cinco años. Están indicadas en pacientes con deterioro de la inmunidad (p. ej., pacientes con síndrome nefrótico o esplenectomía. Los Centros para el Control y Prevención de Enfermedades (CDC) publican información sobre quién debe recibir la vacuna contra el meningococo.[83]
En junio de 2012 la Administración de Alimentos y Medicamentos de los Estados Unidos o FDA (U.S. Food and Drug Administration) aprobó una vacuna combinada contra dos tipos de enfermedad meningocócica y contra la enfermedad por Haemophilus influenzae de tipo b (Hib) para bebés y niños de seis semanas a dieciocho meses. La vacuna, Menhibrix, fue creada para prevenir la enfermedad causada por Neisseria meningitidis serogrupos C e Y y la provocada por Haemophilus influenzae de tipo b (Hib). Fue la primera vacuna antimeningocócica aplicable a niños de apenas seis semanas.[84]
En octubre de 2014 la FDA aprobó la primera vacuna eficaz contra el serogrupo B, llamada Trumenba, para ser usada en los grupos etarios de diez a veinticinco años.[85]
África
En 2010 el Proyecto Vacunas contra la Meningitis introdujo una vacuna llamada MenAfriVac en el cinturón africano de la meningitis. La vacuna, que fue elaborada por el fabricante de medicamentos genéricos Serum Institute de la India y cuesta 50 centavos de dólar por inyección, a partir de Burkina Faso en 2010 ha sido aplicada a 215 millones de personas en Benín, Camerún, Chad, Costa de Marfil, Etiopía, Ghana, Malí, Níger, Mauritania, Nigeria, Senegal, Sudán, Togo y Gambia.[84] A partir de enero de 2015 no se ha observado ningún caso de meningitis meningocócica en las poblaciones vacunadas y la transmisión se ha detenido en el cinturón. El 8 de enero de 2015 la Organización Mundial de la Salud autorizó la MenAfriVac para la inmunización infantil de rutina en África.[84]
España
Tras la reducción de los casos de enfermedad causada por el serogrupo C de Neisseria meningitidis como resultado de la introducción de la vacuna antimeningococo C en el calendario de vacunación sistemática del año 2000, el serogrupo B de meningococo es la causa más frecuente de meningitis bacteriana y septicemia en España, lo que no se debe al desplazamiento de serogrupos como aseveran algunos grupos antivacunas sino a que la enfermedad meningocócica por serogrupo B se ha mantenido estable.[86][87] En España, la enfermedad meningocócica es de declaración obligatoria, urgente e individual y se registra por la Red Nacional de Vigilancia Epidemiológica mediante la notificación al Sistema de Enfermedades de Declaración Obligatoria (EDO).[88]
La Agencia Europea de Medicamentos o EMA (del inglés European Medicines Agency) recomendó la autorización de la primera vacuna contra la meningitis bacteriana causada por Neisseria meningitidis de tipo B.[89] Según lo anunciado en su momento por el Comité de productos para uso humano de la citada entidad, "no hay trabas para que se autorice la comercialización de Bexsero, un producto destinado a niños mayores de dos meses que protege de todas las infecciones provocadas por la bacteria Neisseria meningitidis (de tipo B). Las vacunas disponibles no ofrecen protección contra la meningitis por meningococos del serogrupo B, que representa hasta el noventa por ciento de todos los casos de enfermedad meningocócica en algunos países europeos y el setenta y siete por ciento de los casos en España".[89]
Finalmente, en agosto de 2014 se autorizó esa vacuna, que como ya se dijo es la primera contra el meningococo de tipo B (Bexsero).[90] Se trata de una vacuna con cuatro componentes, a saber, tres proteínas recombinantes de Neisseria meningitidis del grupo B (NHBA, NadA, fHbp), producidas en células de Escherichia coli mediante tecnología de ADN recombinante, y vesículas de la membrana externa (OMV, del inglés outer membrane vesicles) de Neisseria meningitidis del grupo B cepa NZ98/254 (antígeno PorA P1.4). Los cuatro antígenos están adsorbidos en hidróxido de aluminio. Esta vacuna, autorizada en enero de 2013 en Europa mediante un procedimiento centralizado,[91][92] está destinada a la prevención de la enfermedad meningocócica causada por cepas del serogrupo B y puede ser aplicada a partir de los dos meses de edad pero todavía no ha sido incluida en los calendarios de vacunación sistemática.[93]
En marzo de 2019, las comunidades autónomas y el Ministerio de Sanidad acordaron vacunar a los adolescentes de 12 años contra los meningococos de la clase A, C, W e Y, argumentando una adaptación a los cambios en los patrones de la infección en España, detectados por la Comisión de Salud Pública.[94] A pesar de la exclusión de la financiación pública de la vacuna para el meningococo B, las autoridades admitieron que un tercio de los padres la estaban financiando de su bolsillo, dada la previa liberalización de su venta.
Véase también
Notas
- Las proteínas de clase 5 se hallan expuestas en la membrana y se consideran antígenos vacunales;[6] poseen una estructura trimérica y han sido subdivididas en Opa, expresadas por N. meningitidis y N. gonorrhoeae, y Opc (5C). Su nivel de expresión es variable y tanto una como la otra muestran un alto grado de variación de fase.[7] Las proteínas de esta clase desempeñan una función importante en la adhesión de las bacterias a las células del huésped y por ende también en la invasión bacteriana de esas células.[8] Algunas Opa pueden mediar la adhesión de N. meningitidis a las células del epitelio humano en los estadios iniciales de la enfermedad y las Opc pueden intervenir en la adhesión a las células del epitelio y del endotelio.[9][10]
- El término determinante serotípico se refiere a una estructura antigénica que puede ser reconocida por ciertos anticuerpos y que como es variable entre los aislamientos de una especie dada puede ser utilizada para distinguir esos aislamientos.[18]
- Las gotitas de Pflügge (llamadas así en honor al bacteriólogo e higienista alemán Carl Pflügge) son partículas (0,1–2 mm de diámetro) de secreciones respiratorias contaminadas con patógenos expulsadas al toser que se reducen por evaporación a núcleos diminutos (de menos de 100 μm de diámetro), partículas secas que pueden permanecer en el aire durante largos períodos; este es un posible mecanismo de transmisión de la infección de una persona a otra (infección por gotitas).[54]
Referencias
- «meningitidis (Albrecht and Ghon 1901), Murray 1929.». Archivado desde el original el 23 de junio de 2016. Consultado el 16 de septiembre de 2015.
- Hitchcock P.J., Robinson E.N. (Jr.) y McGee Z.A., "Neisseriae: Gonococcus and Meningococcus", cap. 14 en Schaechter M., Medoff G. y Eisenstein B.I., Mechanisms of Microbial Disease, 2a ed., Baltimore, Williams & Wilkins, 1993., p.231.
- Jiménez Morillas F., "Meningitis meningocócica", Vacunas y viajes. Consultado en el 21 de agosto de 2015.
- Centers for Disease Control and Prevention (CDC), Meningococcal Disease, Epidemiology and Prevention of Vaccine-Preventable Diseases, 13a ed., abril de 2015.
- Martínez Motas I., Neisseria meningitidis: Contribución al transporte-conservación y caracterización de cepas aisladas en Cuba (1982-2002), tesis presentada en opción al grado científico de Doctor en Ciencias Médicas, La Habana, Cuba, 2004. Consultado en Archivado el 20 de enero de 2016 en Wayback Machine. el 20 de agosto de 2015.
- Sacchi C.T., Outerio M.C., Silva de Lemos A.P. y Bradileone M.C., "Considerations on the use of Neisseria meningitidis class 5 proteins as meningococcal vaccine components", Vaccine 1995, 13:112-118.
- Meyer T.F. y van Putten J.P.M., "Genetic mechanisms and biological implications of phase variation in pathogenic neisseriae", Clin Microbiol Rev 1989, 2 Suppl:S139-s145.
- Pujol C., Eugene E., Morand P. y Nassif X., "Do pathogenic neisseriae need several ways to modify the host cell cytoskeleton?", Microbes Infect 2000;2:821-827.
- Virji M., Makepeace K., Ferguson D.J.P., Achtman M., Sakari J. y Moxon E.R., “Expression of the Opc protein correlates with invasion of epithelial and endothelial cells by Neisseria meningitidis”, Mol Microbiol 1992, 6:2785-2795.
- Hardy S.J., Christodoulides M., Weller R.O. y Heckels J.E., "Interactions of Neisseria meningitidis with cells of the human meninges", Mol Microbiol 2000;36:817-829. DOI:10.1046/j.1365-2958.2000.01923. Resumen disponible en consultado el 26 de agosto de 2015.
- Neisseria meningitidis Archivado el 23 de noviembre de 2015 en Wayback Machine., Micromadrid, Microbiologia médica general (t. I), pp.1-5.
- Romero Cabello R., Microbiología y parasitología humana: Bases etiológicas de las enfermedades infecciosas y parasitarias, 3a ed., México, Editorial Médica Panamericana, 2007, 1802 pp. Vista previa consultada en el 29 de agosto de 2015.
- Centers for Disease Control and Prevention, Pulsed-field Gel Electrophoresis (PFGE) (en inglés), actualizado en julio de 2013. Consultado el 26 de agosto de 2015.
- Morse S.A., "Neisseria, Moraxella, Kingella and Eikenella", cap. 14 en Baron S. (ed.), Medical Microbiology, 4a ed., Galveston (TX): University of Texas Medical Branch at Galveston; 1996. Consultado en el 26 de agosto de 2015.
- Tsai C.M., Frasch C.E. y Mocca I., "Five structural classes of major outer membrane proteins in Neisseria meningitidis", J Bacteriol 1981, 146: 69-78. Consultado en el 27 de agosto de 2015.
- Hauck C.R. y Mayer T.F., "'Small talk': Opa proteins as mediators of Neisseria-host-cell communication", Curr Opin Microbiol 2003, 6:43-49. Resumen consultado en el 25 de agosto de 2015.
- Virji M., Makepeace K., Ferguson D.J., Achtman M. y Moxon E.R., "Meningococcal Opa and Opc proteins: their role in colonization and invasion of human epithelial and endothelial cells",Mol Microbiol 1993, 10(3):499-510. Resumen consultado en el 25 de agosto de 2015.
- Invene.
- Manchanda V., Gupta S. y Bhalla P., "Meningococcal disease: History, epidemiology, pathogenesis, clinical manifestations, diagnosis, antimicrobial susceptibility and prevention", Indian J Med Microbiol 2006, 24:7-19. DOI:10.4103/0255-0857.19888. Consultado el 8 de septiembre de 2015.
- Vieusseux M., "Mémoire sur la maladie qui a régné à Genève au printemps de 1805", J Med Chir Pharmacol 1805, 11:163-182.
- Stephens D.S., "Biology and pathogenesis of the evolutionarily successful, obligate human bacterium Neisseria meningitidis", Vaccine 2009, 27 (2):B71-B77. PMID:19477055, PMC:2712446, DOI:10.1016/j.vaccine.2009.04.070.
- Koneman E.W y Allen S., Koneman. Diagnóstico microbiológico, 6a ed., Buenos Aires, Editorial Médica Panamericana, 2008, 1691 pp. ISBN:978-950-06-0895-4. Consultado el 29 de agosto de 2015.
- Flexner S., The results of serum treatment in thirteen hundred cases of epidemic meningitis", J Exp Med 1913, 17:553-576.
- Jochmann G., "Versuche zur Serodiagnostik un Serotherapie der epidemischen Genickstarre", Dtsch Med Wochenschr 1906, 1:788-793.
- Rosenstein N. y Perkins B.A., Update on Haemophilus influenzae serotype b and meningococcal vaccines, Pediatr Clin North Am 2000, 47:337-352.
- Kirsch E.A., Barton R.P., Kitchen L. y Giroir B.P., "Pathophysiology, treatment and outcome of meningococcemia:a review and recent experience", Pediatr Infect Dis J 1996, 15:967-979.
- Mola S.J., Nield L.S. y Weisse M.E., "Treatment and Prevention of N. meningitidis Infection", Infect Med 2008, 25(3):128-133. Para acceder se requiere suscripción previa.
- Genco C. y Wetzler L. (eds.), Neisseria: Molecular Mechanisms of Pathogenesis, Caister Academic Press, Norfolk, Reino Unido, 2010, 270 pp. ISBN: 978-1-904455-51-6.
- Caugant D.A., "Population genetics and molecular epidemiology of Neisseria meningitidis", APMIS 1998, 106:505-525.DOI: 10.1111/j.1699-0463.1998.tb01379.x. Consultado el 11 de septiembre de 2015.
- Stephens D.S., "Uncloaking the meningococcus:dynamics of carriage and disease", Lancet 1999, 353:941-942. DOI: http://dx.doi.org/10.1016/S0140-6736(98)00279-7. Consultado el 11 de septiembre de 2015.
- Rosenstein N.E., Perkins B.A., Stephens D.S., Lefkowitz L., Cartter M.L., Danila R. et al., "The changing epidemiology of meningococcal disease in the United States, 1992-1996", J Infect Dis 1999, 180 (6):1894-1901. DOI:10.1086/315158. Consultado el 11 de septiembre de 2015.
- Connolly M. y Noah N., "Is group C meningococcal disease increasing in Europe? A report of surveillance of meningococcal infection in Europe 1993-6", Epidemiol Infect 1999, 122:41-49.
- Band J.D., Chamberland M.E., Platt T., Weaver R.E., Thornsberry C. y Fraser D.W., "Trends in meningococcal disease in the United States, 1975-1980", J Infect Dis 1983,148 (4):754-758.
- Popovic T., Sacchi C.T., Reeves M.W., Whitney A.M., Mayer L.W., Noble C.A. et al., "Neisseria meningitidis serogroup W135 isolates associated with the ET-37 complex", Emerg Infect Dis 2000, 6 (4):428-429.
- Taha M.K., Achtman M., Alonso J.M., Greenwood B., Ramsay M., Fox A. et al., "Serogroup W135 meningococcal disease in Hajj pilgrims", Lancet 2000, 356(9248):2159. PMID:11191548.
- Vogel G., "Infectious disease. Shortage of meningitis vaccine forces triage in Burkina Faso", Science 2003, 299(5612): 1499-1501. PMID:12624241. DOI: 10.1126/science.299.5612.1499a.
- Kertesz D.A., Coulthart M.B., Ryan J.A., Johnson W.M. y Ashton F.E., "Serogroup B, electrophoretic type 15 Neisseria meningitidis in Canada", J Infect Dis 1998, 177:1754-1757. Consultado el 12 de septiembre de 2015.
- Scholten R.J., Poolman J.T., Valkenburg H.A., Bijlmer H.A., Dankert J. y Caugant D.A., "Phenotypic and genotypic changes in a new clone complex of Neisseria meningitidis causing disease in The Netherlands, 1958-1990", J Infect Dis 1994, 169 (3):673-676. DOI: 10.1093/infdis/169.3.673.
- Greenwood B.M., Bradley A.K. y Wall R.A., "Meningococcal disease and season in sub-Saharan Africa", Lancet 1985;2:829-830.
- "Response to epidemic meningitis in Africa" 1997, Wkly Epidemiol Rec 1997,42:313-318.
- van Deuren M., Brandtzaeg P. y van der Meer J.W., "Update on meningococcal disease with emphasis on pathogenesis and clinical management", Clin Microbiol Rev 2000,13 (1):144-166. Consultado el 12 de septiembre de 2015.
- Schwartz B., Moore P.S. y Broome C.V., "Global Epidemiology of Meningococcal Disease", Clin Microbiol Rev 1989, 2:S118-S124. Suppl. 0893-8512/89/OSS118-07$02.00/0. Consultado el 15 de septiembre de 2015.
- Sociedad Argentina de Pediatría, Comité Nacional de Infectología.
- Piet J.R., Huis in 't Veld A.G., van Schaik D.C., van Kampen H.C., Baas F., van de Beek D. et al., "Genome Sequence of Neisseria meningitidis Serogroup B Strain H44/76▿", J Bacteriol 2011, 193 (9):2371-2372. DOI:10.1128/JB.01331-10. PMCID: PMC3133077. Consultado el 10 de septiembre de 2015.
- Tettelin H., Saunders N.J., Heidelberg J., Jeffries A.C., Nelson K.E., Eisen J.A. et al., "Complete Genome Sequence of Neisseria meningitidis Serogroup B Strain MC58", Science 2000, 287 (5459):1809-1815. DOI: 10.1126/science.287.5459.1809. Consultado el 4 de septiembre de 2015.
- Zhang, Y; Yang, J; Xu, L; Zhu, Y; Liu, B; Shao, Z; Zhang, X; Jin, Q (2014). «Complete Genome Sequence of Neisseria meningitidis Serogroup a Strain NMA510612, Isolated from a Patient with Bacterial Meningitis in China». GenomeA 2 (3): e00360-14. PMC 4014685. PMID 24812217. doi:10.1128/genomeA.00360-14.
- Davidsen T., Rødland E.A., Lagesen K., Seeberg E., Rognes T. y Tønjum T., "Biased distribution of DNA uptake sequences towards genome maintenance genes", Nucleic Acids Res 2004, 32 (3):1050-1058. DOI:10.1093/nar/gkh255. PMC: 373393. PMID: 14960717.
- Dyet K. y Moir J., "Effect of combined oxidative and nitrosative stress on Neisseria meningitidis", Biochem. Soc. Trans. 2006, 34 (Pt 1): 197-199. DOI:10.1042/BST0340197. PMID:16417521. Consultado el 5 de septiembre de 2015.
- Michod R.E., Bernstein H. y Nedelcu A.M., "Adaptive value of sex in microbial pathogens", Infect. Genet. Evol. 2008, 8 (3):267-285. DOI:10.1016/j.meegid.2008.01.002. PMID: 18295550. Consultado el 5 de septiembre de 2015.
- Quagliarello V.J. y Scheld W.M., "Bacterial meningitis: pathogenesis, pathophysiology, and progress", N Engl J Med 1992, 327:864-872.
- Gil Cebrián J., Díaz-Alersi Rosety R., Jesús Coma Mª. y Gil Bello D., "Infecciones agudas del sistema nervioso central. Meningitis bacteriana", en Principios de urgencias y emergencias y cuidados críticos. Consultado el 28 de agosto de 2015 en Archivado el 12 de septiembre de 2015 en Wayback Machine..
- Tunkel A.R., Wispelwey B., Scheld W.M., "Bacterial meningitis: recent advances in pathophysiology and treatment", Ann Intern Med 1990, 112:610-623.
- Hare R., "The Transmission of Respiratory Infections", Proc R Soc Med 1964, 57(3):221–230. PMCID:PMC1897886. Consultado el 28 de agosto de 2015.
- Cabrera C.F., Plano F.L. y Alfonzo P.A., “Meningitis. Enfoque actual en la unidad de cuidados neurointensivos”, Archivado el 18 de abril de 2016 en Wayback Machine. Revista de Posgrado de la Cátedra VIa Medicina, Facultad de Medicina - UNNE – septiembre de 2000.
- Laguna Torres V.A., “Meningitis meningocócica”, Oficina General de Epidemiología / Instituto Nacional de Salud, Lima, Perú, 1999.
- Morris J. y Schoene W., “Meningitis” en Robbins S.L. y Cotran R.S., Patología estructural y funcional, 3ª ed., Editorial Interamericana, 1987 p 1343-1405.
- Morentín B. y Fernández-Rodríguez A., "Muerte súbita por meningitis bacteriana y choque séptico: aportaciones del diagnóstico del estudio necrópsico", Enferm Infecc Microbiol Clin 2006, vol. 24., N° 7, DOI: 10.1157/13091790. Consultado el 16 de septiembre de 2015.
- Challener R.C., Morrissey A.M. y Jacobs M.R., "Postmortem diagnosis of meningococcemia by detection of capsular polysaccharides", J Forensic Sci 1988,33 (2):336-346.
- Fernández-Rodríguez A. y Morentín B., "Protocolo de actuación forense ante la sospecha de meningitis bacteriana y shock séptico fulminante", Cuad Med Forense 2005;37:7-19.
- Fernández-Rodríguez A., "Forensic microbiology: an old science, a new approach", ESCMID News 2004;2:35-37.
- Washington J.A., "Principles of Diagnosis", cap. 10 en John A., Medical Microbiology, 4a ed. Consultado en el 1 de septiembre de 2015.
- Fischer M., Hedberg K., Cardosi P., Plikaytis B.D., Hoesly F.C., Steingart K.R. et al., "Tobacco smoke as a risk factor for meningococcal disease", Pediatr Infect Dis J 1997, 16: 979-983.
- Figueroa J.E. y Densen P., "Infectious diseases associated with complement deficiencies", Clin Microbiol Rev 1991, 4: 359-395. Consultado en el 29 de agosto de 2015.
- Centers for Disease Control and Prevention. Prevention and control of meningococcal disease. "Recommendations of the Advisory Committee on Immunization Practices (ACIP) Disease", MMWR 2005, 1-21.
- Meningitis meningocócica. Organización Mundial de la Salud, Centro de Prensa, Nota descriptiva N°141, febrero de 2015.
- Goldschneider I., Gotschlich E.C. y Artenstein M.S., "Human immunity to the meningococcus. I. The role of humoral antibodies", J Exp Med 1969,129:1307-1326. Consultado el 14 de septiembre de 2015.
- Acute Management of Suspected Meningococcal Disease Clinical Pathway Archivado el 4 de marzo de 2016 en Wayback Machine., State of Queensland (Queensland Health) 2012.
- Vallés J., Ferrer R. y Fernández-Viladrich P., "Bloodstream infections including Endocarditis and Meningitis", cap. 16 en Hendrik K.F, Van Saene H.K.F., Silvestri L. y Cal M.A. (eds.), Infection Control in the Intensive Care Unit, Springer Science & Business Media, 2005, 639 pp. ISBN: 88-470-0185-4. Consultado el 29 de agosto de 2015.
- Sánchez Artola B., "Tratamiento de las infecciones graves por Neisseria meningitidis (meningococo)", Curso en Internet de sepsis grave, 2004, art. N° C11, vol. 4, N° 10. Consultado el 30 de agosto de 2015.
- Tunkel A.R., Hartman B.J., Kaplan S.L., Kaufman B.A., Roos K.L., Scheld W.M. y Whitley R.J., “Practice Guidelines for the Management of Bacterial Meningitis”, Clin Infect Dis 2004, 39 (9): 1267-1284. ISSN (versión en línea): 1537-6591. DOI: 10.1086/425368. Consultado el 2 de septiembre de 2015.
- Ryan K.J. y Ray C.G. (eds.), Sherris Medical Microbiology, 4a ed., McGraw Hill, 2004, pp. 329-333. ISBN: 0-8385-8529-9.
- Zamorano Riquelme J., Porte T.L., Peláez D.J.M. y Varela A.C., "Manifestaciones inusuales de la infección por Neisseria", Rev Chil Infect 2002, 19(3):174 -180. http://dx.doi.org/10.4067/S0716-10182002000300005. Consultado el 6 de septiembre de 2015.
- "Identification and Characterization of Neisseria meningitidis", cap. 7 en CDC, Bacterial Meningitis, Laboratory Methods for the Diagnosis of Meningitis. Consultado el 6 de septiembre de 2015.
- Coant P.N., Kornberg A.E., Duffy L.C., Dryja D.M. y Hassan S.M., "Blood culture results as determinants in the organism identification of bacterial meningitis", Pediatr Emerg Care 1992, 8:200-205. Consultado el 29 de agosto de 2015.
- Lebel M.H. y McCracken G.H. Jr., "Delayed cerebrospinal fluid sterilization and adverse outcome of bacterial meningitis in infants and children", Pediatrics 1989, 83:161-167.
- Aronin S.I. y Quagliarello V.J., "Bacterial Meningitis", Infect Med. 2003;20(3). Consultado el 29 de agosto de 2015.
- Blazer S., Berant M. y Alon U., "Bacterial meningitis. Effect of antibiotic treatment on cerebrospinal fluid", Am J Clin Pathol 1983, 80:386-387.
- Quagliarello V.J. y Scheld W.M., "Treatment of bacterial meningitis", Archivado el 5 de marzo de 2016 en Wayback Machine. New Engl J Med 1997, 336 (10).
- Talan D.A. y Zibulewsky J., "Relationship of clinical presentation to time to antibiotics for the emergency department management of suspected bacterial meningitis", Ann Emerg Med 1993, 22:1733-1738. Consultado el 29 de agosto de 2015.
- Waler J.A. y Rathore M.H., "Outpatient management of pediatric bacterial meningitis", Pediatr Infect Dis J 1995, 14 (2): 89-92. PMID: 7746713. Consultado el 3 de septiembre de 2015.
- Tice A.D., Strait K., Ramey R. y Hoaglund P.A., "Outpatient parenteral antimicrobial therapy for central nervous system infections", Clin Infect Dis 1999, 29 (6):1394-1399. Consultado el 4 de septiembre de 2015.
- Menningococcal Vaccines – What You Need to Know, , Center for Disease Control and Prevention (CDC), 2008.
- FDA approves new combination vaccine that protects children against two bacterial diseases", Administración de Alimentos y Medicamentos de los Estados Unidos (U.S. Food and Drug Administration o FDA), 14 de junio de 2012.
- "First vaccine approved by FDA to prevent serogroup B Meningococcal disease", Administración de Alimentos y Medicamentos de los Estados Unidos (U.S. Food and Drug Administration o FDA), 29 de octubre de 2014.
- Garrido P., Prat A. y Domínguez A., “Enfermedad meningocócica en España (1940-2012). Tendencias de la incidencia y evolución de los serogrupos antes y después de las campañas de vacunación”, Vacunas 2013, 14(4): 145-154.
- Gil A., Barranco D., Batalla J., Bayas J.M., Campins M., Gorrotxategi P. et al., “Prevención de la enfermedad meningocócica por el serogrupo B mediante una vacuna de 4 componentes”, Anales de Pediatría 2014, 80 (4), 273-274. DOI:10.1016/j.anpedi.2013.04.013. Consultado el 10 de septiembre de 2015.
- Nuevo listado de enfermedades de declaración obligatoria (EDO). Comité Asesor de Vacunas de la Sociedad Española de Pediatría, 7 de mayo de 2015.
- Respaldo a la vacuna para la meningitis bacteriana tipo B.El Mundo, Madrid, actualizado el 16 de noviembre de 2012.
- Descripción de la vacuna.
- «Ministerio de Sanidad, Servicios Sociales e Igualdad. Informe de utilidad terapéutica. Vacuna meningocócica del grupo B, Bexsero (5 de abril de 2013).». Archivado desde el original el 13 de enero de 2016. Consultado el 17 de septiembre de 2015.
- Gil A., Barranco D., Batalla J., Bayas J.M., Campins M., Gorrotxategi Gorrotxategi P. et al., "Prevención de la enfermedad meningocócica por el serogrupo B mediante una vacuna de cuatro componentes", Rev Pediatr Aten Primaria 2014;16:108.e55-e74.
- Vacunación frente al meningococo B. Posicionamiento del Comité Asesor de Vacunas de la Asociación Española de Pediatría, 25 de agosto de 2014.
- Benito, Emilio de (15 de marzo de 2019). «La sanidad pública añade las vacunas contra el meningococo A, W e Y». El País. ISSN 1134-6582. Consultado el 15 de marzo de 2019.