Proteína del retinoblastoma
Rb (también denominada pRB) es la proteína del retinoblastoma, una proteína supresora de tumores que se encuentra alterada en muchos tipos de cáncer,[1] entre ellos el cáncer de pulmón, melanoma, cáncer de próstata y cáncer de mama. Originalmente se detectó esta alteración en cáncer de retina, de donde deriva su nombre.
| RB1 | ||||
|---|---|---|---|---|
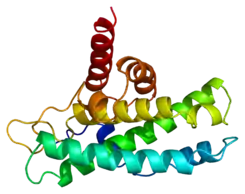 | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolos | RB1 (HGNC: 9884) ; OSRC; RB; p105-Rb; pRb; pp110 | |||
| Identificadores externos | ||||
| Locus | Cr. 13 q14.2 | |||
| Patrón de expresión de ARNm | ||||
 | ||||
 | ||||
| Más información | ||||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| Ensembl |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| RefSeq (proteína) NCBI |
| |||
| Ubicación (UCSC) |
| |||
| PubMed (Búsqueda) |
| |||
Una de las funciones principales de pRb es la inhibición de la progresión del ciclo celular antes de la entrada en mitosis, de manera que la célula no entra en división hasta que está preparada para ello y se dan las condiciones adecuadas: pRb impide por tanto la proliferación celular. Por ello, la inactivación de pRb puede suponer la aparición de un cáncer, ya que con ello se elimina un importante freno a la proliferación celular. Así por ejemplo, si una proteína oncogénica, tales como las producidas por células infectadas con los tipos de alto riesgo del virus del papiloma humano (HPV), se unen e inactivan pRb, se puede promover la aparición de cáncer cervical (entre otros).[2][3]
pRb pertenece a la familia de las proteínas pocket (bolsillo), cuyos miembros presentan un bolsillo para la unión funcional a otras proteínas. Dentro de esta familia también se encuentran las proteínas p107 y p130, que son estructural y funcionalmente similares a pRb y participan en las mismas vías de señalización, pero muestran funciones diferentes de pRb en determinados contextos.[4]
Nombre y genética
En humanos, esta proteína está codificada por el gen RB1 localizado en 13q14.1-q14.2. Si ambos alelos de este gen se encuentran mutados en un momento temprano de la vida de un individuo (durante la infancia), la proteína se inactiva y ello resulta en el desarrollo de cáncer de retina, denominado retinoblastoma, de ahí el nombre Rb. Se desconoce por qué se produce cáncer sobre todo en la retina como resultado de una mutación en un gen que es importante en todas las células del organismo.
El modelo de funcionamiento de los genes supresores de tumores fue propuesto en primer lugar por Alfred Knudson en la década de 1970, para explicar precisamente el mecanismo hereditario del retinoblastoma, una enfermedad autosómica dominante.[5][6] Knudson propuso que, en las familias afectadas por la forma hereditaria de retinoblastoma, se produce un primer evento (primer hit) en la línea germinal que inactiva uno de los dos alelos de RB1. Como el otro alelo permanecería activo, esto solo produciría una disminución del 50% en la cantidad de proteína activa, lo cual tiene un efecto despreciable. Knudson propuso entonces que debe producirse la pérdida del segundo alelo de RB1 (segundo hit) en un tejido somático para que se desarrolle un tumor en el mismo. Esto conduce a una paradoja: aunque la transmisión de la predisposición a desarrollar un tumor es dominante (porque basta un alelo mutado parta transmitir la predisposición), el desarrollo del tumor en sí mismo es recesivo (porque hacen falta dos alelos mutados para producir el tumor).
Existen dos formas de retinoblastoma: una forma bilateral (en la que aparecen tumores independientes en los dos ojos), familiar, y una forma unilateral (en la que aparece un solo tumor en uno de los ojos), esporádica.[7] Los afectados con el primer tipo tienen una probabilidad 6 veces mayor de desarrollar otros tipos de cáncer durante su vida, sobre todo osteosarcoma.[8] Esto se debe a que en las formas familiares, todos los tejidos somáticos presentan un alelo mutado, por lo que solo necesitan una segunda mutación para provocar la pérdida de función, mientras que en los casos esporádicos hacen falta dos eventos en cada tejido, lo cual ocurre con menor frecuencia. La pérdida de un alelo se puede producir de diversas maneras:[6]
- pérdida del cromosoma 13 completo;
- pérdida del cromosoma 13 normal y duplicación del 13 con el gen mutado;
- recombinación homóloga entre los dos cromosomas 13 durante mitosis;
- adquisición de una mutación independiente en el segundo alelo de RB1;
En todos los casos, excepto en la mutación independiente, se perderían además todos los marcadores genéticos localizados alrededor de RB1 (y por tanto, ligados a este gen), una situación que se denomina pérdida de heterocigosis (LOH por sus siglas en inglés, lost of heterozigosity), una condición que se observa frecuentemente en cáncer.
El gen RB1 fue clonado en 1986, uno de los primeros éxitos del método de clonaje posicional.[6] Como predecía la hipótesis de Knudson, cuando se analizaron tumores de retinoblastoma utilizando cDNA como sonda en Northern blots, se observó que había tumores en los que el ARN mensajero estaba completamente ausente, mientras que en otros se observaba un ARNm de tamaño anormal. En otros casos, el tamaño del ARNm aparecía normal, pero la secuenciación del mismo reveló la presencia de mutaciones puntuales que afectaban a la función de la proteína. En ningún caso se observaron ARNm normales de RB1 en tumores de retinoblastoma.
Se han identificado ortólogos[9] de RB1 en la mayoría de los mamíferos, para los cuales existen datos genómicos completos.
Supresión de la progresión del ciclo celular
pRb impide que células con ADN dañado progresen en el ciclo celular y repliquen su ADN, evitando así que se perpetúen los daños producidos. En concreto, pRb detiene el ciclo celular entre G1 (intervalo 1) y S (fase de síntesis).[10] Para realizar esta función, pRb se une e inhibe factores de transcripción de la familia E2F, que están compuestos de dímeros de una proteína E2F y una proteína DP (por dimerization partner).[11] Los complejos E2F-DP son capaces de activar la transcripción de una serie de genes que inducen la entrada de la célula en fase S.[12][13] Mientras E2F-DP permanece inactivo, la célula permanece estancada en la fase G1. Cuando pRb se une a E2F, el complejo se inactiva, de forma que pRb funciona como un supresor de la proliferación celular, al inhibir la progresión a través del ciclo celular.[14][2] El complejo pRb-E2F/DP también produce la unión de una histona deacetilasa (HDAC) a la cromatina, lo cual disminuye la transcripción de factores que promueven la entrada en fase S, amplificando así la inhibición de la síntesis de ADN.
El gen RB que es el encargado de sintetizar la proteína Rbp (proteína de retinoblastoma) juega un papel fundamental en el proceso de la senescencia
Activación e inactivación
pRb puede encontrarse en dos estados: hipofosforilado e hiperfosforilado. En el estado hipofosforilado, pRb es activo, y puede realizar su función de supresor de tumores, uniéndose a E2F-DP y bloqueando la progresión de la célula a través del ciclo celular.
Cuando se precisa que la célula se divida, complejos de kinasas dependientes de ciclinas (CDK) y ciclinas fosforilan pRB, inhibiendo su actividad,[14][2]<ref), la fosfatasa PP1 defosforila pRb, devolviéndolo a su estado hipofosforilado y activándolo,[2][15] para evitar que la célula entre en un nuevo proceso de división.
Otras funciones de pRB
Además de inhibir la proliferación celular mediante la inhibición de E2F-DP durante la fase G1, hoy se conoce que pRb realiza otras muchas funciones, que incluyen el control de la diferenciación celular durante la embriogénesis y en tejidos adultos, la regulación de la muerte celular por apoptosis, mantenimiento de las células en un estado permanente de parada en el ciclo y preservación de la estabilidad cromosómica.[16] En la actualidad, pRb se considera como un co-regulador de la transcripción, que puede unirse a muchos factores de transcripción y potenciar o antagonizar la acción de estos. Además, pRb es una proteína adaptadora que recluta enzimas remodeladoras de la cromatina para controlar la expresión de genes específicos y para modificar la estructura de la cromatina a nivel cromosómico.
Interacciones

Se han identificado interacciones de pRb con las siguientes proteínas:
- ADN polimerasa α1[17]
- LIN9[18]
- CUTL1[19]
- E2F2[20]
- Ciclina T2[21]
- RBBP8[22][23]
- E2F1[24][25][26][27][28][29][30]
- RBBP7[31][32]
- PRDM2[33]
- ARID4A[34]
- MRFAP1[35][25]
- RBBP4[24][32][36]
- JARID1A[37][38]
- BRF1[39][40]
- BRCA1[41][42][31]
- Gen Abl[43][44]
- c-Raf[45][46]
- Ciclina A1[47]
- MORF4L1[35][25]
- Ciclina D1[48][49]
- Prohibitina[46][50]
- E4F1[27]
- Receptor de aril hidrocarbonos[51]
- DNMT1[52]
- HDAC3[53][34]
- FRK[54]
- Inhibidor 2 del activador de plasminógeno[55]
- SUV39H1[56][57]
- NCOA6[58]
- SNAPC1[59]
- THOC1[60]
- HDAC1[22][61][62][63][64][34][65]
- HDAC2[34]
- SNAPC3[59]
- PA2G4[66]
- SNW1[67]
- Receptor androgénico[68][69]
- RBBP9[70]
- ENC1[71]
- MCM7[72]
- PIK3R3[73]
- TRAP1[74]
- Cdk9[21]
- TAF1[48][75][76][77]
- PRKRA[78]
- UBTF[79]
- EID1[80][81]
- AATF[82][83]
- TRIP11[84]
- PPARG[53]
- MyoD[85][86]
- USP4[87]
- c-Jun[88]
- Proteína de la leucemia promielocítica[89]
- HBP1[90]
Véase también
- p53 - implicada en la función de apoyo a la reparación del ADN de pRb.
- Retinoblastoma.
Referencias
- Murphree AL, Benedict WF (March de 1984). «Retinoblastoma: clues to human oncogenesis». Science 223 (4640): 1028-33. PMID 6320372. doi:10.1126/science.6320372.
- Münger K, Howley PM (November de 2002). «Human papillomavirus immortalization and transformation functions». Virus Res. 89 (2): 213-28. PMID 12445661. doi:10.1016/S0168-1702(02)00190-9. Archivado desde el original el 24 de agosto de 2010. Consultado el 19 de enero de 2010.
- Funk J.O., Waga S., Harry J.B., Espling E., Stillman B., and Galloway D.A. (1997). «Inhibition of CDK activity and PCNA-dependent DNA replication by p21 is blocked by interaction with the HPV-16 E7 oncoprotein». Trends in Genetics 13 (12): 474. doi:10.1016/0168-9525(97)90029-9.
- Cobrinik, D. (2005). «Pocket proteins and cell cycle control». Oncogene 24 (17): 2796-2809.
- Knudson AG (April de 1971). «Mutation and cancer: statistical study of retinoblastoma». Proc. Natl. Acad. Sci. U.S.A. 68 (4): 820-3. PMC 389051. doi:10.1073/pnas.68.4.820.
- Gelehrter, T.; et al. (1998). Principles of Medical Genetics (2nd edición). Baltimore: Williams et Wilkins.
- Alberts et al (2004). «Biología molecular de la célula». Barcelona: Omega. ISBN 54-282-1351-8.
- Kleinerman RA, Tucker MA, Tarone RE, et al. (April de 2005). «Risk of new cancers after radiotherapy in long-term survivors of retinoblastoma: an extended follow-up». J. Clin. Oncol. 23 (10): 2272-9. PMID 15800318. doi:10.1200/JCO.2005.05.054.
- «OrthoMaM phylogenetic marker: RB1 coding sequence». Archivado desde el original el 24 de septiembre de 2015. Consultado el 19 de enero de 2010.
- Das SK, Hashimoto T, Shimizu K, et al. (November de 2005). «Fucoxanthin induces cell cycle arrest at G0/G1 phase in human colon carcinoma cells through up-regulation of p21WAF1/Cip1». Biochim. Biophys. Acta 1726 (3): 328-35. PMID 16236452. doi:10.1016/j.bbagen.2005.09.007.
- Wu CL, Zukerberg LR, Ngwu C, Harlow E, Lees JA (May de 1995). «In vivo association of E2F and DP family proteins». Mol. Cell. Biol. 15 (5): 2536-46. PMC 230484. PMID 7739537.
- De Veylder L, Joubès J, Inzé D (December de 2003). «Plant cell cycle transitions». Curr. Opin. Plant Biol. 6 (6): 536-43. PMID 14611951. doi:10.1016/j.pbi.2003.09.001. Archivado desde el original el 4 de junio de 2008. Consultado el 19 de enero de 2010.
- de Jager SM, Maughan S, Dewitte W, Scofield S, Murray JA (June de 2005). «The developmental context of cell-cycle control in plants». Semin. Cell Dev. Biol. 16 (3): 385-96. PMID 15840447. doi:10.1016/j.semcdb.2005.02.004.
- Korenjak M, Brehm A (October de 2005). «E2F-Rb complexes regulating transcription of genes important for differentiation and development». Curr. Opin. Genet. Dev. 15 (5): 520-7. PMID 16081278. doi:10.1016/j.gde.2005.07.001. Archivado desde el original el 4 de junio de 2008. Consultado el 19 de enero de 2010.
- Vietri M, Bianchi M, Ludlow JW, Mittnacht S, Villa-Moruzzi E (2006). «Direct interaction between the catalytic subunit of Protein Phosphatase 1 and pRb». Cancer Cell Int. 6: 3. PMC 1382259. PMID 16466572. doi:10.1186/1475-2867-6-3.
- Burkhart D.L.; Sage, J. (2008), «Cellular mechanisms of tumour suppression by retinoblastoma gene», Nat Rev Cancer 8: 675-682.
- Takemura, M; Kitagawa T; Izuta S; Wasa J; Takai A; Akiyama T; Yoshida S (Nov. de 1997). «Phosphorylated retinoblastoma protein stimulates DNA polymerase alpha». Oncogene (ENGLAND) 15 (20): 2483-92. ISSN 0950-9232. PMID 9395244. doi:10.1038/sj.onc.1201431.
- Gagrica, Sladjana; Hauser Stefanie, Kolfschoten Ingrid, Osterloh Lisa, Agami Reuven, Gaubatz Stefan (Nov. de 2004). «Inhibition of oncogenic transformation by mammalian Lin-9, a pRB-associated protein». EMBO J. (England) 23 (23): 4627-38. ISSN 0261-4189. PMID 15538385. doi:10.1038/sj.emboj.7600470.
- Gupta, Sunita; Luong Mai X, Bleuming Sylvia A, Miele Angela, Luong Michael, Young Daniel, Knudsen Erik S, Van Wijnen Andre J, Stein Janet L, Stein Gary S (Sep. de 2003). «Tumor suppressor pRB functions as a co-repressor of the CCAAT displacement protein (CDP/cut) to regulate cell cycle controlled histone H4 transcription». J. Cell. Physiol. (United States) 196 (3): 541-56. ISSN 0021-9541. PMID 12891711. doi:10.1002/jcp.10335.
- Lee, Changwook; Chang Jeong Ho, Lee Hyun Sook, Cho Yunje (Dec. de 2002). «Structural basis for the recognition of the E2F transactivation domain by the retinoblastoma tumor suppressor». Genes Dev. (United States) 16 (24): 3199-212. ISSN 0890-9369. PMID 12502741. doi:10.1101/gad.1046102.
- Simone, Cristiano; Bagella Luigi, Bellan Cristiana, Giordano Antonio (Jun. de 2002). «Physical interaction between pRb and cdk9/cyclinT2 complex». Oncogene (England) 21 (26): 4158-65. ISSN 0950-9232. PMID 12037672. doi:10.1038/sj.onc.1205511.
- Dick, F A; Sailhamer E, Dyson N J (May. de 2000). «Mutagenesis of the pRB pocket reveals that cell cycle arrest functions are separable from binding to viral oncoproteins». Mol. Cell. Biol. (UNITED STATES) 20 (10): 3715-27. ISSN 0270-7306. PMID 10779361.
- Fusco, C; Reymond A, Zervos A S (Aug. de 1998). «Molecular cloning and characterization of a novel retinoblastoma-binding protein». Genomics (UNITED STATES) 51 (3): 351-8. ISSN 0888-7543. PMID 9721205. doi:10.1006/geno.1998.5368.
- Nicolas, E; Ait-Si-Ali S, Trouche D (Aug. de 2001). «The histone deacetylase HDAC3 targets RbAp48 to the retinoblastoma protein». Nucleic Acids Res. (England) 29 (15): 3131-6. PMID 11470869.
- Pardo, Patricia S; Leung James K, Lucchesi John C, Pereira-Smith Olivia M (Dec. de 2002). «MRG15, a novel chromodomain protein, is present in two distinct multiprotein complexes involved in transcriptional activation». J. Biol. Chem. (United States) 277 (52): 50860-6. ISSN 0021-9258. PMID 12397079. doi:10.1074/jbc.M203839200.
- Choubey, D; Li S J, Datta B, Gutterman J U, Lengyel P (Oct. de 1996). «Inhibition of E2F-mediated transcription by p202». EMBO J. (ENGLAND) 15 (20): 5668-78. ISSN 0261-4189. PMID 8896460.
- Fajas, L; Paul C, Zugasti O, Le Cam L, Polanowska J, Fabbrizio E, Medema R, Vignais M L, Sardet C (Jul. de 2000). «pRB binds to and modulates the transrepressing activity of the E1A-regulated transcription factor p120E4F». Proc. Natl. Acad. Sci. U.S.A. (UNITED STATES) 97 (14): 7738-43. ISSN 0027-8424. PMID 10869426. doi:10.1073/pnas.130198397.
- Dyson, N; Dembski M; Fattaey A; Ngwu C; Ewen M; Helin K (Dec. de 1993). «Analysis of p107-associated proteins: p107 associates with a form of E2F that differs from pRB-associated E2F-1». J. Virol. (UNITED STATES) 67 (12): 7641-7. ISSN 0022-538X. PMID 8230483.
- Wu, C L; Zukerberg L R, Ngwu C, Harlow E, Lees J A (May. de 1995). «In vivo association of E2F and DP family proteins». Mol. Cell. Biol. (UNITED STATES) 15 (5): 2536-46. ISSN 0270-7306. PMID 7739537.
- Taniura, H; Taniguchi N; Hara M; Yoshikawa K (Jan. de 1998). «Necdin, a postmitotic neuron-specific growth suppressor, interacts with viral transforming proteins and cellular transcription factor E2F1». J. Biol. Chem. (UNITED STATES) 273 (2): 720-8. ISSN 0021-9258. PMID 9422723.
- Yarden, R I; Brody L C (Apr. de 1999). «BRCA1 interacts with components of the histone deacetylase complex». Proc. Natl. Acad. Sci. U.S.A. (UNITED STATES) 96 (9): 4983-8. ISSN 0027-8424. PMID 10220405.
- Qian, Y W; Lee E Y (Oct. de 1995). «Dual retinoblastoma-binding proteins with properties related to a negative regulator of ras in yeast». J. Biol. Chem. (UNITED STATES) 270 (43): 25507-13. ISSN 0021-9258. PMID 7503932.
- Buyse, I M; Shao G; Huang S (May. de 1995). «The retinoblastoma protein binds to RIZ, a zinc-finger protein that shares an epitope with the adenovirus E1A protein». Proc. Natl. Acad. Sci. U.S.A. (UNITED STATES) 92 (10): 4467-71. ISSN 0027-8424. PMID 7538672.
- Lai, A; Lee J M, Yang W M, DeCaprio J A, Kaelin W G, Seto E, Branton P E (Oct. de 1999). «RBP1 recruits both histone deacetylase-dependent and -independent repression activities to retinoblastoma family proteins». Mol. Cell. Biol. (UNITED STATES) 19 (10): 6632-41. ISSN 0270-7306. PMID 10490602.
- Leung, J K; Berube N, Venable S, Ahmed S, Timchenko N, Pereira-Smith O M (Oct. de 2001). «MRG15 activates the B-myb promoter through formation of a nuclear complex with the retinoblastoma protein and the novel protein PAM14». J. Biol. Chem. (United States) 276 (42): 39171-8. ISSN 0021-9258. PMID 11500496. doi:10.1074/jbc.M103435200.
- Nicolas, E; Morales V, Magnaghi-Jaulin L, Harel-Bellan A, Richard-Foy H, Trouche D (Mar. de 2000). «RbAp48 belongs to the histone deacetylase complex that associates with the retinoblastoma protein». J. Biol. Chem. (UNITED STATES) 275 (13): 9797-804. ISSN 0021-9258. PMID 10734134.
- Chan, S W; Hong W (Jul. de 2001). «Retinoblastoma-binding protein 2 (Rbp2) potentiates nuclear hormone receptor-mediated transcription». J. Biol. Chem. (United States) 276 (30): 28402-12. ISSN 0021-9258. PMID 11358960. doi:10.1074/jbc.M100313200.
- Kim, Y W; Otterson G A, Kratzke R A, Coxon A B, Kaye F J (Nov. de 1994). «Differential specificity for binding of retinoblastoma binding protein 2 to RB, p107, and TATA-binding protein». Mol. Cell. Biol. (UNITED STATES) 14 (11): 7256-64. ISSN 0270-7306. PMID 7935440.
- Johnston, Imogen M; Allison Simon J, Morton Jennifer P, Schramm Laura, Scott Pamela H, White Robert J (Jun. de 2002). «CK2 forms a stable complex with TFIIIB and activates RNA polymerase III transcription in human cells». Mol. Cell. Biol. (United States) 22 (11): 3757-68. ISSN 0270-7306. PMID 11997511.
- Sutcliffe, J E; Cairns C A, McLees A, Allison S J, Tosh K, White R J (Jun. de 1999). «RNA polymerase III transcription factor IIIB is a target for repression by pocket proteins p107 and p130». Mol. Cell. Biol. (UNITED STATES) 19 (6): 4255-61. ISSN 0270-7306. PMID 10330166.
- Aprelikova, O N; Fang B S, Meissner E G, Cotter S, Campbell M, Kuthiala A, Bessho M, Jensen R A, Liu E T (Oct. de 1999). «BRCA1-associated growth arrest is RB-dependent». Proc. Natl. Acad. Sci. U.S.A. (UNITED STATES) 96 (21): 11866-71. ISSN 0027-8424. PMID 10518542.
- Fan, S; Yuan R, Ma Y X, Xiong J, Meng Q, Erdos M, Zhao J N, Goldberg I D, Pestell R G, Rosen E M (Aug. de 2001). «Disruption of BRCA1 LXCXE motif alters BRCA1 functional activity and regulation of RB family but not RB protein binding». Oncogene (England) 20 (35): 4827-41. ISSN 0950-9232. PMID 11521194. doi:10.1038/sj.onc.1204666.
- Miyamura, T; Nishimura J; Yufu Y; Nawata H (Feb. de 1997). «Interaction of BCR-ABL with the retinoblastoma protein in Philadelphia chromosome-positive cell lines». Int. J. Hematol. (IRELAND) 65 (2): 115-21. ISSN 0925-5710. PMID 9071815.
- Welch, P J; Wang J Y (Nov. de 1993). «A C-terminal protein-binding domain in the retinoblastoma protein regulates nuclear c-Abl tyrosine kinase in the cell cycle». Cell (UNITED STATES) 75 (4): 779-90. ISSN 0092-8674. PMID 8242749.
- Wang, S; Ghosh R N, Chellappan S P (Dec. de 1998). «Raf-1 physically interacts with Rb and regulates its function: a link between mitogenic signaling and cell cycle regulation». Mol. Cell. Biol. (UNITED STATES) 18 (12): 7487-98. ISSN 0270-7306. PMID 9819434.
- Wang, S; Nath N; Fusaro G; Chellappan S (Nov. de 1999). «Rb and prohibitin target distinct regions of E2F1 for repression and respond to different upstream signals». Mol. Cell. Biol. (UNITED STATES) 19 (11): 7447-60. ISSN 0270-7306. PMID 10523633.
- Yang, R; Müller C, Huynh V, Fung Y K, Yee A S, Koeffler H P (Mar. de 1999). «Functions of cyclin A1 in the cell cycle and its interactions with transcription factor E2F-1 and the Rb family of proteins». Mol. Cell. Biol. (UNITED STATES) 19 (3): 2400-7. ISSN 0270-7306. PMID 10022926.
- Siegert, J L; Rushton J J, Sellers W R, Kaelin W G, Robbins P D (Nov. de 2000). «Cyclin D1 suppresses retinoblastoma protein-mediated inhibition of TAFII250 kinase activity». Oncogene (England) 19 (50): 5703-11. ISSN 0950-9232. PMID 11126356. doi:10.1038/sj.onc.1203966.
- Dowdy, S F; Hinds P W, Louie K, Reed S I, Arnold A, Weinberg R A (May. de 1993). «Physical interaction of the retinoblastoma protein with human D cyclins». Cell (UNITED STATES) 73 (3): 499-511. ISSN 0092-8674. PMID 8490963.
- Wang, S; Nath N; Adlam M; Chellappan S (Jun. de 1999). «Prohibitin, a potential tumor suppressor, interacts with RB and regulates E2F function». Oncogene (ENGLAND) 18 (23): 3501-10. ISSN 0950-9232. PMID 10376528. doi:10.1038/sj.onc.1202684.
- Ge, N L; Elferink C J (Aug. de 1998). «A direct interaction between the aryl hydrocarbon receptor and retinoblastoma protein. Linking dioxin signaling to the cell cycle». J. Biol. Chem. (UNITED STATES) 273 (35): 22708-13. ISSN 0021-9258. PMID 9712901.
- Robertson, K D; Ait-Si-Ali S, Yokochi T, Wade P A, Jones P L, Wolffe A P (Jul. de 2000). «DNMT1 forms a complex with Rb, E2F1 and HDAC1 and represses transcription from E2F-responsive promoters». Nat. Genet. (UNITED STATES) 25 (3): 338-42. ISSN 1061-4036. PMID 10888886. doi:10.1038/77124.
- Fajas, Lluis; Egler Viviane, Reiter Raphael, Hansen Jacob, Kristiansen Karsten, Debril Marie-Bernard, Miard Stéphanie, Auwerx Johan (Dec. de 2002). «The retinoblastoma-histone deacetylase 3 complex inhibits PPARgamma and adipocyte differentiation». Dev. Cell (United States) 3 (6): 903-10. ISSN 1534-5807. PMID 12479814.
- Craven, R J; Cance W G, Liu E T (Sep. de 1995). «The nuclear tyrosine kinase Rak associates with the retinoblastoma protein pRb». Cancer Res. (UNITED STATES) 55 (18): 3969-72. ISSN 0008-5472. PMID 7664264.
- Darnell, Grant A; Antalis Toni M, Johnstone Ricky W, Stringer Brett W, Ogbourne Steven M, Harrich David, Suhrbier Andreas (Sep. de 2003). «Inhibition of retinoblastoma protein degradation by interaction with the serpin plasminogen activator inhibitor 2 via a novel consensus motif». Mol. Cell. Biol. (United States) 23 (18): 6520-32. ISSN 0270-7306. PMID 12944478.
- Nielsen, S J; Schneider R, Bauer U M, Bannister A J, Morrison A, O'Carroll D, Firestein R, Cleary M, Jenuwein T, Herrera R E, Kouzarides T (Aug. de 2001). «Rb targets histone H3 methylation and HP1 to promoters». Nature (England) 412 (6846): 561-5. ISSN 0028-0836. PMID 11484034. doi:10.1038/35087620.
- Vandel, L; Nicolas E, Vaute O, Ferreira R, Ait-Si-Ali S, Trouche D (Oct. de 2001). «Transcriptional repression by the retinoblastoma protein through the recruitment of a histone methyltransferase». Mol. Cell. Biol. (United States) 21 (19): 6484-94. ISSN 0270-7306. PMID 11533237.
- Goo, Young-Hwa; Na Soon-Young, Zhang Hao, Xu Jianming, Hong SunHwa, Cheong JaeHun, Lee Soo-Kyung, Lee Jae Woon (Feb. de 2004). «Interactions between activating signal cointegrator-2 and the tumor suppressor retinoblastoma in androgen receptor transactivation». J. Biol. Chem. (United States) 279 (8): 7131-5. ISSN 0021-9258. PMID 14645241. doi:10.1074/jbc.M312563200.
- Hirsch, H A; Gu L, Henry R W (Dec. de 2000). «The retinoblastoma tumor suppressor protein targets distinct general transcription factors to regulate RNA polymerase III gene expression». Mol. Cell. Biol. (UNITED STATES) 20 (24): 9182-91. ISSN 0270-7306. PMID 11094070.
- Durfee, T; Mancini M A, Jones D, Elledge S J, Lee W H (Nov. de 1994). «The amino-terminal region of the retinoblastoma gene product binds a novel nuclear matrix protein that co-localizes to centers for RNA processing». J. Cell Biol. (UNITED STATES) 127 (3): 609-22. ISSN 0021-9525. PMID 7525595.
- Fuks, F; Burgers W A, Brehm A, Hughes-Davies L, Kouzarides T (Jan. de 2000). «DNA methyltransferase Dnmt1 associates with histone deacetylase activity». Nat. Genet. (UNITED STATES) 24 (1): 88-91. ISSN 1061-4036. PMID 10615135. doi:10.1038/71750.
- Puri, P L; Iezzi S, Stiegler P, Chen T T, Schiltz R L, Muscat G E, Giordano A, Kedes L, Wang J Y, Sartorelli V (Oct. de 2001). «Class I histone deacetylases sequentially interact with MyoD and pRb during skeletal myogenesis». Mol. Cell (United States) 8 (4): 885-97. ISSN 1097-2765. PMID 12479798.
- Wang, Sheng; Fusaro Gina, Padmanabhan Jaya, Chellappan Srikumar P (Dec. de 2002). «Prohibitin co-localizes with Rb in the nucleus and recruits N-CoR and HDAC1 for transcriptional repression». Oncogene (England) 21 (55): 8388-96. ISSN 0950-9232. PMID 12466959. doi:10.1038/sj.onc.1205944.
- Luo, R X; Postigo A A, Dean D C (Feb. de 1998). «Rb interacts with histone deacetylase to repress transcription». Cell (UNITED STATES) 92 (4): 463-73. ISSN 0092-8674. PMID 9491888.
- Ferreira, R; Magnaghi-Jaulin L, Robin P, Harel-Bellan A, Trouche D (Sep. de 1998). «The three members of the pocket proteins family share the ability to repress E2F activity through recruitment of a histone deacetylase». Proc. Natl. Acad. Sci. U.S.A. (UNITED STATES) 95 (18): 10493-8. ISSN 0027-8424. PMID 9724731.
- Xia, X; Cheng A, Lessor T, Zhang Y, Hamburger A W (May. de 2001). «Ebp1, an ErbB-3 binding protein, interacts with Rb and affects Rb transcriptional regulation». J. Cell. Physiol. (United States) 187 (2): 209-17. ISSN 0021-9541. PMID 11268000. doi:10.1002/jcp.1075.
- Prathapam, Tulasiram; Kühne Christian, Banks Lawrence (Dec. de 2002). «Skip interacts with the retinoblastoma tumor suppressor and inhibits its transcriptional repression activity». Nucleic Acids Res. (England) 30 (23): 5261-8. PMID 12466551.
- Lu, J; Danielsen M (Nov. de 1998). «Differential regulation of androgen and glucocorticoid receptors by retinoblastoma protein». J. Biol. Chem. (UNITED STATES) 273 (47): 31528-33. ISSN 0021-9258. PMID 9813067.
- Yeh, S; Miyamoto H; Nishimura K; Kang H; Ludlow J; Hsiao P; Wang C; Su C et al. (Jul. de 1998). «Retinoblastoma, a tumor suppressor, is a coactivator for the androgen receptor in human prostate cancer DU145 cells». Biochem. Biophys. Res. Commun. (UNITED STATES) 248 (2): 361-7. ISSN 0006-291X. PMID 9675141. doi:10.1006/bbrc.1998.8974.
- Woitach, J T; Zhang M, Niu C H, Thorgeirsson S S (Aug. de 1998). «A retinoblastoma-binding protein that affects cell-cycle control and confers transforming ability». Nat. Genet. (UNITED STATES) 19 (4): 371-4. ISSN 1061-4036. PMID 9697699. doi:10.1038/1258.
- Kim, T A; Lim J; Ota S; Raja S; Rogers R; Rivnay B; Avraham H; Avraham S (May. de 1998). «NRP/B, a novel nuclear matrix protein, associates with p110(RB) and is involved in neuronal differentiation». J. Cell Biol. (UNITED STATES) 141 (3): 553-66. ISSN 0021-9525. PMID 9566959.
- Sterner, J M; Dew-Knight S, Musahl C, Kornbluth S, Horowitz J M (May. de 1998). «Negative regulation of DNA replication by the retinoblastoma protein is mediated by its association with MCM7». Mol. Cell. Biol. (UNITED STATES) 18 (5): 2748-57. ISSN 0270-7306. PMID 9566894.
- Xia, Xianmin; Cheng Aiwu, Akinmade Damilola, Hamburger Anne W (Mar. de 2003). «The N-terminal 24 amino acids of the p55 gamma regulatory subunit of phosphoinositide 3-kinase binds Rb and induces cell cycle arrest». Mol. Cell. Biol. (United States) 23 (5): 1717-25. ISSN 0270-7306. PMID 12588990.
- Chen, C F; Chen Y, Dai K, Chen P L, Riley D J, Lee W H (Sep. de 1996). «A new member of the hsp90 family of molecular chaperones interacts with the retinoblastoma protein during mitosis and after heat shock». Mol. Cell. Biol. (UNITED STATES) 16 (9): 4691-9. ISSN 0270-7306. PMID 8756626.
- Shao, Z; Ruppert S, Robbins P D (Apr. de 1995). «The retinoblastoma-susceptibility gene product binds directly to the human TATA-binding protein-associated factor TAFII250». Proc. Natl. Acad. Sci. U.S.A. (UNITED STATES) 92 (8): 3115-9. ISSN 0027-8424. PMID 7724524.
- Siegert, J L; Robbins P D (Jan. de 1999). «Rb inhibits the intrinsic kinase activity of TATA-binding protein-associated factor TAFII250». Mol. Cell. Biol. (UNITED STATES) 19 (1): 846-54. ISSN 0270-7306. PMID 9858607.
- Shao, Z; Siegert J L, Ruppert S, Robbins P D (Jul. de 1997). «Rb interacts with TAF(II)250/TFIID through multiple domains». Oncogene (ENGLAND) 15 (4): 385-92. ISSN 0950-9232. PMID 9242374. doi:10.1038/sj.onc.1201204.
- Simons, A; Melamed-Bessudo C, Wolkowicz R, Sperling J, Sperling R, Eisenbach L, Rotter V (Jan. de 1997). «PACT: cloning and characterization of a cellular p53 binding protein that interacts with Rb». Oncogene (ENGLAND) 14 (2): 145-55. ISSN 0950-9232. PMID 9010216. doi:10.1038/sj.onc.1200825.
- Hannan, K M; Hannan R D, Smith S D, Jefferson L S, Lun M, Rothblum L I (Oct. de 2000). «Rb and p130 regulate RNA polymerase I transcription: Rb disrupts the interaction between UBF and SL-1». Oncogene (ENGLAND) 19 (43): 4988-99. ISSN 0950-9232. PMID 11042686. doi:10.1038/sj.onc.1203875.
- Miyake, S; Sellers W R, Safran M, Li X, Zhao W, Grossman S R, Gan J, DeCaprio J A, Adams P D, Kaelin W G (Dec. de 2000). «Cells degrade a novel inhibitor of differentiation with E1A-like properties upon exiting the cell cycle». Mol. Cell. Biol. (UNITED STATES) 20 (23): 8889-902. ISSN 0270-7306. PMID 11073989.
- MacLellan, W R; Xiao G, Abdellatif M, Schneider M D (Dec. de 2000). «A novel Rb- and p300-binding protein inhibits transactivation by MyoD». Mol. Cell. Biol. (UNITED STATES) 20 (23): 8903-15. ISSN 0270-7306. PMID 11073990.
- Bruno, Tiziana; De Angelis Roberta, De Nicola Francesca, Barbato Christian, Di Padova Monica, Corbi Nicoletta, Libri Valentina, Benassi Barbara, Mattei Elisabetta, Chersi Alberto, Soddu Silvia, Floridi Aristide, Passananti Claudio, Fanciulli Maurizio (Nov. de 2002). «Che-1 affects cell growth by interfering with the recruitment of HDAC1 by Rb». Cancer Cell (United States) 2 (5): 387-99. ISSN 1535-6108. PMID 12450794.
- Fanciulli, M; Bruno T, Di Padova M, De Angelis R, Iezzi S, Iacobini C, Floridi A, Passananti C (May. de 2000). «Identification of a novel partner of RNA polymerase II subunit 11, Che-1, which interacts with and affects the growth suppression function of Rb». FASEB J. (UNITED STATES) 14 (7): 904-12. ISSN 0892-6638. PMID 10783144.
- Chang, K H; Chen Y, Chen T T, Chou W H, Chen P L, Ma Y Y, Yang-Feng T L, Leng X, Tsai M J, O'Malley B W, Lee W H (Aug. de 1997). «A thyroid hormone receptor coactivator negatively regulated by the retinoblastoma protein». Proc. Natl. Acad. Sci. U.S.A. (UNITED STATES) 94 (17): 9040-5. ISSN 0027-8424. PMID 9256431.
- Mal, A; Sturniolo M, Schiltz R L, Ghosh M K, Harter M L (Apr. de 2001). «A role for histone deacetylase HDAC1 in modulating the transcriptional activity of MyoD: inhibition of the myogenic program». EMBO J. (England) 20 (7): 1739-53. ISSN 0261-4189. PMID 11285237. doi:10.1093/emboj/20.7.1739.
- Gu, W; Schneider J W, Condorelli G, Kaushal S, Mahdavi V, Nadal-Ginard B (Feb. de 1993). «Interaction of myogenic factors and the retinoblastoma protein mediates muscle cell commitment and differentiation». Cell (UNITED STATES) 72 (3): 309-24. ISSN 0092-8674. PMID 8381715.
- Blanchette, P; Gilchrist C A, Baker R T, Gray D A (Sep. de 2001). «Association of UNP, a ubiquitin-specific protease, with the pocket proteins pRb, p107 and p130». Oncogene (England) 20 (39): 5533-7. ISSN 0950-9232. PMID 11571651. doi:10.1038/sj.onc.1204823.
- Nishitani, J; Nishinaka T, Cheng C H, Rong W, Yokoyama K K, Chiu R (Feb. de 1999). «Recruitment of the retinoblastoma protein to c-Jun enhances transcription activity mediated through the AP-1 binding site». J. Biol. Chem. (UNITED STATES) 274 (9): 5454-61. ISSN 0021-9258. PMID 10026157.
- Alcalay, M; Tomassoni L, Colombo E, Stoldt S, Grignani F, Fagioli M, Szekely L, Helin K, Pelicci P G (Feb. de 1998). «The promyelocytic leukemia gene product (PML) forms stable complexes with the retinoblastoma protein». Mol. Cell. Biol. (UNITED STATES) 18 (2): 1084-93. ISSN 0270-7306. PMID 9448006.
- Lavender, P; Vanandel L, Bannister A J, Kouzarides T (Jun. de 1997). «The HMG-box transcription factor HBP1 is targeted by the pocket proteins and E1A». Oncogene (ENGLAND) 14 (22): 2721-8. ISSN 0950-9232. PMID 9178770. doi:10.1038/sj.onc.1201243.
Enlaces externos
- MeSH: Retinoblastoma+genes (en inglés)
- Genética del Retinoblastoma