Vía del mevalonato
La vía del mevalonato, conocida también como ruta del mevalonato, vía isoprenoide o vía de la HMG-CoA reductasa es una vía metabólica esencial presente en eucariotas, archaeas, y algunas bacterias.[1] Esta vía produce dos bloques de construcción de cinco carbonos llamados respectivamente pirofosfato de isopentenilo (IPP) y pirofosfato de dimetilalilo (DMAPP), los cuales son utilizados por los organismos para fabricar isoprenoides, una clase diversa de biomoléculas con más de 30 000 exponentes, entre los que se encuentran por ejemplo el colesterol, el grupo hemo, la vitamina K, la coenzima Q10 y todas las hormonas esteroideas.[2]
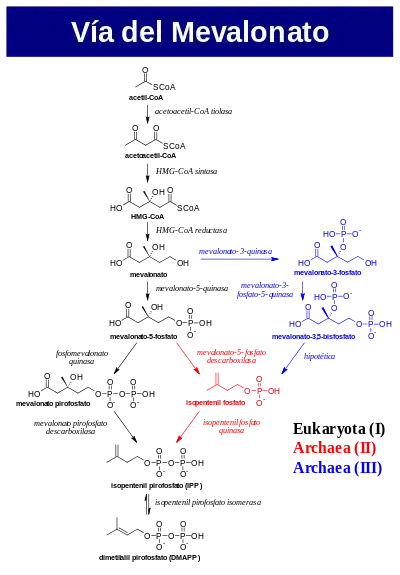
La vía del mevalonato comienza con acetil-CoA y desemboca en la producción de IPP y DMAPP.[3] Se conoce muy bien como diana de los fármacos conocidos como estatinas, los cuales se utilizan para disminuir los niveles de colesterol en plasma. El fármaco Lipitor (atorvastatina), inhibe a la enzíma HMG-CoA reductasa que pertenece a la vía del mevalonato.
Vía del mevalonato superior
Tanto la vía del mevalonato de los eucariotas, como de las arqueas y bacterias comienzan de la misma forma. La única fuente de carbono que alimenta a esta vía es el acetil-CoA. El primer paso de la vía condensa dos moléculas de acetil-CoA para formar acetoacetil-CoA, reacción catalizada por la enzima acetoacetil-CoA tiolasa. Una segunda condensación del acetoacetil-CoA con acetil-CoA conduce a la formación de HMG-CoA (3-hidroxi-3- metil-glutaril-CoA), este paso es mediado por la enzima HMG-CoA sintasa. Por último la subsecuente reducción del HMG-CoA mediada por la enzima HMG-CoA reductasa produce (R)-mevalonato. A estos tres primeros pasos enzimáticos se los conoce como vía del mevalonato superior.[4]
Vía del mevalonato inferior
La vía del mevalonato inferior, que convierte al (R)-mevalonato en IPP y DMAPP tiene 3 variantes. En eucariotas el mevalonato se fosforila dos veces en la posición 5-OH, siendo después descarboxilado para producir IPP (vía del mevalonato I).[4] En algunas arqueas tales como Haloferax volcanii, el mevalonato se fosforila una vez en la posición 5-OH, es descarboxilado para producir isopentenil fosfato (IP), y luego fosforilado nuevamente para producir IPP (vía del mevalonato II, o vía del mevalonato I de las arqueas).[5] En Thermoplasma acidophilum es posible encontrar una tercera variante de la vía del mevalonato, en esta vía el mevalonato se fosforila primeramente en la posición 3-OH, y luego en la posición 5-OH. El metabolito resultante, llamado mevalonato-3,5-bisfosfato, se descarboxila para producir IP, y finalmente se fosforila para producir IPP (vía del mevalonato III, vía del mevalonato II de las arqueas).[6][7]
Regulación y retroalimentación
Varias enzimas llave de esta vía pueden ser activadas por medio de la regulación a nivel de la transcripción de ADN mediada por SREBP (proteínas de unión a elementos reguladores de esteroles-1 y -2). Este sensor intracelular detecta los niveles bajos de colesterol y estimula la producción endógena por medio de la vía de la HMG-CoA reductasa, de la misma forma aumenta la captación de lipoproteínas regulando al alza al receptor de LDL. La regulación de esta vía también se consigue controlando la tasa de traducción del ARNm, degradación de la reductasa y fosforilación.[1]
Farmacología
Existen un cierto número de fármacos que hacen diana en la vía del mevalonato:
- Las estatinas (utilizadas para reducir los niveles de colesterol);
- Los bisfosfonatos (utilizados para el tratamiento de varias enfermedades degenerativas de los huesos)
Enfermedades
Existen vairas enfermedades que afectan a la vía del mevalonato, por ejemplo:
- Deficiencia de mevalonato quinasa
- Aciduria mevalónica
- Síndrome de hiperinmunoglobulinemia D (HIDS)
Vía alternativa
Las plantas, la mayor parte de las bacterias, y algunos protozoos tales como los parásitos que producen la malaria tienen la capacidad de producir isoprenoides por una vía alternativa llamada vía independiente del mevalonato o vía del metileritritol fosfato (MEP).[8] Los productos de ambas vías, la del mevalonato y la independiente de mevalonato son los mismos, IPP y DMAPP, sin embargo las reacciones enzimáticas que convierten al acetil-CoA en IPP son completamente diferentes en estas vías. En las plantas superiores, la vía del MEP se lleva a cabo en los plástidos, mientras que la vía del mevalonato se lleva a cabo en el citosol.[8] Algunos ejemplos de bacterias que hacen uso de la vía del MEP son Escherichia coli y patógenos tales como Mycobacterium tuberculosis.
Reacciones enzimáticas
Vía eucariota del mevalonato
| Enzima | Reacción | Descripción |
| Acetoacetil-CoA tiolasa |  | Produce la condensación de dos moléculas de acetil-CoA (provenientes del ciclo del ácido cítrico) para formar acetoacetil-CoA |
| HMG-CoA sintasa | Media la condensación de acetoacetil-CoA con otra molécula de acetil-CoA para formar 3-hidroxi-3-metilglutaril-CoA (HMG-CoA). | |
| HMG-CoA reductasa |  | En este paso el HMG-CoA es reducido a mevalonato por NADPH (en algunas especies por NADH). Este es el paso limitante de la velocidad en la síntesis de colesterol, razón por la cual esta enzima es una excelente diana terapéutica para los fármacos conocidos como estatinas. |
| mevalonato-5-quinasa |  | En este paso el mevalonato es fosforilado en la posición 5-OH para producir mevalonato-5-fosfato (compuesto conocido también como ácido fosfomevalónico). Este paso consume 1 ATP. |
| Fosfomevalonato quinasa | 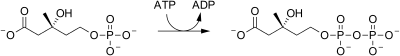 | el mevalonato-5-fosfato se fosforila nuevamente en la posición 5-OH, para producir mevalonato-5-pirofosfato. Se consume 1 ATP. |
| Mevalonato-5-pirofosfato descarboxilasa |  | Mevalonato-5-pirofosfato se descarboxila para producir isopentenil pirofosfato (IPP) (pirofosfato de isopentilo). Se consume 1 ATP. |
| Isopentenil pirofosfato isomerasa | 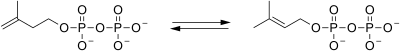 | El isopentenil pirofosfato se isomeriza para producir dimetilalil pirofosfato. |
Referencias
- Buhaescu I, Izzedine H (2007) Mevalonate pathway: areview of clinical and therapeutical implications. ClinBiochem 40:575–584.
- Holstein, S. A., and Hohl, R. J. (2004) Isoprenoids: Remarkable Diversity of Form and Function. Lipids 39, 293−309
- Goldstein, J. L., and Brown, S. B. (1990) Regulation of the mevalonate pathway. Nature 343, 425−430
- Miziorko H (2011) Enzymes of the mevalonate pathway of isoprenoid biosynthesis. Arch Biochem Biophys 505:131-143.
- Dellas, N., Thomas, S. T., Manning, G., and Noel, J. P. (2013) Discovery of a metabolic alternative to the classical mevalonate pathway. eLife 2, e00672
- Vinokur JM, Korman TP, Cao Z, Bowie JU (2014) Evidence of a novel mevalonate pathway in archaea. Biochemistry 53:4161–4168.
- Azami Y, Hattori A, Nishimura H, Kawaide H, YoshimuraT, Hemmi H (2014) (R)-mevalonate-3-phosphate is an intermediate of the mevalonate pathway in Thermoplasma acidophilum. J Biol Chem 289:15957–15967.
- Banerjee A, Sharkey TD. (2014) Methylerythritol 4-phosphate (MEP) pathway metabolic regulation. Nat Prod Rep 31:10431055
- "Lipitor becomes world's top-selling drug". Crain's New York Business. 2011-12-28.
Enlaces externos
- Rensselaer Polytechnic Institute Archivado el 4 de julio de 2017 en Wayback Machine. page on cholesterol synthesis (including regulation)