Sesquiterpeno
Los sesquiterpenos o sesquiterpenoides son los terpenos de 15 carbonos (es decir, terpenoides de un monoterpenoide y medio). Como los monoterpenoides, muchos sesquiterpenoides están presentes en los aceites esenciales. Además muchos sesquiterpenoides actúan como fitoalexinas, compuestos antibióticos producidos por las plantas en respuesta a la aparición de microbios, y como inhibidores de la alimentación ("antialimentario") de los herbívoros oportunistas.
Biosíntesis
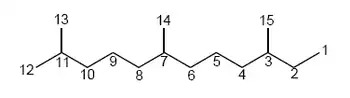
Los esqueletos de sesquiterpenos provienen de un precursor común: el pirofosfato de farnesilo:[1]

Varios sesquiterpenos de esqueleto lineal se producen como derivados del pirofosfato de farnesilo.La hormona de las plantas llamada ácido abscísico es estructuralmente un sesquiterpeno, su precursor de 15 carbonos, la xantosina, no es sintetizada directamente de 3 unidades isopreno sino producida por una escisión oxidativa asimétrica de un carotenoide de 40 unidades.

Los sesquiterpenos monocíclicos se generan por reacciones de ciclización del pirofosfato de farnesilo o alguno de sus derivados (NOTA: El esqueleto de drimano se forma por una diciclización concertada):

Principales esqueletos sesquiterpénicos (Se incluyen los esqueletos transpuestos y los esqueletos escindidos)
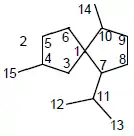
Farnesanos
 |
| Farnesano |
- Epoxifarnesanos
La Merrekentrona D es un sesquiterpenfurano aislado de las raíces y los injertos de Merremia kentrokaulus.[2] La miomontanona fue obtenida de Myoporum montanum.[3] La dendrolasina se encuentra en las secreciones defensivas de la hormiga Lasius fuliginosus[4]
 |
 |
| Botrilactona | Dendrolasina |
Ciclofarnesanos simples
Cicloneridiol
El ciclonerodiol es un metabolito aislado de Trichothecium spp., Fusarium culmorum, Gibberella fujikuroi y Trichoderma polysporum,[5] que contiene un esqueleto de 6-(2,3-dimetilciclopentil)-2-metilheptano. Los chokoles son un grupo de terpenos aislados del hongo endófito Epichloe typhina que presentan anillos de 5 miembros, tales como los chokoles A y F[6] (que contiene un esqueleto de 4-(2,3-dimetilciclopentil)pentano) y los chokoles B, C, D y E (que contienen un esqueleto de 6-(2,3-dimetilciclopentil)-2-metilheptano).[7]
 |
 |
 |
 |
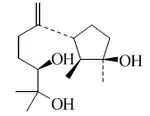 |
| Ciclonerodiol | Chokol A | Chokol B | Chokol C | Chokol E |
5,9-Ciclofarnesanos
El cetol Carney es un 5,9-ciclofarnesano aislado de plantas del género Myoporum. Su esqueleto de carbono es un 1-(butan-2-il)-3-metil-2-(3-metilbutil)ciclopentano. Se han aislado otros compuestos con estructura relacionada, tales como el cetol Brigalow, el cetol Kindon, el cetol Carr, el cetol Jackson, el cetol Warrego y el cetol Woogaroo.[8] La curcumalactona es una sesquiterpenlactona aislada de Curcuma wenyujin.[9] Las ciclohidromiopironas y el eumorfistonol son compuestos aislados de Eumorphia prostata.[10]
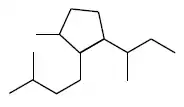 |
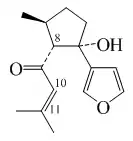 |
 |
 |
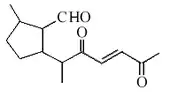 |
| 5,9-Ciclofarnesano | Cetol Carney | Curcumalactona | Ciclodeshidromiopirona A | Girinidona |
_5%252C9-cyclofarnesane.png.webp) |
 |
 |
 |
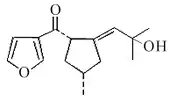 |
| Abeo 14(7→6) 5,9-ciclofarnesano | Merrekentrona D | Miomontanona | Ciclodeshidromiopirona B | Eumorfistonol |
Caulolactona

Herbasólido

Sesquiterpentropolonas
-2-(propan-2-il)cicloheptano.png.webp) |
 |
 |
| 1-(3-Metilbutil)-2-(propan-2-il)cicloheptano | Nootkatina | Cupresotropolona B |
Herbertianos
Los herbertianos (4-Metil-2-(2-metilbutil)-1-(1-metiletil)ciclohexano, no confundir con herbertanos) son ciclofarnesanos obtenidos a partir de la ciclización del pirofosfato de farnesilo en las posiciones 5 y 10. Ejemplos de estos compuestos son el humbertitol y el penlanfurano, aislado de la esponja marina Dysidea fragilis[11]
 |
 |
| Herbertiano | Penlanfurano |
Derivados de la ruta del bisabolano
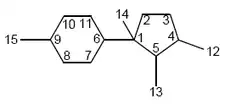
Bisabolanos
Los bisabolanos (1-(1,5-dimetilhexil)-4-metilciclohexano) son un grupo ampliamente distribuido en la naturaleza como componentes de las plantas superiores. El sistema de numeración utilizado para bisabolanos es el mismo que el sistema de farnesano. Muchos bisabolanos contribuyen al aroma de los aceites esenciales, como el caso del zingibereno, el cual es un constituyente del aceite esencial del jengibre.[12] El sesquicineol es otro caso de un componente que contribuye los aromas de aceites esenciales de Senecio subrubriflorus, Anthemis alpestris, Aydendron barbeyana y Boronia megastigma.[13] El ácido sidówico es un epoxibisabolano producido por Aspergillus sydowi.[14] El Yingzhaosu A es un endoperóxido de bisabolano que ha sido aislado de la planta medicinal china Artabotrys uncinatus[15]
 |
 |
 |
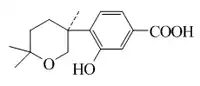 |
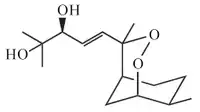 |
 |
| Bisabolano | Zingibereno | Sesquicineol | Ácido sidówico | Yingzhaosu A | Zingiber officinale |
Los panicúlidos son bisabol-1,14-ólidos aislados de Andrographis paniculata[16]

La diperezona es un dímero de acoplamiento por radicales libres aislado de Perezia alamani var. oolepis y de Coreocarpus arizonicus[17]

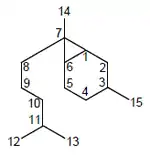
Sesquicaranos
Los sesquicaranos (nombre IUPAC 3,7-dimetil-7-(4-metil-pentil)biciclo-[4.1.0]heptano) son homólogos isoprénicos del carano. Un ejemplo representativo es el sesquicareno, un sesquiterpeno aislado de la planta Schisandra chinensis ([α]25D = -76.9 (c, 0.82 en cloroformo)).[18]
 |
 |
 |
| Sesquicarano | Sesquicareno | Schisandra chinensis |
Sesquisabinanos
Los sesquisabinanos son homólogos isoprénicos del sabinano. El nombre IUPAc es 1-(1,5-dimetilhexil)-4-metilbiciclo[3.1.0]-hexano. El 12-sesquisabinenal es un compuesto aislado de los aceites esenciales de varias especies de Haplocarpha
 |
 |
 |
| Sesquisabinano | 12-Sesquisabinenal | Haplocarpha |
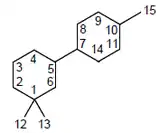
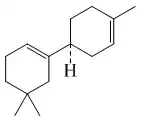
Macrocarpanos
Los macrocarpanos han sido aislados de Cupressus macrocarpa[19]
 |
 |
 |
| Macrocarpano | β-Macrocarpeno | ar-macrocarpeno |
Acoranos
 |
 |
 |
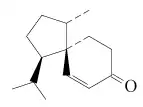 |
| Acorano | β-Acoradienol | Acorenona | 15-Nor-2-acoren-4-ona |
El bakerol es un 2-noracorano aislado de Cupressus bakeri[20]
 |
 |
| 2-Noracorano | Bakerol |
Cedranos
 |
 |
| Cedrano | 3,12-Cedranediol |
Isocedranos
 |
| Isocedrano |
Dupreziananos
Constituyentes de Cupressus dupreziana, y Juniperus thurifera[21]
 |
 |
| Duprezianano | β-Duprezianeno |
Prezizaanos
El alcohol y su ácido presentes en Vetiveria nigritana[24]
 |
-Prezizaen-12-ol.png.webp) |
| Prezizaano | (1β,2α,5β,8β)-7(15)-Prezizaen-12-ol |
Cuparanos
El cuparano (1-metil-4-(1,2,2-trimetilciclopentil)ciclohexano) se forma por la ciclización entre los carbonos 6 y 11 del bisabolano. Los cuparanos se han encontrado en hepáticas, plantas superiores y organismos marinos. El δ-Cuprenen-4-ol y el cuparadiepóxido son cuparanos aislados de la hepática Jungermannia asplenioides (Jungermanniaceae)[25]
 |
 |
 |
 |
| Cuparano | δ-Cuprenen-4-ol | Cuparadiepóxido | Jungermannia asplenioides |
Se han reportado 14(7→6)-Abeo-2,7-cuparanos aislados de hepáticas como el caso del isobazzaneno[26]
-Abeo-2%252C7-cuparano.png.webp) |
 |
 |
| 14(7→6)-Abeo-2,7-cuparano | Isobazaneno | Bazzania |
Lauranos y ciclolauranos
Los lauranos (1-metil-4-(1,2,3-trimetilciclopentil)ciclohexano) se encuentran en algas rojas particularmente en Laurencia. Los ciclolauranos pueden ser consideradas como ciclocuparanos pero pueden aparecer en las fuentes con lauranos.[27][28]
 |
 |
| Laurano | 11-Laureno-1,10-diol |
 |
 |
| Ciclolaurano | Neolaurinterol |
Herbertanos
Los herbertanos son un pequeño grupo de compuestos aislados de las hepáticas y los hongos. Por ejemplo el 1,15-Dihidroxiherberteno y la Herbertenona B fueron aislados de la hepática Herbertus sakuraii.
 |
 |
 |
| Herbertano | 1,15-Dihidroxiherberteno | Herbertenona B |
Tricotecanos
Los tricotecanos son epóxidos del esqueleto 1-(1,2-dimetilciclopentil)-1,4-dimetilciclohexano. La mayoría de tricotecanos contienen un 12,13-epóxido (Escirpano). Los tricotecenos son un grupo de micotoxinas encontradas en granos alimenticios infectados con hongos de los géneros Baccharis, Cephalosporum, Myrothecium, Trichothecium, Stachyobotrys, Calonectria y Fusarium. El 3-acetildesoxinivalenol es un contaminante típico. Las verrucarinas son micotoxinas del tricotecanos conjugados con ácidos dioicos.[29]
-1%252C4-dimetilciclohexano.png.webp) |
 |
 |
 |
 |
| 1-(1,2-dimetilciclopentil)-1,4-dimetilciclohexano | Escirpano | Isotricodermina | Verrucarina A | Fusarium oxysporum |
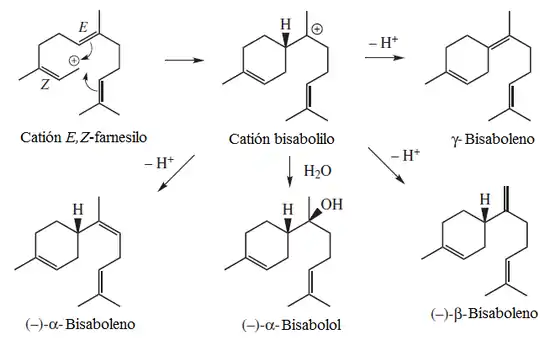
La biosíntesis de los tricotecanos parte del catión bisabolilo:
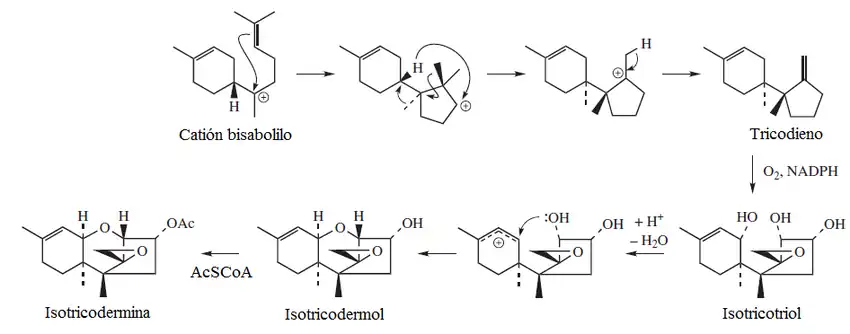
Espirovetivanos (Vetispiranos)
 |
 |
| Espirovetivano | Lubiminol |
Chamigranos
 |
 |
 |
| Chamigrano | Elatol | Esteperóxido B |
Derivados de la ruta de los drimanos
Drimanos
El drimano es un hidrocarburo bicíclico sesquiterpénico que se encuentra naturalmente en el petróleo.[32] Es prototipo estructural de diversos metabolitos secundarios aislados de hongos y plantas superiores. El primer compuesto de este tipo, el cual fue nombrado drimenol, se aisló de la planta chilena Drimys winteri.[33] Los esqueletos de drimano se forman por una biciclización concertada de pirofosfato de farnesilo. Los compuestos de las series ent- tales como la Iresina han sido aisladas de plantas del género Iresine.[34][35][36] Muchos de estos compuestos presentan actividad antialimentaria contra insectos[37] Los drimanos (Decahidro-1,1,4a,5,6-pentametilnaftalenos) se han aislado de hongos, esponjas y plantas superiores. La biosíntesis se elucida como un biciclización concertada del pirofosfato de farnesilo.

Los estereoisómeros de la forma ent- tales como la iresina fueron aislados por plantas del género Iresine spp.[34][35][36]
 |
 |
| Drimano | Fetidona B |
Se han reportado 8,9-secodrimanos (8,9-Seco-9(11)-drimen-8-ona) del tabaco.[38]
 |
-drimen-8-one.png.webp) |
| 8,9-Secodrimano | 8,9-Seco-9(11)-drimen-8-ona |
Coloratanos
Los coloratanos (Decahidro-1,2,4a,5,6-pentametilnaftalenos) son esqueletos de drimano transpuestos donde el metilo de la posición 4 migró a la posición 3. Se han encontrado en plantas de la familia Canellaceae. Un ejemplo es el muzigadial, aislado de Warburgia ugandensis[39] y Canella winterana.[40]
 |
 |
%252C7-Coloratadien-12%252C11-olide.png.webp) |
 |
| Coloratano | Muzigadial | 4(13),7-Coloratadien-12,11-ólido | Canella winterana |
Derivados de la ruta del germacrano
Germacranos
Los germacranos son un grupo de terpenos ampliamente distribuidos en la naturaleza.[41][42][43]

El grupo de los germacranos puede ser clasificado como:
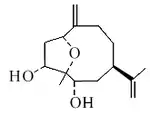
- Germacranos simples: Presentes en una gran diversidad de organismos. Las periplanonas son germacranos epoxidados que fungen como feromonas de la cucaracha americana.[44] El crisandiol es un 1,4-epoxigermacreno aislado de Chrysanthemum morifolium.[45] Los tanacetoles son compuestos aislados de Tanacetum.[46] La ciclaquenina es un componente de Iva xanthifilia.[47]
 |
 |
 |
 |
 |
| Germacrano | Periplanona B | Crisandiol | Tanacetol B | Ciclaquenina |
- Furanogermacranos
 |
| Furanogermacrano |
- 12,6-germacranólidos
La epibalsamina fue aislada de Centaurea coronopifolia[48] y Stizolophus balsamita[49]
 |
 |
| Costunólido | 9-Epibalsamina |
- 12,8-germacranólidos
La vernomigdina es un componente del extracto de Vernonia amygdalina.[50] El ineupatólido es ua sesquiterpenlactona aislada de Inula eupatorioides[51]
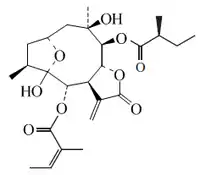 |
 |
| Vernomigdina | Ineupatólido |
- 14,6-germacranólidos
 |
| Neoliacina |
- 15,6-germacranólidos
El ácido neoliacínico es un 15,6-germacranólido aislado de la planta Neolitsea aciculata
 |
| Ácido neoliacínico |
- Norgermacranos
- Homogermacranos,
- Secogermacranos
Elemanos
Los elemanos se numeran consistentemente con los eudesmanos y germacranos. Los elemanos se forman por transposición de Cope de 1(10), 4-germacradienos. Por esta razón, muchos elemanos identificados pueden ser compuestos no naturales (formados por el proceso de purificación). Un ejemplo es el 1,11-elemadien-15-al, aislado del aceite vetiver de Haití.[52] Algunos elemanos se producen por modificación oxidativa, como la vernolepina aislada de Vernonia amygdalina.[53]
 |
 |
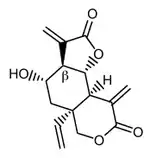 |
 |
 |
| Elemano | 1,11-Elemadien-15-al | Vernolepina | Temisina | Vernonia |
El occidenol es un elemano oxepínico aislado de Thuja occidentalis, Thuja koraiensis y Nicotiana rustica[54]

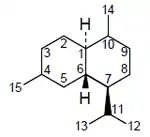
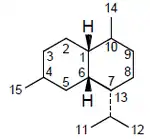
Cadinanos
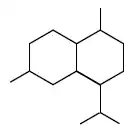 |
 |
 |
 |
 |
 |
 |
| Decahidro-1,6-dimetil-4-isopropilnaftaleno | Cadinano | Muurolano | Bulgarano | Amorfano | Calameneno | Cadaleno |
El primer reporte del aislamiento de un cadinano en forma impura fue a mediados del siglo XX. Desde entonces, otros esqueletos similares han sido cadinenos ampliamente distribuidos en la naturaleza y en la actualidad se han reportado más de 190. Mientras que el amorfinano tiene origen en un esqueleto de bisabolano,[55]
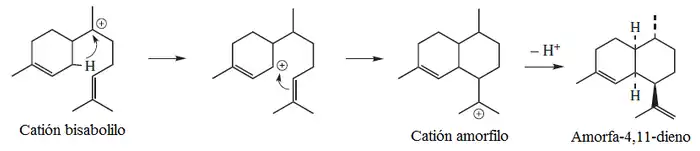
el cadinano tiene su origen en el germacrano.[56]

El isocadaleno es un 11(7→8)-abeo-1,3,5,7,9-cadinapentaeno aislado de Heterotheca inuloides[57]
 |
 |
| Isocadaleno | 4-Hidroxiisocadaleno |
El isocalameno es un 15(4→3)-abeo-1,3,5-cadinano que se ha encontrado en plantas del género Chiloscyphus y Bazzania[58][59]
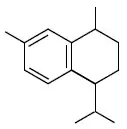 |
 |
| Isocalameneno | Quiloscifenol A |
La artemisina es un derivado de oxidación del ácido artemísico (un amorfano) aislado de la planta compuesta Artemisia annua. El esqueleto de la artemisina corresponde al 4,5-secoamorfano o (1R,2S,3R,4S)-2-butil-1,3-dimetil-4-(propan-2-il)ciclohexano.
-2-butil-1%252C3-dimetil-4-(propan-2-il)ciclohexano.png.webp) |
 |
| 4,5-Secoamorfano | Artemisia annua |
Oplopanos
Los oplopanos (1-Etiloctahidro-4-metil-7-(1-metiletil)-1H-indeno) han sido aislado de plantas superiores. Son 3(4 → 5)-abeocadinanos. Las pulioplopanonas son sesquiterpenos tipo oplopano aislados de especies de Pulicaria[60]
 |
 |
 |
| Oplopano | Pulioplopanona A | Pulicaria |
Eringenanos
Los eringenanos son 13(11→12)-abeo-9-cadinanos aislados de Eryngium creticum[61]
 |
 |
| Eringenano | 9-Eringen-15-al |
6(7 → 8)-abeocadinanos
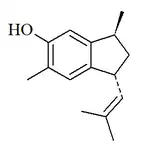
El mutisiantol es un compuesto que es base de varios compuestos con esqueleto (1S,3S)-1,5-dimetil-3-(2-metilpropil)-2,3-dihidro-1H-indeno, fue aislado por Bohlmann y colaboradores en 1979, a partir de las raíces Mutisia homoeantha. Este grupo consiste en esqueletos de 6(7 → 8)-abeocadinanos de Jungia y Mutisia'.
-1%252C5-dimetil-3-(2-metilpropil)-2%252C3-dihidro-1H-indeno.png.webp) |
 |
 |
| (1S,3S)-1,5-dimetil-3-(2-metilpropil)-
2,3-dihidro-1H-indeno |
Mutisiantol | Mutisia |
Eudesmanos
Los eudesmanos (denominados como selinanos en literatura anterior a los años 50's). Los eudesmanos que presentan la configuración 4β,5α,7β,10β se encuentran en plantas superiores mientras que los ent- eudesmanos se encuentran en hepáticas. Los eudesmados son sesquiterpenos muy diversos y que presentan diversas variaciones estructurales:
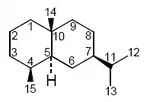
- Eudesmanos y ent-eudesmanos (Decahidro-1,4a-dimetil-7-(1-metiletil)-naftaleno):
 |
 |
 |
| Eudesmano | Gerina | Geraea viscida |
- Eudesman-12,6-ólidos
 |
| α-Santonina |
- Eudesman-12,8-ólidos
- Furanoeudesmanos
- Cicloeudesmanos: El 6,8-ciclo-4(15)-eudesmeno-1,2-diol fue aislado de la planta Jatropha neopauciflora[62]
 |
-eudesmene-1%252C2-diol.png.webp) |
| 6,8-Cicloeudesmano | 6,8-Ciclo-4(15)-eudesmeno-1,2-diol |
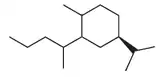
- Secoeudesmanos: El 6,7-seco-7(11)-eudesmen-6-al (Esqueleto base: 2,6-Dimetil-2-(4-metil-3-pentenil)ciclohexano) fue aislado por Adio a partir de la hepática Tritomaria polita.[63] El ácido 1,10-seco-3,5(10)-eudesmadien-12,6-olid-1-oico es un 1,10-secoeudesmano aislado de Artemisia hugueti.[64] La azoridiona y su epímero α fueron son 4,5-secoeudesmanos aislados de Cyperus rotundus[65] y Laurus azorica.[66]
 |
-eudesmen-6-al.png.webp) |
| 6,7-Secoeudesmano | 6,7-Seco-7(11)-eudesmen-6-al |
 |
-eudesmadien-12%252C6-olid-1-oic_acid.png.webp) |
| 1,10-Secoeudesmano | Ácido 1,10-seco-3,5(10)-eudesmadien-12,6-olid-1-oico |
 |
 |
| 4,5-Secoeudesmano | Azoridiona |
- Noreudesmanos
- Agarofuranos y alcaloides tipo evonina. 2,6,10,10-tetrametil-11-oxatriciclo[7.2.1.01,6]dodecano.
 |
| Dihidro-β-agarofurano |
Los eudesmanos tienen valor quimiotaxonómico. Por ejemplo, los agarofuranos y los alcaloides tipo evonina son indicadores quimiotaxonómicos de la familia Celastraceae. La gerina es un compuesto aislado de Geraea viscida.[67]
Jatamansanos
Estos compuestos, llamados también como valeranos (El esqueleto es un decahidro-4a,8a-dimetil-2-(1-metiletil)naftaleno) han sido aislados principalmente de Valeriana. Estos esqueletos son derivados de transposición del eudesmano en donde el grupo metilo del carbono 4 ha migrado a la posición 5. La jatamansona es un componente de las raíces de Valeriana officinalis y Nardostachys jatamansi.[68]
 |
 |
 |
| Jatamansano | Jatamansona | Valeriana officinalis |
Helmintosporanos
Aislado de Helminthosporium sativum y Cochliobolus sativus[69]
 |
 |
| Helmintosporano | Helmintosporal |

Emotina
El esqueleto de la emotina, el 1,4-dimetil-6-(propan-2-il)naftaleno, es un 14(10 → 1)-abeoeudesmano con un anillo aromático A y el metilo de la posición 10 migrado a la posición 1. Estos compuestos han sido aislados de Emmotum nitens, por ejemplo la emotina C.[70]
 |
 |
 |
| Emotina | Emotina C | Emmotum |
Opositanos
Los opositanos son 8(7 → 6)-abeoeudesmanos y se encuentran tanto en esponjas (Axinella) como en plantas de la familia Apiaceae (Torilis japonica, Erigeron annuus),[71][72] Annonaceae (Annona bullata) y Araceae (Homalomena occulta[73]) como en organismos marinos. Su esqueleto es un octahidro-3a,7-dimetil-1-(2-metilpropil)-1H-indeno.
 |
%252C7(11)-Oppositadien-1-ol.png.webp) |
 |
| Opositano | 1-β-4(15),7(11)-Oppositadien-1-ol | Torilis japonica |
Farfugina
El esqueleto de la farfugina, el 1,5-dimetil-3-(propan-2-il)naftaleno, consiste en un 14(10 → 9)-abeoeudesmano, el cual tiene un anillo aromático B y el metilo en posición 10 migrado hacia la posición 9. Las farfuginas han sido aisladas de Farfugium japonicum[74]
 |
 |
 |
| Farfugina | Farfugina A | Farfugium japonicum |
Gorgonanos
Los gorgonanos (Decahidro-1,4a-dimetil-8-(1-metiletil)naftalenos) son derivados del eudesmano por una migración del grupo isopropilo a la posición 6. Estos terpenos han sido aislados de corales Pseudopterogorgia americana[75] y Saccogyna viticulosa[76]
 |
 |
 |
| Gorgonano | β-Gorgoneno | Pseudopterogorgia americana |
Eremofilanos
Los eremofilanos se derivan de los eudesmanos por la migración del grupo metilo desde C-10 a C-5. Existe una confusión en la literatura sobre la numeración de los carbonos 14 y 15; la numeración biogenética dada a continuación es la más utilizada. La estereoquímica normal se muestra, aunque hay varias excepciones a esta. Al igual que con las otras categorías más grandes, los eremofilanos se separan en eremofilanos simples, eremophilanólidos y furanoeremofilanos, secoeremofilanos, abeoeremofilanos y noreremofilanos.[77]
 |
 |
 |
| Eremofilano | Eremofilanólido | 8,9-Secoeremofilano |
|
%252C7(11)-eremofiladien-8%252C12-olid-9-oico.png.webp)
Quiloscifanos
Los quiloscifanos son sesquiterpenos con esqueleto base de octahidro-7,7a-dimetil-1-(2-metilpropil)-1H-indeno. Biogenéticamente son considerados son 8(7 → 6)-abeoeremofilanos. Estos compuestos han sido aislados de hepáticas. Por ejemplo, la 10-α-7,10-Anhidro-11,12-dihidroquiloscifolona fue aislada de Lepidozia fauriana[78]
 |
 |
| Quiloscifano | 10-α-7,10-Anhidro-11,12-dihidroquiloscifolona |
Aristolanos
Los aristolanos (Decahidro-1,1,7,7a-tetrametil-1H-ciclopropa-[a]naftalenos) fueron aislados de varias especies de plantas del género Aristolochia y hepáticas. Se definen como 6,11-cicloeremofilanos. El 9-aristolen-12-al es un aristolano aislado de hepáticas del género Bazzania.[79] El α-feruleno es un compuesto relacionado encontrado en plantas vasculares (Ferula communis y Acanthella cavernosa), además de corales (Pseudopterogorgia americana).
 |
 |
 |
 |
| Aristolano | α-Feruleno | 9-Aristolen-12-al | Bazzania trilobata |
Nardosinanos
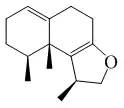
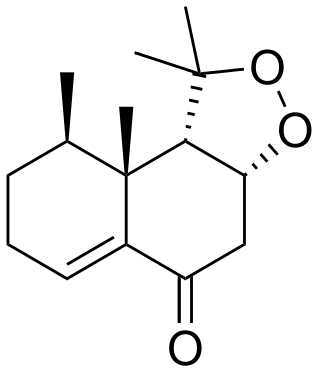
Los narsidosanos son sesquiterpenos aislados de organismos marinos que presentan el esqueleto base de decahidro-1,8a-dimetil-8-(1-metiletil)naftaleno. El Nardosinanol A es un furonardosinano aislado de esponjas del género Lemnalia.[80] Estos esqueletos son eremofilanos en los cuales el grupo isopropilo ha migrado a la posición 6. Las paralemnolinas son derivados del nardosinano aislados del coral Paralemnalia thyrsoides.[81] La nardosinona es un nardosinano constituyente de Nardostachys jatamansi.[82]
 |
 |
 |
 |
 |
| Nardosinano | Paralemnolina M | Nardosinanol A | Nardosinona | Nardostachys grandiflora |
Cacaloides
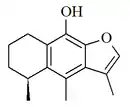
El cacalol es un nafto[2,3-b]furano aislado del matarique y posteriormente se encontraron compuestos con el esqueleto relacionado de 1,8-dimetil-2-(propan-2-il)naftaleno.[83] Se han aislado de plantas del género Cacalia y Psacalium.
naftaleno.png.webp) |
 |
 |
| 1,8-dimetil-2-(propan-2-il)naftaleno | Cacalol | Cacalia |
Guayanos
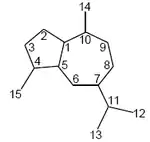
Los guayanos (Decahidro-1,4-dimetil-7-(1-metiletil)azulenos) son un grupo de sesquiterpenos ampliamente distribuidos en la naturaleza en forma de hidrocarburos, alcoholes y sesquiterpenlactonas (Guayanólidos).[84] Estos sesquiterpenos son típicos de la familia Asteraceae.

Este grupo puede ser clasificado en:
- Guayanos simples
 |
 |
 |
| Guayano | Eurabidiol | Euriops |
- 12,6-guayanólidos
 |
 |
| Kauniólido | Tapsigargina |
- 12,8-guayanólidos
- Secoguayanos
Se han reportado 3,4-secoguayanos (Espicatólidos y zaluzaninas) aislados de Zaluzania grayana,[85] Pseudelephantopus spicatus[86] y Microliabum polymnioides (Asteraceae) Por otro lado, los 1,10-secoguayanos han sido encontrados en Cyperus articulatus[87] y Alpinia oxyphylla.[88] Los xantanos (1-Butil-2-metil-5-(1-metiletil)cicloheptanos) son 4,5-secoguayanos originalmente aislados de Xanthium. Otro ejemplo es la Giberodiona obtenida de los extractos de Sinularia gibberosa[89]
 |
 |
| 3,4-secoguayanos | Espicatólido H |
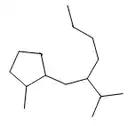 |
 |
| 1,10-Secoguayano | Mandasidiona |
_-_numeraci%C3%B3n.png.webp) |
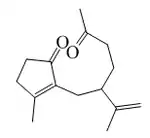
 |
| 4,5-Secoguayano (Xantano) | Giberodiona |
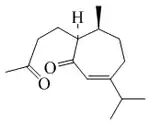
- Abeoguayanos: Se han reportado diversos esqueletos producidos por la transposición de grupos metilo, como en el caso del 11(7→6)-Abeo-2-guaien-10-ol, aislado de Ulva fasciata.[90] Los pseudoguayanos (Decahidro-4,8a-dimetil-7-(1-metiletil)azulenos) son abeoguayanos generados por la migración de un metilo del carbono 4 a la posición 5. Muchas veces el carbono 4 tiene una función orgánica con oxígeno. La partenina es un ejemplo del seudoguayano.
-Abeo-2-guaien-10-ol.png.webp) |
 |
 |
| 11(7→6)-Abeo-2-guayen-10-ol | Pseudoguayano | Partenina |
- Dímeros de guayanos:
- 1) Dímeros tipo absintina: La absintina es un aducto Diels-Alder de dos guayanos.

- 2) Acoplamiento por radicales libres: El bisnubenólido, el bisnubidiol y la bistataxacin son dímeros por acoplamiento del nubenólido.
- 3) Dímeros tipo microlenina.
- 4) Dímeros tipo maritimólido
- 5) Pungiólidos
- 6) Gochnatiólidos
- 7) Vietlaninas
Carabranos
Los carabranos (7-Butil-1-metil-4-(1-metiletil)biciclo[4.1.0]heptanos) son un grupo de sesquiterpenos del tipo 5,10-cicloxantanos. Los curcarabranoles son carabranos aislados de Curcuma zedoaria.[91]
 |
 |
_001.jpg.webp) |
| Carabrano | Curcarabranol A | Curcuma zedoaria |
Aromadendranos
Los aromadendranos (Decahidro-1,1,4,7-tetrametil-1H-cicloprop[e]azulenos) son 6,11-cicloguayanos. Otros derivados de los cicloguayanos son los 5,10-cicloaromadendranos, secoaromadendranos, incluyendo a las plagioquilinas (2,3-secoaromadendranos).
 |
 |
 |
| Aromadendrano | 5,10-Cicloaromadendrano | 2,3-Secoaromadendrano |
Cubebanos
Los cubebanos (Octahidro-3,7-dimetil-4-(1-metiletil)-1H-ciclopenta[1,3]ciclopropa[1,2]-bencenos) son 1,6-cicloguayanos. Han sido identificados en los aceites esenciales de cubeba (Piperaceae),[92] Jackiella javanica (Jackiellaceae),[93] Eupatorium serotinum y Solidago canadensis (Asteraceae)
 |
 |
 |
 |
| Cubebano | α-Cubebeno | 11-Cubebanol | Piper cubeba |
Ivaxilaranos
Los ivaxilaranos (4,6b-dimetil-2-(propan-2-il)decahidrociclopropa[e]indenos) son 8,10-cicloguayanos. La ivaxilarina es un ivaxilaranólido aislado de Iva axillaris.[94]
 |
 |
 |
| Ivaxilarano | Ivaxilarina | Iva |
Patchoulanos
Los patchoulanos (4,10,11,11-tetrametiltriciclo[5.3.1.01,5]undecanos) son 1,11-cicloguayanos. En el aceite de patchouli han sido aislados varios esqueletos transpuestos de patchoulano. El ciperenol y el α-patchouleno son sesquiterpenos tipo patchoulano abundantes en los aceites esenciales de varias especies de plantas pertenecientes a las familias Lamiaceae (Pogostemon),[95] Lauraceae (Lindera), Cyperaceae (Cyperus), Asteraceae (Cirsium), valerianaceae (Nardostachys)[96] y Euphorbiaceae (Joannesia, Sandwithia, y Croton)
 |
 |
 |
 |
| Patchoulano | Ciperenol | α-Patchouleno | Cyperus rotundus |
La ciperadiona es un 4,5-secopatchoulano aislado del aceite esencial de Cyperus rotundus.[97]
 |
 |
| 4,5-Secopatchoulano | Ciperadiona |
Ishwaranos
 |
 |
| Ishwarano | Ishwaranol |
Valerenanos
Los valerenanos (Octahidro-1,4-dimetil-7-(2-metilpropil)-1H-indeno) son 8(7 → 6)-abeoguayanos. Un ejemplo es el α-valerenol y sus derivados de oxidación, aislados de plantas de la familia Valerianaceae (Valeriana)[98] y Asteraceae (Zexmenia).[99]
 |
 |
 |
| Valerenano | α-Valerenol | Valeriana officinalis |
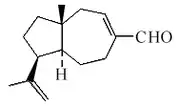
Daucanos
Los daucanos (decahidro-3a,6-dimetil-1-(1-metiletil)azulenos) son estructuras encontradas principalmente en plantas del género Ferula, Blainvillea, Daucus, Rosa[100] y Homalomena así como los hongos Trichoderma,[101] Aspergillus y Gliocladium.[102][103]
 |
 |
 |
 |
 |
| Daucano | 2,8-Daucadieno-5,10-diol | Tricocarano C | Isodaucenal | Homalomena |
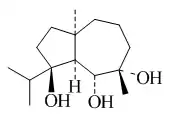
Salviolanos
Los salviolanos (llamados también Isodaucanos) son sesquiterpenos con esqueletos de decahidro-3a,7-dimetil-1-(1-metiletil)azuleno. Un ejemplo de estos compuestos es el homalomenol E, aislado de Homalomena occulta.[104]
 |
 |
| Salviolano | Homalomenol E |
Derivados de la ruta del humulano
Humulanos y biciclohumulanos
El humulano es producto de la ciclización del pirofosfato de farnesilo en las posiciones 1 y 11. El humuleno se encuentra en el lúpulo (Humulus lupulus).
 |
 |
 |
| Humulano | Humuleno | Lúpulo (Humulus lupulus) |
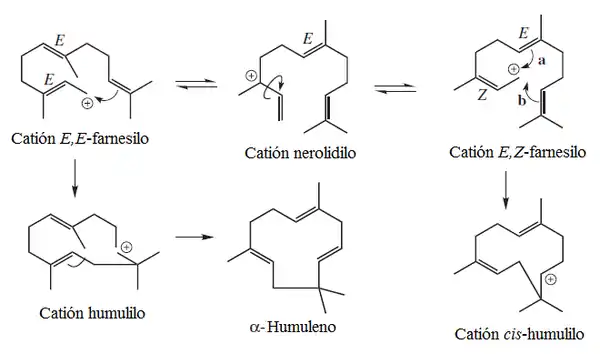
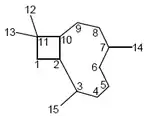
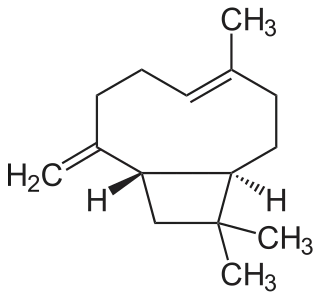
Cariofilanos
La ciclización del humulano en los carbonos 2 y 10 produce el esqueleto de cariofilano. El β-cariofileno se ha aislado de varias plantas, tales como Syzygium aromaticum y Cinnamomum zeylanicum. El taedolidol es un diepoxicariofileno obtenido del hongo endófito Pestalotiopsis sp. aislado de Pinus taeda.[105]
 |
 |
 |
 |
| Cariofilano | β-Cariofileno | Taedolidol | Syzygium aromaticum |

Iludanos
Los iludanos son sesquiterpenos aislados de hongos de los géneros Cyathus, Clitocybe, Pleurotus, Mycena y Russula[108] además de helechos de los géneros Hypolepis y Pteridium.[109]
- Nombre IUPAC: Decahydro-2',2',4',6'-tetrametilespiro[ciclopropano-1,5'-[5H]indeno]
 |
-dieno-3%252C14-diol.png.webp) |
 |
| Iludano | Iluda-7,9(10)-dieno-3,14-diol | Mycena |
Protoiludanos
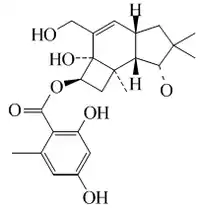
Los protoiludanos son estructuras sesquiterpénicas aisladas de hongos del género Armillaria, Coprinus, Fomitopsis, Omphalotus y Clitocybe. El 6-protoiludeno es un sesquiterpeno aislado de Fomitopsis insularis y Omphalotus olearis.[110] Los meleólidos son ésteres protoiludánicos esterificados con ácido orselínico aislados de Armillaria mellea.
- Nombre IUPAC: Decahidro-3,6,6,7b-tetrametil-1H-ciclobut[e]-indeno.
 |
 |
 |
 |
| Protoiludano | 6-Protoiludeno | Meleólido E | Fomitopsis |
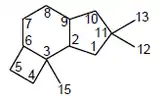
La armilasina es un 14-norprotoiludano esterificado con el ácido orselínico. También fueron aislados de Armillaria mellea.[111]
- Nombre IUPAC: Decahidro-6,6,7b-trimetil-1H-ciclobut[e]-indeno.
 |
 |
 |
| 14-Norprotoiludano | Armilasina | Armilaria melea |
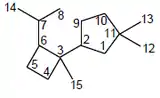
La estructura del fomosano corresponde a la de un 8,9-secoprotoiludano. La iludosina es un fomosano aislado del extracto del hongo Omphalotus illudens.[112]
- Nombre IUPAC: 1,1-Dimetil-3-[1-metil-2-(propan-2-il)ciclobutil]ciclopentano.
 |
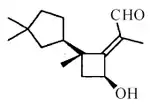 |
 |
| Fomosano | Iludosina | Omphalotus illudens |
Iludalanos
Los iludalanos se pueden considerar como 4,6-secoilludanos. Estos esqueletos se encuentran en hongos (géneros Clitocybe, Fomes y Onychium) y helechos (géneros Pityrogramma, Hypolepis, Dennstaedtia, Equisetum y Cibotium). Los hongos del género Ripartites y Russula producen iludalanos fenólicos (Riparoles[113] y rusujaponoles[114]).
 |
 |
 |
 |
| Iludalano | Rusujaponol I | Riparol B | Ripartites |
El cibrodol es un 10,11-secoiludalano aislado del hongo Cyathus buller.[115]
 |
 |
| 10,11-Secoiludalano | Cibrodol |
Cerapicanos
 |
| Caratopicano |
Ceratiopicanos
 |
 |
| Ceratopicano | Ceratopicanol |
Hirsutanos
Esponjas del género Haliclona[116] y Gloeostereum incarnatum[117]
 |
 |
 |
| Hirsutano | Hirsutanol A | Gloeosteretriol |
Himachalanos
Los himachalanos (Decahidro-2,5,9,9-tetrametil-1H-benzocicloheptenos) son sesquiterpenos aislados de plantas de la familia Pinaceae (Cedrus), Asteraceae (Artemisia, Lasianthaea, Blumea y Acritopappus). La bacciferina A es un himachalano aislado de Cipadessa baccifera (Meliaceae)[119]
 |
 |
 |
| Himachalano | Bacciferina A | Cipadessa baccifera |
Africananos
Los africananos son decahidro-3,3,5,7b-tetrametil-1H-cicloprop[e]azuleno. El Africantriol es un compuesto con este esqueleto base que es producido por Streptomyces (cepa HKI0297)[120] y el octocoral Lemnalia africana.[121] Por otro lado, la 10-Angeloiloxi-2-africanen-4-ona fue aislada de la planta Senecio oxyriifolius.[122]
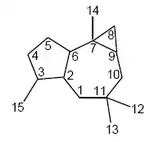 |
 |
 |
| Africanano | Africantriol | 10-Angeloiloxi-2-africanen-4-ona |
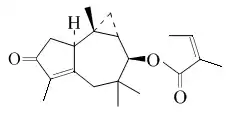
Longipinanos
Los longipinanos (2,6,6,9-Tetrametiltriciclo[5.4.0.02,8]undecanos) son 2,7-ciclohimachalanos. Estos esqueletos han sido detectados en aceites esenciales de Asteraceae (Lavandula, Stevia, Artemisia, Tanacetum, Santolina) y Lamiaceae (Lavandula). La 2-longipinanona es un longipinano aislado de Artemisia filifolia.[123] El oblongifoliol es un constituyente de Santolina oblongifolia y Santolina viscosa.[124]
 |
 |
 |
 |
 |
| Longipinano | α-Longipineno | 2-Longipinanona | Oblongifoliol | Santolina |
Longifolanos
Los longifolanos tienen la estructura de decahidro-4,8,8,9-tetrametil-1,4-metanoazuleno.[125] El longifoleno (llamado también junipeno) es un longifolano ampliamente distribuido en el reino vegetal, sobre todo en especies de los géneros Pinus y Juniperus. El 7(15)-Longifolen-5-ol es un longifolano aislado de Juniperus conferta.
 |
 |
-Longifolen-5-ol.png.webp) |
 |
| Longifolano | Junipeno | 7(15)-Longifolen-5-ol | Juniperus conferta |
Longibornanos
Los longibornanos (Decahidro-4,5,5,8a-tetrametil-1,4-metanoazulenos) son 3,7-ciclohimachalanos. Estos compuestos están distribuidos en varias especies de coníferas de los géneros Juniperus, Pinus, Cupressus, Dacrydium y Cedrus.[126] Un ejemplo de estos compuestos es el kuromatsuol (llamado también juniperol o 4β-longiborneol).
 |
 |
 |
| Longibornano | Kuromatsuol | Dacrydium |
Otros esqueletos
Brasilanos
Los brasilanos son sesquiterpenos con esqueleto base de octahidro-1,6,6-trimetil-4-(1-metiletil)-1H-indeno. Se han aislado de moluscos del género Aplysia. Este esqueleto toma su nombre de Aplysia brasilensis (Sinónimo: Aplysia fasciata).
 |
 |
 |
| Brasilano | Brasilenol | Aplysia brasilensis |
Hodgsonox
Los hodgsonoxes son sesquiterpenos aislados de la hepática Lepidolaena hodgsoniae[127]
-4-(propan-2-il)ciclopentano.png.webp) |
 |
 |
| 1-Etil-2-(pentan-2-il)-4-(propan-2-il)ciclopentano | Hodgsonox | Hodgsonox B |
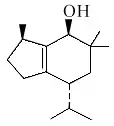
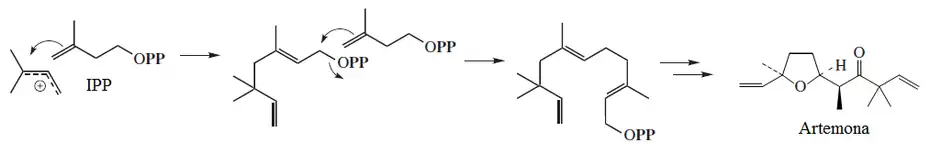
Artemona
La artemona es un sesquiterpeno irregular aislada de Artemisia pallens, Artemisia abrotanum y Polygonum barbatum[128][129]
Tapsanos
Los tapsanos (Octahidro-1,2,3a,7,7,7a-hexametil-1H-indenos) han sido aislados de plantas del género Thapsia.[130] El tapsanol es un 14,15 epoxitapsano aislado de la planta Thapsia villosa (Apiaceae)[130]
 |
 |
|
| Tapsano | Tapsanol | Thapsia villosa |
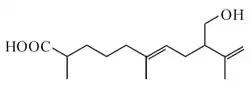
Ácido helepuberínico
Kumepaloxano

Aliacanos
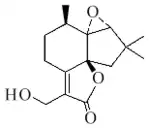
Los aliacanos son sesquiterpenos con esqueleto base de octahidro-2,2,4-trimetil-7-(1-metiletil)-1H-indeno. Han sido aislados de los hongos Marasmius alliaceus y los primnatrienos aromáticos de Primnoeides. Los primnatrienos son anillos aromáticos de los aliacanos.
 |
 |
 |
 |
 |
| Aliacano | Primnatrienona | Aliacol B | Aliacólido II | Marasmius alliaceus |
El rusulanorol, aislado de Russula delica es un ejemplo de un esqueleto que corresponde a un abeo-11(4→3)-12-noraliacano:[131]
 |
 |
| Rusulanorol A | Russula delica |
Lipifolianos
 |
| Lipifoliano |
Pinguisanos
Los pinguisanos (5-Etiloctahidro-1,3a,4,7a-tetrametil-1H-indenos) han sido aislados de hepáticas (Trocholejeunea, Porella, Aneura). Se pueden clasificar en:
- Tapsanos simples: Un ejemplo de estos compuestos es el pinguisenol aislado de varias especies de Porella.[132]
 |
 |
 |
| Pinguisano | Pinguisanol | Porella |
- Furanopinguisanos: La pinguisanina es un ejemplo de este tipo de compuestos; fue aislada de Porella platyphylla[133]
 |
| Pinguisanina |
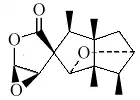
- Abeopinguisanos: El pinguisanólido y la espirodensifolina B son 7(6→5)-abeopinguisanos que fueron reportados de las hepáticas Porella platyphylla[134] y Frullanoides densifolia[135] respectivamente.
-Abeopinguisane.png.webp) |
 |
 |
| 7(6→5)-Abeopinguisano | Pinguisanólido | Espirodensifolina B |
Fukinanos
Los fukinanos (Octahidro-2,3a,4-trimetil-2-(1-metiletil)-1H-indenos) fueron aislados de Petasites japonicus. También se han aislado del coral Coelogorgia.
 |
| Fukinano |
Picrotoxanos
Los picrotoxanos (Octahidro-1,4,7a-trimetil-5-(1-metiletil)-1H-indenos) son componentes amargos y tóxicos de plantas de la familia Orchidaceae. Por lo general son altamente oxigenados.[136] Se pueden clasificar en:
- Picrotoxanos simples: Los dendronobilósidos son picrotoxanos aislados de orquídeas del género Dendrobium.[137]
 |
 |
| Picrotoxano | Dendronobilósido A |
- Picrotoxanólidos: El ejemplo típico es la picrotoxinina, una toxina antagonista de los receptores GABAA aislada de varias plantas, tales como Anamirta cocculus y Menispermum cocculus.[138][139]
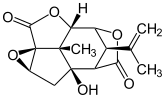 |
| Picrotoxinina |
Perforanos
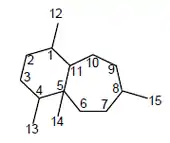
Los perforanos tienen esqueleto de decahidro-1,4,7,9a-tetrametil-1H-benzocicloheptano. Se les ha aislado de algas del género Laurencia (como el caso del guadalupol)[140] y del molusco Aplysia.
 |
 |
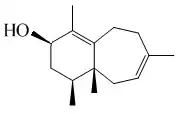 |
| Perforano | Perforenona | Guadalupol |
Pacifigorgianos
Los pacifigorgianos son esqueletos de sesquiterpenos encontrados en corales del género Pacifigorgia y de hepáticas del género Frullania[141]
- Nombre IUPAC: Octahidro-1,5-dimetil-4-(2-metilpropil)-1H-indeno.
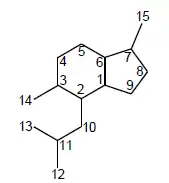 |
 |
 |
| Pacifigorgiano | 2,10-Pacifigorgiadieno | Frullania |
Asteriscanos
Los asteriscanos son sesquiterpenos aislados de Asteriscus (Asteraceae)[142]
- Nombre IUPAC: Decahidro-2,2,4,8-tetrametil-1H-ciclopentacicloocteno.
 |
 |
 |
| Asteriscano | Ácido 15-asteriscanoico | Asteriscus |
Punctaporonanos
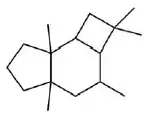 |
| Punctaporonano |
Pleurotelanos
 |
| Pleurotelano |
Fomanosanos
 |
| Fomanosano |
Esterpuranos
Los esterpuranos son sesquiterpenos relacionados biosintéticamente con los iludanos. Han sido aislados de los hongos Merulis y Stereum.[143]
- Nombre IUPAC: Decahidro-2a,5,5,7-trimetil-1H-ciclobut[f]-indeno.
 |
 |
 |
| Esterpurano | Ácido esterpúrico | Stereum (Chondrostereum) purpureum) |
Lactaranos
Los lactaranos son sesquiterpenos aislados casi exclusivamente de Lactarius.[144] La rusulactarororufina es un lactarano aislado de Russula brevipes.[145]
- Nombre IUPAC: 2,2,4,6,7-Pentametildecahidroazuleno.
 |
 |
 |
 |
 |
| Lactarano | Piperalol | Velerolactona | Rusulactarororufina | Lactarius piperatus |
Se han aislado 8-norlactaranos de los hongos Lactarius, como el caso de la 8-norlactaranolactona[146]

La lactaronecatorina A es un 8,9-secolactarano aislado de Lactarius.[147]
 |
 |
| 8,9-Secolactarano | Lactaronecatorina A |
Isolactaranos
Los isolactaranos han sido aislados de hongos Lactarius[148]
 |
 |
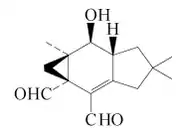 |
 |
| Isolactarano | Isolactarorufina | Merulidial | Merulactona |
Marasmanos
 |
 |
| Marasmano | Velutinol |
Tremulanos
Los tremulanos constituyen una clase de sesquiterpenos que son caracterizados por el esqueleto 2,2,4,5,8-pentametildecahidroazuleno. El primer compuesto con este esqueleto fue aislado en 1993 a partir del saprofito del álamo Phellinus tremulae[150] Los conocenoles se han aislado de Conocybe siliginea.[151]
 |
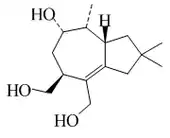 |
_Kuhner_173098_crop.jpg.webp) |
| Tremulano | Conocerol B | Conocybe siliginea |
También se han reportado 5,6-secotemulanos (Conocenólidos A y B) de Conocybe siliginea
 |
 |
 |
| 5,6-Secotemulano | Conocenólido A | Conocenólido B |
Furodisinas
 |
 |
| Furodisina | 3-Etildecahidro-1,1,6-trimetilnaftaleno |
Botridial
 |
 |
| Botridial | Octahidro-1,1,3,3,4,5-hexametil-1H-indeno |
Clovanos
Aislado de Rumphella antipathies.[152]
 |
 |
| Clovano | 9α-hidroxiclovan-2-ona |
 |
 |
| 5,10-Secoclovano | Rumfelclovano B |
Capnelanos
Aislados del coral Capnella imbricata[155]
 |
 |
-Capnellene-8%252C10%252C13-triol.png.webp) |
| Capnelano | δ-Capneleno | 9(12)-Capneleno-8,10,13-triol |
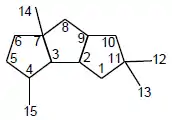
Cucumanos
Aislados de Macrocystidia cucumis
 |
 |
 |
| Cucumano | Cucumina E | Cucumina F |
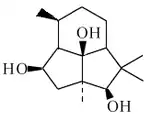
Presilfiperfolianos
Aislado de Senecio anteuphorbium[159] y de Echinops giganteus[160]
 |
 |
 |
| Presilfiperfoliano | (2β,5β,8β)-Presilfiperfolanotriol | Presilfiperfol-7-eno |
Aislado de Echinops giganteus var. lelyi[161]
-Abeopresilfiperfolano.png.webp) |
 |
| 11(7→8)-Abeopresilfiperfolano | 7-Camerunanol |
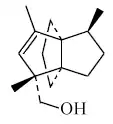
Modhefanos
Aislados de Liabum eggersii[164] e Isocoma wrightii[165]
 |
 |
 |
| Modhefano | 2-Modhefen-12-ol | 2-Modhefeno |
α-Santalanos
 |
| α-Santalano |
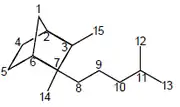
β-Santalanos
Aislados del aceite esencial del sándalo (Santalum album)[170]
 |
 |
-beta-santalol.svg.png.webp) |
| β-Santalano | Ácido β-santálico | β-Santalol |
Copacanfanos
 |
 |
| Copacanfano | Copacanfanol |
Tujopsanos (Tuyopsanos)
Aislados de plantas (Microbiota decussata[177]), hepáticas y hongos (Xylaria carpophila[178])
 |
 |
 |
 |
| Tujopsano | Tuyopsano | 7-Tuyopsanol | Xilcarpina C |
Referencias
- Paul M. Dewick (2009). Medicinal natural products: a biosynthetic approach. John Wiley and Sons. ISBN 9780470741689.
- K. Jenett-Siems, K. Siems, L. Witte and E. Eich, J. Nat. Prod. (2001) v.64:p.1471
- P. L. Metra and M. D. Sutherland. Tetrahedron Lett. (1983) v.24:p.1749
- On the biosynthesis of dendrolasin, a body constituent of the ant Lasius fuliginosus Latr. Waldner EE, Schlatter C, Schmid H. Helv Chim Acta. (1969) v.52(1):pp. 15-24.
- Fujita, T. et al., Chem. Pharm. Bull. (1984) 32, 4419
- Yoshihara, T. et al., Tet. Lett. (1985) 26:5551- 5554
- Koshino, H. et al., Agric. Biol. Chem. (1989) 53:789- 796
- Sutherland, M.D. et al., Aust. J. Chem. (1989) 42:1995
- Inayama, S. et al., Chem. Pharm. Bull., 1985, 33, 2179- 2182; 1986, 34, 5122- 5132
- Bohlmann, F. et al., Phytochemistry, 1978, 17, 1155
- Takano et al. Journal of Heterocyclic Chemistry. Volume 34, Issue 4, pages 1111–1114.
- Herout, Vlastimil; Benesova, Vera; Pliva, Josef (1953). "Terpenes. XLI. Sesquiterpenes of ginger oil". Collection of Czechoslovak Chemical Communications 18: 297–300.
- Bohlmann, F. et al., Phytochemistry, 1982, 21, 1697
- Hamasaki, T. et al., Agric. Biol. Chem., 1975, 39, 2337
- Liang, X.T. et al., Huaxue Xuebao, 1979, 37, 215- 230
- Allison, A.J. et al., Chem. Comm., 1968, 1493
- Joseph-Nathan, P. et al., Phytochemistry, 1982, 21, 1129
- Ohta, Y. et al., Tet. Lett., 1968, 1251
- Cool, L.G.Phytochemistry, 2005, 66, 249- 260
- Cool, L.G. et al., Phytochemistry, 1994, 36, 1283
- Piovetti, L. et al., Phytochemistry, 1977, 16, 103
- Hanayama, N. et al., Tetrahedron, 1973, 29, 945
- Pal, S.K. et al., Tet. Lett., 1998, 39, 8889- 8890
- Weyerstahl, P. et al., Flavour Fragrance J., 2000, 15, 61- 68; 395- 412
- Nagashima, F. et al., J. Nat. Prod., 2001, 64, 1309- 1317
- Wu, C.-L. et al., Tet. Lett., 1983, 39, 2657- 2661
- Cameron, A.F. et al., JCS(B), 1969, 692- 697
- Sun, J. et al., J. Nat. Prod., 2005, 68, 915- 919
- Grove J.F. Prog. Chem. Org. Nat. Prod. (2007) 88:63–130.
- Kwon et al., Biotechnology and Bioprocess Engineering (2010) 15(1): 167-172
- Connolly, J.D. et al., JCS Perkin 1, 1974, 2487- 2493
- Alexander, R. et al., Chem. Comm. (1983) 226- 228
- Appel, H.H., 1948. Scientia (Chile) 15, 31.
- Cordell, G.A. (1976) Chem. Rev., 76, 425.
- Djerassi, C. et al. (1958) J. Am. Chem. Soc., 80, 2593.
- Jansen, B.J.N. et al. (1991) Nat. Prod. Rep., 8, 309;319.
- Messchendorp, L., Gols, G.J.Z., van Loon, J.J.A., Entomol. Experiment. Appl. (2000) 95:217.
- Hlubucek, J.R. et al., Acta Chem. Scand., Ser. B, 1974, 28, 18
- Kubo, I. et al., Tet. Lett., 1977, 18, 4553- 4556
- El-Feraly, F.S. et al., Chem. Comm., 1978, 75- 76
- Brown, D.S. et al. (1992) Heterocycles, 34, 807.
- Fischer, N.H. et al. (1979) Prog. Chem. Org. Nat. Prod., 38, 47.
- Fischer, N.H. (1990) Recent Adv. Phytochem., 24, 161.
- Okada, K et al.. "Behavioral responses of male Periplaneta americana L. to female sex pheromone components, periplanone-A and periplanone-B". Journal of Chemical Ecology (1990) 16(9):2605–2614
- Osawa, T. et al., Tet. Lett., 1974, 1569
- Appendino, G. et al., Phytochemistry, 1983, 22, 509
- Bohlmann, F. et al., Phytochemistry, 1979, 18, 1892
- Öksüz, S. et al., Phytochemistry, 1986, 25, 535- 537
- Suleimenov, E.M. et al., Chem. Nat. Compd. (Engl. Transl.), 2005, 41, 556-
- Kupchan, S.M. et al., JOC, 1969, 34, 3908- 3911
- Herz, W. et al., JOC, 1980, 45, 4838
- Weyerstahl, P. et al., Flavour Fragrance J. (2000) 15: 61- 83
- Laekeman G. M. Naunyn-Schmiedeberg's Archives of Pharmacology (1985) Vol.331(1):108-113
- Von Rudloff, E. et al., Can. J. Chem., 1964, 42, 421- 425
- Bordoloi, M. et al. (1989) Phytochemistry 28(8):2007
- Manobjyoti Bordoloi, Vishunu S. Shukla, Subhan C. Nath, Ram P. Sharma. Naturally Occurring Cadinenes. Phytochemistry (1989) 28(8):2007-2037
- Bohlmann, F. et al., Chem. Ber., 1976, 109, 2021
- Chang, R.-C. et al., J. Chin. Chem. Soc. (Taipei), 1999, 46, 191- 195
- Ma, B. et al., Helv. Chim. Acta, 2007, 90, 52- 57
- Triana, J. et al., J. Nat. Prod., 2005, 68, 523- 531
- Ayoub, N.A. et al., Pharmazie, 2003, 58, 674- 676
- García, A. et al., Helv. Chim. Acta, 2006, 89, 16- 29
- Adio, A.M. et al., Phytochemistry, 2003, 64, 637- 644
- Marco, J.A. et al., Phytochemistry, 1994, 37, 477
- Ohira, S. et al., Phytochemistry, 1998, 47, 1577- 1581
- Fraga, B.M. et al., Z. Naturforsch., C, 2001, 56, 503- 505
- Rodriguez, E. et al., Phytochemistry, 1979, 18, 1741- 1742
- Banerjee, D.K.J. Indian Chem. Soc., 1972, 49, 1
- De Mayo, P. et al., Can. J. Chem., 1965, 43, 1357
- de Oliviera, A.B. et al., Phytochemistry, 1974, 13, 1199- 1204
- Itokawa, H. et al., Chem. Lett., 1983, 1253
- Iijima, T. et al., Chem. Pharm. Bull., 2003, 51, 545- 549
- Wang, Y.-F. et al., Chem. Biodiversity, 2007, 4, 925- 931
- Tada, M. et al., Bull. Chem. Soc. Jpn., 1977, 50, 463- 465
- Bilayet Hossain, M. et al., JACS, 1968, 90, 6607
- Hackl, T. et al., Phytochemistry, 2004, 65, 2261- 2275
- Pinder, A.R. Prog. Chem. Org. Nat. Prod. (1977) 34, 82.
- Paul, C. et al., Phytochemistry, 2001, 58, 789- 798
- Wu, C.-L. et al., Phytochemistry, 1992, 31, 4213
- Bishara, A. et al., J. Nat. Prod., 2008, 71, 375- 380
- Wang, G.-H. et al., Chem. Pharm. Bull., 2010, 58, 30- 33
- Schulte KE, Glauch G, Rücker G (1965). «Nardosinon, ein neuer Inhaltsstoff von Nardostachys chinensis Batalin» [Nardosinone, a new constituent of Nardostachys chinensis Batalin]. Tetrahedron Letters (en alemán) 6 (35): 3083-3084. PMID 5828044. doi:10.1016/S0040-4039(01)89226-1.
- Romo et al. The constituents of Cacalia decomposita A. Gray. Structures of cacaloland cacalone. Tetrahedron (1964) 20:2331-2337
- Fischer, N.H. et al. (1990) Recent Adv. Phytochem., 24, 161
- Spring, O. et al., Phytochemistry, 1995, 39, 609- 612
- Díaz, O.J. et al., Phytochemistry, 2004, 65, 2557- 2560
- Nyasse, B. et al., Phytochemistry, 1988, 27, 3319- 3321
- Xu, F. et al., J. Nat. Prod., 2004, 67, 569- 576
- Ahmed, A.F. et al., J. Nat. Prod., 2005, 68, 1208- 1212
- Chakraborty, K. et al., Eur. J. Med. Chem. (Chim. Ther.), 2010, 45, 2237- 2244
- Yoshikawa, M. et al., Chem. Pharm. Bull., 1998, 46, 1186- 1188
- Thiessen, W.E.Acta Cryst. B, 1977, 33, 3838- 3842
- Nagashima, F. et al., Phytochemistry, 2005, 66, 1662- 1670
- Herz, W. et al., JOC, 1966, 31, 3232
- Nerali, S.B. et al., Tet. Lett., 1967, 8, 2447- 2449
- Ruecker, G. et al., Phytochemistry, 1976, 15, 224
- Sonwa, M.M. et al., Phytochemistry, 2001, 58, 799- 810
- Bos, R. et al., Phytochemistry, 1986, 25, 133-
- Bohlmann, F. et al., Chem. Ber., 1980, 113, 2410-
- Hashidoko, Y. et al., Phytochemistry, 1991, 30, 3729- 3739; 1993, 32, 387- 390
- Macìas, F.A. et al., J. Nat. Prod., 2000
- Fraga, B.M. (1989) in Studies in Natural Products Chemistry, (ed. Atta-ur-Rahman) Elsevier, Amsterdam, p. 721.
- Gonzaléz, A.G. et al. (1995), Prog. Chem. Org. Nat. Prod., 64, 1.
- Hu, Y.-M. et al., Phytochemistry, 2008, 69, 2367- 2373
- Magnani, R.F. et al., Z. Naturforsch., C, 2003, 58, 319- 324
- Z. Yang et al. Chem. Pharm. Bull., 2011, 59, 1430.
- J. Ascari et al., J. Nat. Prod., 2011, 74, 1007.
- Weber, D. et al., Z. Naturforsch., C, 2006, 61, 663- 669
- Castillo, et al., Phytochemistry, 1997,44, 901
- Nozoe, S. et al., Tet. Lett., 1977, 1381
- Yang et al. Yaoxue Xuebao, 1991, 26, 117 (Chem. Abstr., 1991, 115, 89082).
- Arnone et al., J. Chem. Soc., Perkin Trans. 1, 1991, 1787.
- Weber, D. et al., Z. Naturforsch., C, 2006, 61, 663- 669
- Yoshikawa, K. et al., Chem. Pharm. Bull., 2009, 57, 311- 314
- Ayer et al. Tetrahedron Lett., 1980, 21, 1917
- Wang, G.-Y.-S. et al., Tetrahedron, 1998, 54, 7335- 7342
- Gao, J. et al., Acta Pharm. Sci., 1992, 27, 33- 36
- Seto, H. et al., Tet. Lett., 1978, 19, 4411- 4412
- Lin, L.-G. et al., J. Nat. Prod., 2008, 71, 628- 632
- Hu, J.-F. et al., J. Antibiot., 2003, 56, 747- 754
- Jurek, J. et al., J. Nat. Prod., 1993, 56, 508- 513
- Bohlmann, F. et al., Phytochemistry, 1978, 17, 1669
- Bohlmann, F. et al., Phytochemistry, 1983, 22, 503
- De Pascual Teresa, J. et al., Phytochemistry, 1986, 25, 1185- 1190
- Dev, S. Prog. Chem. Org. Nat. Prod. (1981) 40:49.
- Akiyoshi, S. et al., Tetrahedron, 1960, 9, 237- 239
- Barlow, A.J. et al., J. Nat. Prod., 2005, 68, 825- 831
- Naegeli, P. et al., Tet. Lett., 1970, 11, 5021- 5024
- Akhila, A. et al., Tet. Lett., 1986, 27, 5885- 5888
- De Pascual Teresa, J. et al., Phytochemistry, 1986, 25, 703
- Yaoita, Y. et al., Chem. Pharm. Bull., 2003, 51, 1003- 1005
- Asakawa, Y. et al., Phytochemistry, 1978, 17, 457- 460
- Asakawa, Y. et al., J. Chem. Res., Synop., 1987, 82
- Connolly, J.D.Proc. Phytochem. Soc. Eur., 1990, 29, 41
- Tori, M. et al., Phytochemistry, 1993, 32, 335
- Fischer, N.H. et al. Prog. Chem. Org. Nat. Prod. (1979) 38: 47.
- Zhao, W. et al., J. Nat. Prod., 2001, 64, 1196- 1200
- Clark, E.P.JACS, 1935, 57, 1111
- Jarboe, C.H. et al., J. Med. Chem., 1968, 11, 729- 731
- Howard, B.M. et al., Phytochemistry, 1979, 18, 1224- 1225
- Paul, C. et al., Phytochemistry, 2001, 57, 307- 313
- El Dahmy, S. et al., Tetrahedron, 1985, 41, 309
- Ayer, W.A. et al., Tetrahedron, Suppl., No. 1, 1981, 379
- Magnusson, G. et al., Acta Chem. Scand., 1973, 27, 1573; 2396
- Cruz, Can. J. Chem., 1997, 75, 834.
- Bosetti, A. et al., Phytochemistry, 1989, 28, 1427
- Daniewski, W.M. et al., Bull. Acad. Pol. Sci., Ser. Sci. Chim., 1975, 23, 639- 641
- Daniewski, W.M. et al., Bull. Acad. Pol. Sci., Ser. Sci. Chim., 1970, 18, 585
- Sterner, O. et al., Tetrahedron, 1990, 46, 2389
- Ayer, W. A.; Cruz, E. R. J. Org. Chem. (1993) 58:7529–7534.
- Liu, D.-Z. et al., J. Nat. Prod., 2007, 70, 1503- 1506
- Chung et al. Bull.Chem. Soc. Jpn., 2011, 84, 119
- Ayanoglu, E. et al., Tetrahedron, 1979, 35, 1035- 1039
- Norte, M. et al., Tet. Lett., 1994, 35, 4607
- Chang, C.-H. et al., J. Nat. Prod., 2008, 71, 619- 621
- Pedras, M.S.C. et al., Bioorg. Med. Chem. Lett., 1999, 9, 3291- 3294
- Pedras, M.S.C. et al., Bioorg. Med. Chem., 2005, 13, 2469- 2475
- Weyerstahl, P. et al., Phytochemistry, 1991, 30, 3349
- Bohlmann, F. et al., Phytochemistry, 1982, 21, 1331
- Collado et al. Nat. Prod. Rep.,1998, 15, 187
- Weyerstahl, P. et al., Eur. J. Org. Chem., 1998, 1205- 1212
- Bohlmann, F. et al., Phytochemistry, 1983, 22, 1623
- Yoshihara, K. et al., Bull. Chem. Soc. Jpn., 1975, 48, 2078
- Bohlmann, F. et al., Phytochemistry, 1980, 19, 579- 582
- Zalkow, L.H. et al., J. Nat. Prod., 1979, 42, 96
- Nakagawa, M. et al., Agric. Biol. Chem., 1984, 48, 2279- 2283
- Ranieri, R.L.Tet. Lett., 1978, 19, 499- 502
- Hikino, H. et al., Tet. Lett., 1967, 5069
- Ngo, K.-S. et al., Phytochemistry, 1999, 50, 1213- 1218
- Buchbauer, G. et al., Annalen, 1990, 119- 121
- de Mayo, P. et al., JACS, 1965, 87, 3275
- Homma, A. et al., Tet. Lett., 1970, 231
- Beechan, C.M. et al., Tet. Lett., 1977, 2395- 2398
- Braekman, J.C. et al., Tetrahedron, 1981, 37, 179- 186
- Kapadia, V.H. et al., Tet. Lett., 1967, 4661
- Bohlmann, F. et al., Phytochemistry, 1981, 20, 1649
- Raldugin, V.A. et al., Khim. Prir. Soedin., 1981, 17, 163- 169; Chem. Nat. Compd. (Engl. Transl.), 124- 129
- Yin et al. Nat.Prod. Bioprospect., 2011, 1, 75
- Ito, S. et al., Tet. Lett., 1974, 1041- 1043
- Cheng, S.-Y. et al., J. Nat. Prod., 2007, 70, 1449- 1453


.jpg.webp)