Tetril
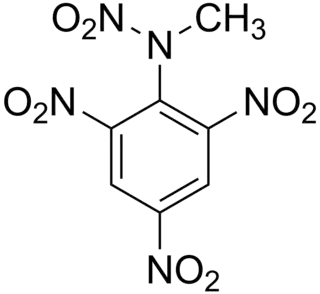
El nombre químico del tetril es 2,4,6-trinitrofenil-N-metilnitramina. Algunos otros nombres usados comúnmente son "nitramina", "tetryl" y "tetralita".
| Tetril | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| N-metil-N,2,4,6-tetranitroanilina | ||
| General | ||
| Fórmula semidesarrollada | C7H5N5O8 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 479-45-8[1] | |
| Propiedades físicas | ||
| Apariencia | cristales amarillentos | |
| Densidad | 1,73 kg/m³; 0,00173 g/cm³ | |
| Masa molar | 287,15 g/mol | |
| Punto de fusión | 129,5 °C (403 K) | |
| Compuestos relacionados | ||
| trinitrotolueno | trinitrotolueno | |
| hexanitrobenceno | hexanitrobenceno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tetril (C7H5N5O8) es un sólido sintético cristalino, sin olor, que no se encuentra en la naturaleza. Bajo ciertas condiciones, el tetril puede existir en el aire como polvo. Es poco soluble en agua y en otros líquidos.
El tetril es un nitramina explosiva de refuerzo, aunque su uso ha sido ampliamente superada por RDX. El tetril es un explosivo sensible secundaria avanzada que se utiliza como refuerzo, una pequeña carga colocada junto a un detonador con el fin de propagar la detonación en la carga explosiva principal.
El tetril fue usado para fabricar explosivos, principalmente durante las Primera y Segunda Guerra Mundial. Ya no se fabrica ni se utiliza en los Estados Unidos (hay abastecimientos de tetril almacenados en instalaciones militares que el Departamento de Defensa está destruyendo).
Propiedades químicas
El tetril se encuentra en estado puro en cristales casi incoloro, que expuesto a la luz rápidamente se convierte en un color amarillo claro. El producto técnico es amarillo. Su estructura se publicó en 1967.[2] El compuesto funde a 129,5 °C con una entalpía de fusión 22,93 kJ mol -1.[3] Reacciona con bases acuosas con eliminación del grupo metilnitramin. Por lo tanto, las trazas restantes de ácido en el producto bruto sólo se puede quitar mediante una cuidadosa recristalización.
El Tetril es prácticamente insoluble en agua, ligeramente soluble en etanol y éter pero soluble en acetona, benceno y otros disolventes.[4] Cuando tetril se calienta, se derrite primero, y luego se descompone y explota. Se quema con facilidad y es más fácil de detonar que el picrato de amonio[5] o TNT, por ser tan sensible como el ácido pícrico. Se hizo estallar por fricción, choque, o una chispa. Se mantiene estable a todas las temperaturas que pueden darse en el almacenamiento.
Propiedades explosivas
El tetril es un explosivo muy sensible[4] Entre los indicadores importantes de explosión son los siguientes:[4]
- Entalpía de la explosión: 4251 kJ · kg-1 (H2O (l)), 4153 kJ · kg-1 (H2O (g))
- Velocidad de detonación: 7850 m · s-1 a una densidad de 1,71 g · cm -3
- Volumen de los gases de explosión: 939 l · kg-1
- Energía específica: 1213 kJ · kg-1
- Temperatura de deflagración: 185 a 195 °C
- Ensayo de Trauzl: 41 cm³ / 10 g
- Sensibilidad al impacto: 3 N · m
- Sensibilidad a la fricción: 353 pin de carga N
- Prueba del casquillo de acero: diámetro crítico 6 mm
Uso
El tetril, descubierto y descrito por Romburgh en 1883.[6] Se ha utilizado principalmente durante la Primera Guerra Mundial (con la ventaja de que su producción no consume los mismos productos que muchos otros explosivos) y la Segunda Guerra Mundial y la otros conflictos de su sucesor.
Se utiliza generalmente en forma de pastillas prensadas, y ha sido aprobado como la carga de ruptura estándar para proyectiles de pequeño calibre, ya que da fragmentación mucho mejor que el TNT. También tiene una mayor potencia rompedora que cualquier otro alto explosivo militar y tiene una velocidad explosiva es 23,600-23,900 pies por segundo. El tetril es la base para los servicios de tetril cápsulas detonantes necesarios para la detonación del TNT. Una mezcla de fulminato de mercurio y clorato potásico se incluye en la cápsula para asegurar la detonación del tetril.
El tetril se utilizó principalmente durante las dos Guerras Mundiales, Primera y Segunda y conflictos posteriores. El tetril se utiliza generalmente solo, aunque a veces se pueden encontrar en composiciones tales como tetrytol. El Tetril fue empleado principalmente en detonadores y cordón detonante. En Alemania durante la Primera Guerra Mundial se empleaba una mezcla de TNT y tetril como carga de proyectiles de artillería y de torpedos. Para lo cual se fundían ambos compuestos y se vertían a la cabeza de combate donde solidificaban. El tetril ya no se fabrica o se utilizan en Estados Unidos ni en otros muchos países, pero aún se pueden encontrar en las municiones existentes, como las minas terrestres antipersona M14.[7] Ha sido sustituido por hexógeno y pentrita, aunque ambos son ligeramente sensible al impacto.
Síntesis
El tetril se produce simplemente mezclando lentamente dimetilanilina con ácido nítrico concentrado en presencia de ácido sulfúrico.
Toxicidad
A pesar de tetril es uno de los compuestos explosivos más tóxicos, es de muy corta duración ya que se degrada rápidamente. Esto, combinado con el hecho de que los impactos en la salud de este compuesto en gran parte sin estudiar, no se sabe mucho acerca de los problemas de salud que este compuesto puede causar. Es irritante para las vías respiratorias y causa sensibilización, dermatitis de contacto, y coloración amarillenta de la piel. A pesar de las precauciones tomadas, sobre todo en la década de 1940, muchos trabajadores que estaban en contacto enfermaban o contraían alérgias.[6]
Casi un siglo después de la primera descripción de esta molécula por Romburgh (en 1883 ), los toxicólogos de EE. UU. (en 1980) demostrarón que el tetril (a las diferencias de otros explosivos como el PETN (tetranitrato de pentaeritritol), RDX (1,3,5-trinitrohexahydro-1,3,5-triazina y HMX (octahidro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine), es un potente mutágeno, actuando directamente y en dosis muy bajas en los tres sistemas convencionales utilizados para las pruebas de mutagenicidad microbiana (Neurospora crassa, Salmonella typhimurium y Saccharomyces cerevisiae).[8]
Impacto ambiental
Los compuestos más tóxicos de las municiones, el tetril y el 1,3,5-TNB, son también los más degradable. Por tanto, estos productos químicos se espera que sea de corta duración en la naturaleza, y no se espera impactos ambientales en las zonas que actualmente no están sujetas a las entradas crónicas de estos productos químicos. El tetril se descompone rápidamente en soluciones metanol/agua, así como con calor. Todas las muestras acuosas sospechosas de contener tetril debe diluirse con acetonitrilo antes de filtrar y se acidifica a pH <3. No deben ser expuestas a temperaturas superiores a la temperatura ambiente. Además, los productos de degradación de tetril aparecer como un hombro sobre el pico de 2,4,6-TNT. La alturas del pico en lugar del áreas se debe utilizar cuando tetril está presente en concentraciones que son significativo en relación con la concentración de 2,4,6-TNT.[5]
Referencias
- Número CAS
- H. H. Cady, The crystal structure of N-methyl-N-2, 4, 6-tetranitroaniline (tetryl); Acta Crystallographica, 1967 scripts.iucr.org
- Krien, G.; Licht, H.H.; Zierath, J.: Thermochemical investigation of nitramines, in: Thermochim. Acta, 1973, 6, S. 465–472.
- Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage, Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- http://www.globalsecurity.org/military/systems/munitions/explosives-booster.htm
- Leon J. Witkowski, M.D.; Carl N. Fisher, M.D.; Howard D. Murdock, M.S, Industrial illness due to tetryl report of 1258 cases; AMA. 1942;119(17):1406-1409. doi: 10.1001/jama.1942.02830340018005 (Début du texte)
- “A Military Guide to Terrorism in the 21st Century.” August 2003. P. 171. U.S. Army Training and Doctrine Command, Fort Leavenworth, Kansas. http://smallwarsjournal.com/documents/terrorismhandbook.pdf. Accessed May 11, 2010.
- Whong Wen-Zong, Norman D. Speciner, Gordon S. Edwards, Mutagenic activity of tetryl, a nitroaromatic explosive, in three microbial test systems ; Toxicology Letters Volume 5, Issue 1, January 1980, Pages 11–17 (résumé)
Enlaces externos
- ATSDR en Español - ToxFAQs™: Tetril (2,4,6-trinitrofenil-N-metilnitramina): Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)