Vacuna de Moderna contra la COVID-19
La vacuna de Moderna contra la COVID-19, cuyo nombre comercial es Spikevax,[1] (DCI: Elasomerán,[2] nombre en clave mRNA-1273) es una vacuna contra la COVID-19 desarrollada por el Instituto Nacional de Alergias y Enfermedades Infecciosas, la Autoridad de Investigación y Desarrollo Biomédico Avanzado (BARDA), ambas instituciones de los Estados Unidos, y la empresa Moderna. Es administrada por inyección intramuscular. Esta vacuna recibió una autorización de uso de emergencia por parte de la Administración de Medicamentos y Alimentos estadounidense el 18 de diciembre de 2020.[3] Se autorizó su uso en Canadá el 23 de diciembre de 2020[4][5] y en la Unión Europea el 6 de enero de 2021.[6]
| Vacuna de Moderna contra la COVID-19 Elasomerán | ||
|---|---|---|
 | ||
| Descripción de la vacuna | ||
| Enfermedad obj. | COVID-19 | |
| Tipo | Vacuna de ARN | |
| Identificadores | ||
| Código ATC | J07BX03 | |
| DrugBank | DB15654 | |
| UNII | EPK39PL4R4 | |
| Datos clínicos | ||
| Nombre comercial | Spikevax[1] | |
| Vías de adm. | Inyección intramuscular | |
Diseño
En enero de 2020, Moderna anunció el desarrollo de una vacuna de ARN, llamada mRNA-1273, para desarrollar inmunidad al virus SARS-CoV-2.[7][8][9] La tecnología de Moderna se basa en un compuesto de ARN mensajero modificado con nucleósidos (modARN) denominado ARNm-1273, que produce inmunidad al codificar una proteína estabilizada por prefusión presente de forma natural en la superficie de las partículas del SARS-CoV-2. Desde el anuncio, las acciones de Moderna subieron drásticamente y el director ejecutivo y otros ejecutivos corporativos comenzaron a realizar grandes ventas de sus acciones.[10]
El sistema de administración de fármacos del ARNm-1273 utiliza un sistema con nanopartículas lipídicas pegiladas (LNP).[11] Cuenta entre sus excipientes con el lípido SM-102, colesterol, 1,2-diestearoil-sn-glicero-3-fosfocolina (DSPC), polietilenglicol, trometamol, clorhidrato de trometamol, ácido acético, acetato de sodio trihidrato y sacarosa.[12]
Eficacia
La evidencia médica afirma que la eficacia de la vacuna comienza dos semanas tras la primera dosis.[13] Se consigue una mayor eficacia a través de la inmunización completa, dos semanas tras la segunda dosis, y según los datos publicados, esta es del 94,1 %. En el estudio por el cual se le otorgó su uso de emergencia en EE. UU., se dieron once casos de COVID-19 en el grupo vacunado (de un total de 15 181 sujetos); mientras que en el grupo placebo se infectaron 185 personas.[13] Además, no se produjo ningún caso de COVID-19 grave en el grupo vacunado, al contrario que en el grupo placebo, en el que hubo once casos.[14] La eficacia es similar a la de la vacuna de Pfizer-BioNTech.[15][16]
La eficacia demostró ser similar sin distinción de grupo de edad, género y grupo racial o étnico; así como los participantes con comorbilidades asociadas a un mayor riesgo de desarrollar COVID-19 grave.[17] Los estudios solo incluyeron a sujetos de 18 o más años de edad, aunque existen otros en curso para evaluar la eficacia y seguridad en sujetos de 0–11 (KidCOVE) y 12–17 (TeenCOVE) años.[18]
Otro estudio llevado a cabo por la agencia estadounidense Centros para el Control y Prevención de Enfermedades entre diciembre de 2020 y marzo de 2021 que empleó a profesionales sanitarios y otros trabajadores esenciales como sujetos concluyó que, en condiciones reales, las vacunas de ARNm en pauta completa (14 días o más tras la segunda dosis) son eficaces en un 90 % ante la infección, mientras que una pauta parcial (14 días o más tras la primera dosis pero antes de la segunda) es eficaz en un 80 %.[19]
La duración de la protección proporcionada por la vacuna aún es desconocida a abril de 2021, aunque existe un estudio en curso que tiene como objetivo evaluarla a lo largo de un período de dos años.[20]
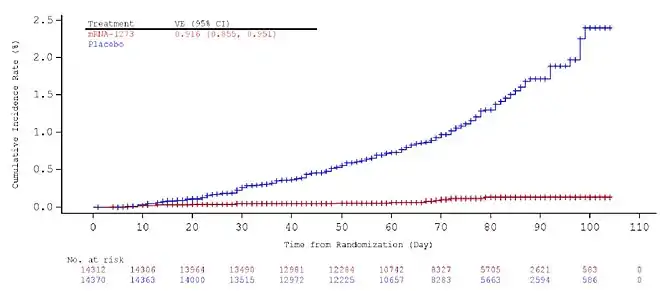
El análisis de eficacia se basó en ensayos clínicos doble ciego. Todos los participantes (28 000) partían con un estado inicial negativo de SARS-CoV-2. Recibieron 2 dosis del producto en investigación por programa sin desviaciones importantes del protocolo. El criterio de valoración principal fue la eficacia de la vacuna (EV) para prevenir que el COVID-19 definido por el protocolo se produzca al menos 14 días después de la segunda dosis. Los casos fueron adjudicados por un comité ciego. El criterio de eficacia principal de éxito se cumpliría si la hipótesis nula de VE ≤ 30 % fuera rechazada en el análisis intermedio o primario. El análisis de eficacia presentado se basa en los datos del primer momento del análisis intermedio preespecificado que consta de 95 casos adjudicados. Los datos se presentan a continuación:
| Criterio de valoración principal: COVID-19 | Grupo de vacuna (N=13,934)
Casos n (%) Incidencia por 1000 personas-año |
Grupo placebo (N=13,883)
Casos n (%) Incidencia por 1000 personas-año |
% eficacia calculada de la vacuna
(Intervalo de confianza del 95%) |
|---|---|---|---|
| Todos los participantes | 5 casos en 13,934 (<0.1%)
1.840 |
90 casos (0.6%)
33.365 |
94.5% (86.5-97.8%) |
| Participantes de 18 a 64 años | 5 casos en 10,407 (<0.1%)
2.504 |
75 casos en 10,384 (0.7%)
37.788 |
93.4% (83.7-97.3%) |
| 65 años o más | 0 casos en 3,527 | 15 casos en 3,499 (0.4%) | 100% |
| Enfermedad pulmonar crónica | 0/661 | 6/673 | 100% |
| Enfermedad cardíaca significativa | 0/686 | 3/678 | 100% |
| Obesidad severa (IMC> 40) | 1/901 | 11/884 | 91.2% (32-98.9%) |
| Diabetes | 0/1338 | 7/1309 | 100% |
| Enfermedad del hígado | 0/93 | 0/90 | |
| Obesidad (IMC> 30) | 2/5269 | 46/5207 | 95.8% (82.6-99%) |
En el análisis de subgrupos por raza y etnia, la eficacia de la vacuna fue del 100 % en indios americanos, asiáticos, afroamericanos y hawaianos nativos.
Eficacia en menores de edad
El 25 de mayo de 2021, un estudio de la eficacia de la vacuna en niños de 12 a 18 años elaborado por Moderna, con un tamaño de la muestra de 3700 sujetos, concluyó que esta es 100% eficaz a la hora de prevenir los síntomas de COVID-19. El estudio no encontró efectos secundarios severos, dándose solo casos de síntomas leves similares a los ocurridos en adultos como fatiga, dolor de cabeza, dolor muscular y escalofríos.[22]
Fabricación
_C.jpg.webp)
Moderna depende en gran medida de las organizaciones de fabricación por contrato para ampliar su proceso de fabricación de vacunas. Moderna ha contratado a Lonza Group para fabricar su vacuna en las instalaciones de Portsmouth (Nuevo Hampshire) y Visp, Suiza, y está comprando los excipientes lipídicos necesarios de CordenPharma. Para las tareas de llenado y envasado de viales, Moderna ha realizado contratos con Catalent en Estados Unidos y Laboratorios Rovi en España.[23]
Almacenamiento
La vacuna de moderna puede ser almacenada a la temperatura normal de un frigorífico médico estándar de 2—8 °C durante treinta días, o a una temperatura de -20 °C hasta cuatro meses.[24][25] Los países con menos recursos a menudo poseen infraestructura de cadena de frío para el almacenamiento en frigoríficos, pero no para la ultracongelación; esto implica que el transporte y distribución de la vacuna de Moderna resulte más viable respecto a otras vacunas para la COVID-19 que requieren ser almacenadas en temperaturas más bajas.[26][27]
.jpg.webp) Envío de vacunas de Moderna en un paquete con aislamiento térmico mediante bolsas de hielo |
_(cropped).jpg.webp) Vacuna de moderna almacenada en un frigorífico convencional |
Controversias
En mayo de 2020, después de publicar los resultados parciales en la etapa preliminar previa a la Fase I, el CEO anunció en CNBC una emisión inmediata de derechos de 1,250 millones de dólares para recaudar fondos para la empresa, con una valoración de 30 mil millones de dólares.[28]
El 7 de julio de 2020, se revelaron disputas entre Moderna y científicos del gobierno de Estados Unidos por la tardanza a la hora de compartir datos de los ensayos clínicos por parte de la compañía.[29]
Moderna también enfrentó críticas por no reclutar personas de color en los ensayos clínicos.[30]
Véase también
Referencias
- European Medicines Agency (EMA). «Spikevax (previously COVID-19 Vaccine Moderna)». Consultado el 26 de julio de 2021.
- Administration, Australian Government Department of Health Therapeutic Goods (24 de junio de 2021). «TGA grants provisional determination for the Moderna COVID-19 vaccine, Elasomeran». Therapeutic Goods Administration (TGA) (en inglés). Consultado el 25 de julio de 2021.
- «Statement from NIH and BARDA on the FDA Emergency Use Authorization of the Moderna COVID-19 Vaccine» (en inglés). Instituto Nacional de la Salud de EE.UU. 18 de diciembre de 2020. Consultado el 27 de diciembre de 2020. el 18 de diciembre de 2020.
- «Regulatory Decision Summary - Moderna COVID-19 Vaccine». Health Canada (en inglés). 23 de diciembre de 2020. Consultado el 23 de diciembre de 2020.
- «Moderna COVID-19 Vaccine (mRNA-1273 SARS-CoV-2)». COVID-19 vaccines and treatments portal (en inglés). 23 de diciembre de 2020. Consultado el 27 de diciembre de 2020.
- url=https://www.ema.europa.eu/en/medicines/human/EPAR/covid-19-vaccine-moderna
- Steenhuysen, Julie; Kelland, Kate (24 de enero de 2020). «With Wuhan virus genetic code in hand, scientists begin work on a vaccine» (en inglés). Reuters. Consultado el 27 de diciembre de 2020.
- Carey, Karen (26 de febrero de 2020). «Increasing number of biopharma drugs target COVID-19 as virus spreads» (en inglés). BioWorld. Consultado el 27 de diciembre de 2020.
- Everett, Gwen (27 de febrero de 2020). «These 5 drug developers have jumped this week on hopes they can provide a coronavirus treatment» (en inglés). Markets Insider. Consultado el 27 de diciembre de 2020.
- Pendleton, Devon; Maloney, Tom (18 de mayo de 2020). «MIT Professor's Moderna Stake on the Brink of Topping $1 Billion». Bloomberg News (en inglés). Consultado el 27 de diciembre de 2020.
- Auth, Dorothy R.; Powell, Michael B. (14 de septiembre de 2020). «Patent Issues Highlight Risks of Moderna's COVID-19 Vaccine». New York Law Journal (en inglés). Consultado el 27 de diciembre de 2020.
- «Ficha técnica». Agencia Española del Medicamento. Consultado el 30 de abril de 2021.
- «Background document on the mRNA-1273 vaccine (Moderna) against COVID-19», World Health Organization.
- «Vaccines and Related Biological Products Advisory Committee Meeting». Food and Drug Administration. 17 de diciembre de 2020.
- Mishra SK, Tripathi T (February 2021). «One year update on the COVID-19 pandemic: Where are we now?». Acta Trop 214: 105778. PMC 7695590. PMID 33253656. doi:10.1016/j.actatropica.2020.105778.
- Meo SA, Bukhari IA, Akram J, Meo AS, Klonoff DC (February 2021). «COVID-19 vaccines: comparison of biological, pharmacological characteristics and adverse effects of Pfizer/BioNTech and Moderna Vaccines». Eur Rev Med Pharmacol Sci 25 (3): 1663-1669. PMID 33629336. doi:10.26355/eurrev_202102_24877.
- «VRBPAC mRNA-1273 Sponsor Briefing Document» (PDF). Moderna. 17 de diciembre de 2020.
- Jenco, Melissa (16 de marzo de 2021). «Moderna testing COVID-19 vaccine in children under 12».
- Thompson MG, Burgess JL, Naleway AL, Tyner HL, Yoon SK, Meece J, Olsho LE, Caban-Martinez AJ, Fowlkes A, Lutrick K, Kuntz JL, Dunnigan K, Odean MJ, Hegmann KT, Stefanski E, Edwards LJ, Schaefer-Solle N, Grant L, Ellingson K, Groom HC, Zunie T, Thiese MS, Ivacic L, Wesley MG, Lamberte JM, Sun X, Smith ME, Phillips AL, Groover KD, Yoo YM, Gerald J, Brown RT, Herring MK, Joseph G, Beitel S, Morrill TC, Mak J, Rivers P, Harris KM, Hunt DR, Arvay ML, Kutty P, Fry AM, Gaglani M (April 2021). «Interim Estimates of Vaccine Effectiveness of BNT162b2 and mRNA-1273 COVID-19 Vaccines in Preventing SARS-CoV-2 Infection Among Health Care Personnel, First Responders, and Other Essential and Frontline Workers – Eight U.S. Locations, December 2020 – March 2021». MMWR Morb Mortal Wkly Rep 70 (13): 495-500. PMID 33793460. doi:10.15585/mmwr.mm7013e3.
 Este artículo incorpora texto de esta fuente, la cual está en el dominio público.
Este artículo incorpora texto de esta fuente, la cual está en el dominio público. - «Moderna Vaccine Shows Significant COVID-19 Prevention Efficacy in Phase 3 Data».
- FDA Briefing Document (17 de diciembre de 2020). «Vaccines and Related Biological Products Advisory Committee Meeting». Consultado el 27 de diciembre de 2020.
- Boseley, Sarah (25 de mayo de 2021). «Moderna jab stops Covid transmission in people aged 12 to 18, trial finds». The Guardian (en inglés). Consultado el 25 de mayo de 2021.
- «Pfizer, Moderna ready vaccine manufacturing networks» (en inglés). American Chemical Society. 25 de noviembre de 2020. Consultado el 27 de diciembre de 2020.
- «Pfizer-BioNTech COVID-19 Vaccine Vaccination Storage & Dry Ice Safety Handling». Pfizer. Archivado desde el original el 24 de enero de 2021. Consultado el 17 de diciembre de 2020.
- CDC. «Moderna COVID-19 VaccineStorage and Handling Summary». Consultado el 16 de mayo de 2021.
- «How China's COVID-19 could fill the gaps left by Pfizer, Moderna, AstraZeneca». Fortune. 5 de diciembre de 2020. Archivado desde el original el 12 de diciembre de 2020. Consultado el 5 de diciembre de 2020.
- «Pfizer's Vaccine Is Out of the Question as Indonesia Lacks Refrigerators: State Pharma Boss». Jakarta Globe. 22 de noviembre de 2020. Archivado desde el original el 7 de diciembre de 2020. Consultado el 5 de diciembre de 2020.
- «Los resultados de la vacuna de Moderna impulsaron su oferta de acciones, y no es una coincidencia.» [The results of Moderna's vaccine boosted its stock offering, and it's no coincidence.]. Los Angeles Times (en inglés). 19 de mayo de 2020.
- «Moderna discute con científicos estadounidenses sobre los ensayos de la vacuna COVID-19» [Moderna discusses COVID-19 vaccine trials with US scientists]. Reuters (en inglés). 7 de julio de 2020.
- «Los contratistas de ensayos de vacunas de Moderna no logran inscribir a suficientes personas de color, lo que provoca una desaceleración». NBC News (en inglés). 6 de octubre de 2020.