α-amylase
L'α-amylase (ou diastase ou takadiastase) fut la toute première enzyme qui fut découverte en 1833 par Anselme Payen et Jean-François Persoz[2].
| α-Amylase | ||
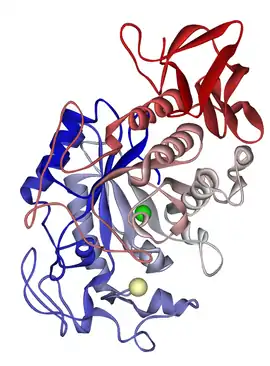 Structure d'une α-amylase pancréatique humaine (PDB 1HNY) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | AMY | |
| N° EC | 3.2.1.1 | |
| Code ATC | A09 | |
| Gène AMY1A — α-Amylase 1A (salivaire) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 768 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène AMY1B — α-Amylase 1B (salivaire) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 768 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène AMY1C — α-Amylase 1C (salivaire) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 768 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène AMY2A — α-Amylase 2A (pancréatique) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 707 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène AMY2B — α-Amylase 2B (pancréatique) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 710 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
L'α-amylase (EC ) est une enzyme digestive classée comme glycosidase (enzyme qui hydrolyse les polysaccharides). C'est un constituant du suc pancréatique et de la salive, requis pour le catabolisme des glucides à longue chaîne (comme l'amidon) en unités plus petites.
Elle est également synthétisée dans les fruits de beaucoup de plantes durant leur maturation (c'est ce qui rend leur goût si doux et sucré), et aussi pendant la germination des graines. L'amylase est entre autres responsable de la production de malt.
Types
Il y a deux iso-enzymes de l'amylase : l'amylase salivaire (ou amylase 1 ou ptyaline[3]) et l'amylase pancréatique (ou amylase 2). Elles se comportent différemment en focalisation isoélectrique, et peuvent être séparées en testant par les anticorps monoclonaux spécifiques.
Mécanisme d'action
L'α-amylase brise les liaisons α(1→4)glycosidiques à l'intérieur des chaînes de l'amylose et de l'amylopectine pour donner des molécules de maltose (disaccharides de α-glucose).
Elle possède un site de liaison donc participe à l'élaboration de la pellicule acquise exogène. Elle se lie avec affinité au S. viridans ce qui conduit à sa clairance ou à son adhésion selon que l'amylase est en solution ou absorbée à la surface dentaire. L'amylase liée à une bactérie conserve environ 50 % de son activité enzymatique. La bactérie liée à l'amylase peut donc fermenter l'acide glutamique que celle-ci produit en acide organique.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
Génétique
Chez l'Homme, toutes les iso-amylases sont liées au chromosome 1q21.
L'enzyme peut être détectée en la mélangeant à son substrat pour obtenir un ou plusieurs produits. Dans ce cas, cette enzyme possède un substrat qui est l'amidon. Ces produits seront le maltose, diholoside réducteur qui pourra être détecté grâce à la liqueur de Fehling.
Pathologies
Des niveaux anormaux d'amylase ont été trouvés dans des cas de :
- traumatismes salivaires (incluant les problèmes liés à l'intubation pendant une anesthésie)
- oreillons (provoquant l'inflammation des glandes salivaires)
- pancréatite (à cause des dommages créés sur les cellules productrices d'amylase)
- problèmes rénaux (à cause d'une sécrétion réduite).
En général, une quantité d'enzymes plus de 10 fois supérieure à la normale est un des symptômes de la pancréatite. Lorsque la quantité est de l'ordre de 5 à 10 fois le taux normal, cela peut indiquer des problèmes duodénaux ou rénaux. Parfois, on peut trouver une faible augmentation d'amylase dans la salive sans que ce soit pathogène.
Séquence
Les cinq α-amylases humaines comportent chacune 496 acides aminés. Les différences entre elles sont très petites (les amylases 1A, 1B et 1C sont identiques). Le tableau qui suit donne la comparaison des cinq chaînes.
α-amylase 1A : (001-060) MKLFWLLFTI GFCWAQYSSN TQQGRTSIVH LFEWRWVDIA LECERYLAPK GFGGVQVSPP
α-amylase 1B : (001-060) MKLFWLLFTI GFCWAQYSSN TQQGRTSIVH LFEWRWVDIA LECERYLAPK GFGGVQVSPP
α-amylase 1C : (001-060) MKLFWLLFTI GFCWAQYSSN TQQGRTSIVH LFEWRWVDIA LECERYLAPK GFGGVQVSPP
α-amylase 2A : (001-060) MKFFLLLFTI GFCWAQYSPN TQQGRTSIVH LFEWRWVDIA LECERYLAPK GFGGVQVSPP
α-amylase 2B : (001-060) MKFFLLLFTI GFCWAQYSPN TQQGRTSIVH LFEWRWVDIA LECERYLAPK GFGGVQVSPP
α-amylase 1A : (061-120) NENVAIHNPF RPWWERYQPV SYKLCTRSGN EDEFRNMVTR CNNVGVRIYV DAVINHMCGN
α-amylase 1B : (061-120) NENVAIHNPF RPWWERYQPV SYKLCTRSGN EDEFRNMVTR CNNVGVRIYV DAVINHMCGN
α-amylase 1C : (061-120) NENVAIHNPF RPWWERYQPV SYKLCTRSGN EDEFRNMVTR CNNVGVRIYV DAVINHMCGN
α-amylase 2A : (061-120) NENVAIYNPF RPWWERYQPV SYKLCTRSGN EDEFRNMVTR CNNVGVRIYV DAVINHMCGN
α-amylase 2B : (061-120) NENVAIHNPF RPWWERYQPV SYKLCTRSGN EDEFRNMVTR CNNVGVRIYV DAVINHMSGN
α-amylase 1A : (121-180) AVSAGTSSTC GSYFNPGSRD FPAVPYSGWD FNDGKCKTGS GDIENYNDAT QVRDCRLSGL
α-amylase 1B : (121-180) AVSAGTSSTC GSYFNPGSRD FPAVPYSGWD FNDGKCKTGS GDIENYNDAT QVRDCRLSGL
α-amylase 1C : (121-180) AVSAGTSSTC GSYFNPGSRD FPAVPYSGWD FNDGKCKTGS GDIENYNDAT QVRDCRLSGL
α-amylase 2A : (121-180) AVSAGTSSTC GSYFNPGSRD FPAVPYSGWD FNDGKCKTGS GDIENYNDAT QVRDCRLTGL
α-amylase 2B : (121-180) AVSAGTSSTC GSYFNPGSRD FPAVPYSGWD FNDGKCKTGS GDIENYNDAT QVRDCRLVGL
α-amylase 1A : (181-240) LDLALGKDYV RSKIAEYMNH LIDIGVAGFR IDASKHMWPG DIKAILDKLH NLNSNWFPEG
α-amylase 1B : (181-240) LDLALGKDYV RSKIAEYMNH LIDIGVAGFR IDASKHMWPG DIKAILDKLH NLNSNWFPEG
α-amylase 1C : (181-240) LDLALGKDYV RSKIAEYMNH LIDIGVAGFR IDASKHMWPG DIKAILDKLH NLNSNWFPEG
α-amylase 2A : (181-240) LDLALEKDYV RSKIAEYMNH LIDIGVAGFR LDASKHMWPG DIKAILDKLH NLNSNWFPAG
α-amylase 2B : (181-240) LDLALEKDYV RSKIAEYMNH LIDIGVAGFR LDASKHMWPG DIKAILDKLH NLNSNWFPAG
α-amylase 1A : (241-300) SKPFIYQEVI DLGGEPIKSS DYFGNGRVTE FKYGAKLGTV IRKWNGEKMS YLKNWGEGWG
α-amylase 1B : (241-300) SKPFIYQEVI DLGGEPIKSS DYFGNGRVTE FKYGAKLGTV IRKWNGEKMS YLKNWGEGWG
α-amylase 1C : (241-300) SKPFIYQEVI DLGGEPIKSS DYFGNGRVTE FKYGAKLGTV IRKWNGEKMS YLKNWGEGWG
α-amylase 2A : (241-300) SKPFIYQEVI DLGGEPIKSS DYFGNGRVTE FKYGAKLGTV IRKWNGEKMS YLKNWGEGWG
α-amylase 2B : (241-300) SKPFIYQEVI DLGGEPIKSS DYFGNGRVTE FKYGAKLGTV IRKWNGEKMS YLKNWGEGWG
α-amylase 1A : (301-360) FMPSDRALVF VDNHDNQRGH GAGGASILTF WDARLYKMAV GFMLAHPYGF TRVMSSYRWP
α-amylase 1B : (301-360) FMPSDRALVF VDNHDNQRGH GAGGASILTF WDARLYKMAV GFMLAHPYGF TRVMSSYRWP
α-amylase 1C : (301-360) FMPSDRALVF VDNHDNQRGH GAGGASILTF WDARLYKMAV GFMLAHPYGF TRVMSSYRWP
α-amylase 2A : (301-360) FVPSDRALVF VDNHDNQRGH GAGGASILTF WDARLYKMAV GFMLAHPYGF TRVMSSYRWP
α-amylase 2B : (301-360) FMPSDRALVF VDNHDNQRGH GAGGASILTF WDARLYKMAV GFMLAHPYGF TRVMSSYRWP
α-amylase 1A : (361-420) RYFENGKDVN DWVGPPNDNG VTKEVTINPD TTCGNDWVCE HRWRQIRNMV NFRNVVDGQP
α-amylase 1B : (361-420) RYFENGKDVN DWVGPPNDNG VTKEVTINPD TTCGNDWVCE HRWRQIRNMV NFRNVVDGQP
α-amylase 1C : (361-420) RYFENGKDVN DWVGPPNDNG VTKEVTINPD TTCGNDWVCE HRWRQIRNMV NFRNVVDGQP
α-amylase 2A : (361-420) RQFQNGNDVN DWVGPPNNNG VIKEVTINPD TTCGNDWVCE HRWRQIRNMV IFRNVVDGQP
α-amylase 2B : (361-420) RQFQNGNDVN DWVGPPNNNG VIKEVTINPD TTCGNDWVCE HRWRQIRNMV NFRNVVDGQP
α-amylase 1A : (421-480) FTNWYDNGSN QVAFGRGNRG FIVFNNDDWT FSLTLQTGLP AGTYCDVISG DKINGNCTGI
α-amylase 1B : (421-480) FTNWYDNGSN QVAFGRGNRG FIVFNNDDWT FSLTLQTGLP AGTYCDVISG DKINGNCTGI
α-amylase 1C : (421-480) FTNWYDNGSN QVAFGRGNRG FIVFNNDDWT FSLTLQTGLP AGTYCDVISG DKINGNCTGI
α-amylase 2A : (421-480) FTNWYDNGSN QVAFGRGNRG FIVFNNDDWS FSLTLQTGLP AGTYCDVISG DKINGNCTGI
α-amylase 2B : (421-480) FTNWYDNGSN QVAFGRGNRG FIVFNNDDWT FSLTLQTGLP AGTYCDVISG DKINGNCTGI
α-amylase 1A : (481-511) KIYVSDDGKA HFSISNSAED PFIAIHAESK L
α-amylase 1B : (481-511) KIYVSDDGKA HFSISNSAED PFIAIHAESK L
α-amylase 1C : (481-511) KIYVSDDGKA HFSISNSAED PFIAIHAESK L
α-amylase 2A : (481-511) KIYVSDDGKA HFSISNSAED PFIAIHAESK L
α-amylase 2B : (481-511) KIYVSDDGKA HFSISNSAED PFIAIHAESK L
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Payen et Persoz, « Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels », Annales de chimie et de physique, 2e série, t. 53, 1833, pp. 73-92, consultable sur Google Books
- Éditions Larousse, « Définitions : ptyaline - Dictionnaire de français Larousse », sur www.larousse.fr (consulté le )