1,4,7-Triazacyclononane
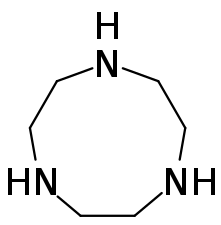
Le 1,4,7-triazacyclononane, ou TACN, est un éther azacouronne de formule chimique (CH2CH2NH)3[3]. Ce solide blanc cristallisé fondant vers 42 à 45 °C est corrosif.
| 1,4,7-Triazacyclononane | |||
  |
|||
| Structure du 1,4,7-triazacyclononane | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1,4,7-triazonane | ||
| No CAS | |||
| No ECHA | 100.164.887 | ||
| No CE | 637-157-5 | ||
| PubChem | 188318 | ||
| ChEBI | 37405 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide blanc cristallisé[1] | ||
| Propriétés chimiques | |||
| Formule | C6H15N3 [Isomères] |
||
| Masse molaire[2] | 129,203 4 ± 0,006 5 g/mol C 55,78 %, H 11,7 %, N 32,52 %, |
||
| Propriétés physiques | |||
| T° fusion | 42 à 45 °C[1] | ||
| Point d’éclair | 110 °C[1] | ||
| Précautions | |||
| SGH[1] | |||
 Danger |
|||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il s'agit d'un des oligomères de l'aziridine C2H4NH, comme le sont la pipérazine (CH2CH2NH)2 et le cyclène (CH2CH2NH)4.
Sa structure moléculaire est analogue à celle du cyclononane (CH2)9 avec substitution des trois groupes méthylène CH2 équidistants par des groupes NH.
Le TACN agit comme chélateur tridenté et comme ligand avec des ions métalliques.
Synthèse
Le TACN peut être obtenu par macrocyclisation de la diéthylènetriamine NH2CH2CH2NHCH2CH2NH2 par du ditosylate d'éthylène glycol TsOCH2CH2OTs[4] :
Applications
Le TACN est un ligand tridenté couramment utilisé. Il a une symétrie d'ordre 3 et se lie à une face de l'octaèdre de coordination de métalloïdes ou de métaux de transition en formant un complexe stable qui permet d'autres réactions de synthèse sur les autres sites de coordination. Le triméthyltriazacyclononane est un analogue plus volumineux du TACN.
Il se coordonne généralement aux métaux dans les états d'oxydation moyen et élevé tels que Ni(III), Mn(IV), Mo(III) ou W(III), mais il existe des exceptions. Par exemple, il réagit avec l'hexacarbonyle de molybdène Mo(CO)6 et l'hexacarbonyle de tungstène W(CO)6 pour produire les tricarbonyles correspondants, [(κ3-TACN)Mo(CO)3] et [(κ3-TACN)W(CO)3]. Ces deux complexes ont un état d'oxydation égale à 0. L'addition de peroxyde d'hydrogène H2O2 à 30 % porte cet état d'oxydation à +6 avec les complexes oxo [(κ3-TACN)MoO3] et [(κ3-TACN)WO3]. Le macrocycle se dissocie au cours de ce changement significatif de l'état d'oxydation formel du métal.
Autre exemple, le complexe [κ3-TACN)Cu(II)Cl2], catalyseur du clivage de liaisons phosphodiester dans l'ADN[5], est produit à partir de TACN de la manière suivante :
Des complexes de TACN et de manganèse catalysent l'époxydation d'alcènes tels que le styrène à l'aide de peroxyde d'hydrogène comme oxydant dans une solution de méthanol tamponnée au carbonate à pH 8,0. Ces réactifs sont considérés comme n'ayant qu'un faible impact sur l'environnement[6].
- [(κ3-TACN)Mn] + H2O2 + NaHCO3 + (C6H5)C2H3 ⟶ [(κ3-TACN)Mn] + 2 H2O + CO2 + (C6H5)C2H2O.
Avec des sources de chrome(III), par exemple par chauffage de chlorure de chrome(III) CrCl3 dans le diméthylsulfoxyde, il forme des complexes tels que le [(TACN)2Cr]3+[7].
Notes et références
- Fiche Sigma-Aldrich du composé 1,4,7-Triazacyclononane, consultée le 3 août 2022. PDF.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Phalguni Chaudhuri et Karl Wieghardt, « The Chemistry of 1,4,7-Triazacyclononane and Related Tridentate Macrocyclic Compounds », Progress in Inorganic Chemistry, vol. 35, , p. 329-436 (DOI 10.1002/9780470166369.ch4, lire en ligne)
- (de) Karl Wieghardt, Wilfried Schmidt, Bernhard Nuber et Johannes Weiss, « Neue μ-Hydroxo-Übergangsmetallkomplexe, I. Darstellung und Struktur des trans-Diaqua-di-μ-hydroxo-bis[(1,4,7-triazacyclononan)cobalt(III)]-Kations; Kinetik und Mechanismus seiner Bildung », Chemische Berichte, vol. 112, no 6, , p. 2220-2230 (DOI 10.1002/cber.19791120629, lire en ligne)
- (en) Kevin F. Sibbons, Kirtida Shastri et Michael Watkinson, « The application of manganese complexes of ligands derived from 1,4,7-triazacyclononane in oxidative catalysis », Dalton Transactions, vol. 5, , p. 645-661 (DOI 10.1039/b511331h, lire en ligne)
- (en) Kim A. Deal et Judith N. Burstyn, « Mechanistic Studies of Dichloro(1,4,7-triazacyclononane)copper(II)-Catalyzed Phosphate Diester Hydrolysis », Inorganic Chemistry, vol. 35, no 10, , p. 2792-2798 (DOI 10.1021/ic951488l, lire en ligne)
- (en) Karl Wieghardt, Wilfried Schmidt, Willy Herrmann et Heinz Josef Kueppers, « Redox potentials of bis(1,4,7-triazacyclononane complexes of some first transition series metals(II,III). Preparation of bis(1,4,7-triazacyclononane)nickel(III) perchlorate », Inorganic Chemistry, vol. 22, no 20, , p. 2953-2956 (DOI 10.1021/ic00162a037, lire en ligne)
- Portail de la chimie
