Mocassin d'eau
Agkistrodon piscivorus

- Crotalus piscivorus Lacepède, 1789
- Acontias leucostoma Troost, 1836

LC : Préoccupation mineure
Le mocassin d'eau (Agkistrodon piscivorus), aussi connu en français louisianais sous le nom de congo à tête plate, serpent congo ou simplement congo,[1] est une espèce de serpents de la famille des Viperidae[2] que l'on trouve dans le Sud-Est des États-Unis. Les adultes sont grands et capables de délivrer une morsure douloureuse et potentiellement mortelle. Lorsqu'il est dérangé, ce serpent s'enroule sur lui-même et montre ses crochets venimeux. Bien que leur dangerosité ait été exagérée, en de rares occasions les mâles territoriaux abordent les intrus de manière agressive. Il s'agit du seul crotale semi-aquatique du monde, et on le trouve généralement dans ou près de l'eau, en particulier dans des eaux au courant très faible comme les lacs peu profonds, les ruisseaux et les marais. Ce serpent est un bon nageur et peut même pénétrer dans la mer. Il a réussi à coloniser les îles au large des côtes de l'Atlantique et du Golfe du Mexique.
Le nom générique est dérivé des mots grecs ankistro (en crochet) et odon (dent), et l'épithète spécifique vient du latin piscis (poisson) et voro (manger). L'ensemble de son nom scientifique se traduit donc par « mangeur de poissons à dents en forme de crochet ». Trois sous-espèces sont actuellement reconnues. Son régime alimentaire se compose principalement de poissons et de grenouilles mais est par ailleurs très varié et, de manière unique, on l'a même vu consommer des charognes.
Description



Le mocassin d'eau est la plus grande espèce du genre Agkistrodon. Les adultes dépassent couramment 80 cm de long, et les femelles sont plus petites que les mâles. La longueur totale mesurée lors d'une étude a révélé que les adultes mesuraient entre 65 et 90 cm de long. Une étude de l'adulte est de 65 à 90 cm[3]. La masse corporelle moyenne a été jugée à entre 292,5 et 579,6 g pour les mâles, et entre 201,1 et 254,1 g pour les femelles[4],[5]. Parfois, les individus peuvent dépasser 180 cm de long, en particulier dans la partie orientale de leur aire de répartition[6]. Selon Gloyd et Conant (1990), le plus grand spécimen de A. p. piscivorus jamais enregistré mesurait 188 cm de long[7], basé sur un spécimen capturé dans la région de Dismal Swamp et donné au zoo de Philadelphie. Il convient de noter, toutefois, que ce serpent avait apparemment été blessé pendant la capture, et est mort plusieurs jours plus tard et a été mesuré droit et complètement détendu[8]. Les grands spécimens peuvent être extrêmement volumineux, un spécimen d'environ 180 cm ayant été pesé à 4,6 kg[9].
La tête large est distincte du cou, et le museau a un profil émoussé avec le bord du sommet de la tête légèrement vers l'avant, s'étendant plus loin que la bouche. De grandes plaques crâniennes sont présentes, et les écailles pariétales sont souvent fragmentées, en particulier vers l'arrière. Il n'y a pas d'écaille loréale. Il y a six à neuf supralabiales et de 8 à 12 infralabiales. Au milieu du corps, il y a 23 à 27 rangées d'écailles dorsales[6]. Toutes les rangées d'écailles dorsales sont carénées, bien que celles des rangées d'écailles les plus basses soient moins marquées[8]. Chez les mâles et les femelles, le nombre d'écailles ventrales est respectivement de 130-145 et 128-144 et celui de sous-caudales de 38-54 et 36-50[6].
Bien que la majorité des spécimens sont totalement noirs ou presque (à l'exception de la tête et des marques du visage), la coloration peut être constituée d'une couleur de fond brun, gris, beige, jaune-olive ou noirâtre, recouverte d'une série de 10 à 17 bandes transversales d'un brun foncé presque noir. Ces bandes transversales, qui ont généralement des bords noirs, sont parfois cassées le long de la ligne médiane dorsale pour former une série de demi-bandes en quinconce de part et d'autre du corps. Ces bandes transversales sont moins nettes dans le centre, se rapprochant de la couleur de fond, et elles présentent souvent des taches sombres irrégulières, et s'étendent vers les écailles ventrales. Le motif de bandes s'estompent avec l'âge, et les animaux les plus âgés sont presque uniformément brun-olive, gris-brun ou noir. Le ventre est blanc, blanc jaunâtre ou beige, marqué de taches sombres, et devient plus foncé vers la queue. La quantité de pigmentation foncée sur le ventre varie de quasiment rien à presque complètement noir. La tête est d'un brun plus ou moins uniforme, en particulier chez la sous-espèce nominale. Les spécimens subadultes peuvent présenter le même genre de taches pariétales sombres qu'A. contortrix, et ces marques peuvent parfois encore être visibles chez les adultes. Les populations de l'Est ont de larges bandes postoculaires foncées, bordées d'une pigmentation plus pâle dessus et dessous, qui est faible ou absente dans les populations occidentales. La face inférieure de la tête est généralement blanchâtre, crème ou beige[6].
Les jeunes et les spécimens subadultes ont généralement un motif de couleur plus contrastée, avec des bandes transversales sombres sur un fond plus clair. La couleur de fond est alors brun ou brun rougeâtre. Le bout de la queue est généralement jaunâtre, devenant jaune verdâtre ou verdâtre chez les jeunes adultes, puis noire chez les adultes. Sur certains jeunes, le motif en bandes peut également être vu sur la queue[6]. Les jeunes serpents remuent le bout de leur queue de couleur vive pour attirer des proies[10].
Cette espèce est souvent confondue avec le A. contortrix. C'est particulièrement vrai pour les jeunes, mais il y a des différences visibles. A. piscivorus a de larges bandes sombres sur les côtés de sa tête qui se prolongent en arrière de l'œil, alors que A. contortrix ne dispose que d'une ligne sombre mince qui sépare les écailles supralabiales pâles de la couleur un peu plus sombre de la tête. Les serpents du genre Nerodia sont également ressemblants, avec leur corps épais et leur grande tête, mais ils ont les pupilles rondes, n'ont pas de dépressions au niveau du lore, présente une plaque anale unique, des écailles sous-caudales qui sont divisées en travers et un motif global de coloration distinctif[6].
Biologie et écologie
Comportement

L'agressivité de ces serpents a été grandement exagérée. Dans les tests visant à mesurer les différentes réponses comportementales de spécimens sauvages à des rencontres avec l'Homme, de 23 à 45 serpents (51 %) ont essayé de s'échapper, tandis que 28 des 36 (78 %) ont eu recours à des postures de menaces et d'autres tactiques défensives. C'est seulement une fois attrapés avec une main mécanique qu'ils étaient susceptibles de mordre[11].
Lorsqu'il est stressé ou menacé, ce serpent prend une posture défensive caractéristique, faisant vibrer sa queue comme le crotale et jetant sa tête en arrière avec la gueule ouverte pour afficher l'intérieur étonnamment blanc[12], et produisant un sifflement fort tandis que le cou et la partie avant de son corps sont mis dans une position en forme de S[13]. D'autres réponses défensives peuvent inclure l'aplatissement de son corps[13] et la sécrétion d'un fluide odorant par les glandes anales situées à la base de la queue[6]. Cette sécrétion peut être éjectée en jets minces si le serpent est fortement dérangé. L'odeur a été comparée à celle d'un bouc, ainsi que celle d'un genre de plantes des plaines inondables, Pluchea, également connu pour son odeur pénétrante[8].
Des serpents d'eau inoffensifs du genre Nerodia sont souvent confondus avec ce serpent. Ce sont aussi des serpents semi-aquatiques au corps épais avec de grandes têtes qui peuvent être agressifs quand ils sont menacés[6], mais ils se comportent différemment. Par exemple, les serpents Nerodia fuient habituellement rapidement dans l'eau, alors qu'A. piscivorus ne bouge pas de son emplacement, prenant sa posture défensive menaçante. De plus les serpents Nerodia ne font pas vibrer leur queue quand ils sont menacés[14]. A. piscivorus tient habituellement sa tête à un angle d'environ 45° lorsqu'il se baigne ou rampe[6].
Brown (1973) considère leurs corps musclés lourds comme pouvant être un moyen de se protéger, notant qu'il est difficile de les tenir pour extraire leur venin en raison de leur force[15].
Cette espèce peut être active pendant la journée, tout comme la nuit. Cependant, durant les belles journées ensoleillées, ils restent généralement enroulés quelque part dans l'ombre. Dans la matinée et durant les journées fraîches, ils peuvent souvent être vus se dorer au soleil. Ils apparaissent souvent au coucher du soleil pour se réchauffer sur le sol chaud (comme les trottoirs, les routes) et deviennent alors très actifs tout au long de la nuit, et c'est à ce moment qu'ils sont vus nageant ou rampant[6]. Contrairement à la croyance populaire, ils sont capables de mordre lorsqu'ils sont dans l'eau[12].
Dans le nord, ils hibernent pendant les mois d'hiver. Niell (1947, 1948) a observé cette espèce en Géorgie et a noté qu'ils étaient l'une des dernières espèces de reptile à chercher un abri, étant souvent trouvé actif jusqu'aux premières fortes gelées. À ce moment, ils déménagent vers un terrain plus en altitude et peuvent être trouvés dans des souches de pins pourries dont ils ont arraché l'écorce. Ces serpents peuvent être très actifs lorsqu'on les trouve ainsi réfugiés, et tentent alors de creuser plus profondément dans le bois tendre ou de s'échapper vers l'eau la plus proche. Dans le sud-est de la Virginie, Wood (1954) a rapporté avoir identifié un comportement migratoire fin octobre et début novembre. Pendant une période de trois ou quatre jours, jusqu'à 50 individus peuvent être vus traversant à la nage Back Bay, à partir des marais des îles barrières vers le continent. Il suggère que cela pourrait avoir quelque chose à voir avec les habitudes d'hibernation. Dans les régions du sud de son aire de répartition, l'hibernation peut être de courte durée ou même complètement absente[8].
Alimentation
Raymond Ditmars (1912) décrit cette espèce comme « omnicarnivore ». Son régime alimentaire comprend des mammifères, des oiseaux, des amphibiens, des poissons et de petits alligators. Le cannibalisme a également été rapportée. Normalement cependant, la majeure partie de son régime alimentaire se compose de poissons et des grenouilles. À l'occasion, les jeunes se nourrissent d'invertébrés[8]. Les poissons-chats sont souvent consommés, bien que leurs épines pointues provoquent parfois des blessures. Les crapauds du genre Bufo sont apparemment évités[6].

De nombreux auteurs ont décrit les proies prises dans des circonstances naturelles. Bien que les poissons et les grenouilles sont leur proie la plus commune, ils mangent presque tous les petits vertébrés. Campbell et Lamar (2004) ont fourni une liste exhaustive des espèces qui peuvent être la proie d'A. piscivorus, y compris les cigales, les chenilles, les escargots terrestres (Euglandina rosea), les poissons-chats (Ictalurus furcatus), le brochet (Esox), des Lepomis), des (Micropterus), des (Siren), des Tritons verts (Notophthalmus viridescens), des salamandres du genre (Eurycea), Desmognathus brimleyorum, des crapauds tels ceux du genre Scaphiopus ou Gastrophryne carolinensis, des Rainettes grillons boréales (Acris crepitans), des Rainettes de Cuba (Osteopilus septentrionalis), des grenouilles arboricoles du genre Hyla, des grenouilles du genre Rana, des Anoles verts (Anolis carolinensis), des lézards comme ceux du genre (Eumeces), Ophisaurus ventralis et Scincella lateralis, d'autres serpents comme Farancia abacura, les Couleuvres à nez plat (Heterodon platirhinos), les espèces des genres Lampropeltis, Nerodia, Regina et Thamnophis, les Couleuvres brunes (Storeria dekayi), d'autres A. piscivorus, des crotales (Crotalus), les Tortues serpentines (Chelydra serpentina), les tortues du genre Kinosternon, Sternotherus odoratus, Pseudemys floridana, Trachemys scripta, des Tortues boîtes (Terrapene carolina), des Tortues à carapace molle (Apalone ferox), des bébés Alligators d'Amérique (Alligator mississippiensis), des Grives des bois (Hylocichla mustelina), des mésanges (Parus), des Cardinals rouges (Cardinalis cardinalis), divers passereaux non identifiés, les petits canards, les jeunes Anhingas d'Amérique (Anhinga anhinga), des Grandes aigrettes (Ardea alba), des aigrettes, les Ibis falcinelles et leurs œufs (Plegadis falcinellus), les Aigrettes tricolores (Egretta tricolor), les hérons et leurs œufs, les Grèbes à bec bigarré (Podilymbus podiceps), les Grandes musaraignes (Blarina brevicauda), des Petites musaragines (Cryptotis parva), Sorex longirostris, les Taupes à queue glabre (Scalopus aquaticus), les Rats musqués (Ondatra zibethicus), les Rats du riz (Oryzomys palustris), Perognathus hispidus, les Rats noirs (Rattus rattus), les écureuils (Sciurus), les lapins (Sylvilagus) et les chauve-souris[6].
Le serpent capture les poissons en les acculant en eau très peu profonde, généralement contre la rive ou contre des morceaux de bois. Les serpents profitent des trous d'eau laissés quand les rivières commencent à se tarir l'été ou au début de l'automne et se gavent des fortes concentrations de poissons et têtards qui en résultent. Une étude réalisée par Savitsky (1992) a montré qu'ils étaient étonnamment incapables d'attraper des poissons vivants ou morts sous l'eau[6].
Ils sont opportunistes et peuvent parfois manger des charognes. Campbell et Lamar (2004) ont décrit les avoir vus se nourrissant de têtes de poisson et des viscères qui avaient été jetés à l'eau à partir d'un quai. Heinrich et Studenroth (1996) ont rapporté un cas dans lequel un spécimen a été vu se nourrissant des restes de l'abattage d'un cochon sauvage (Sus scrofa) qui avaient été jetés dans Cypress Creek[6].
Conant (1929) a donné un compte rendu détaillé du comportement alimentaire d'un spécimen détenu en captivité en Caroline du Sud. Quand une proie était introduite, le serpent devenant rapidement attentif et réalisait une attaque. Les grenouilles et les petits oiseaux étaient saisis et maintenus dans la gueule du serpent jusqu'à leur complète immobilisation. Des proies plus imposantes étaient approchées de manière plus prudente ; une attaque rapide était exécutée avant que le serpent ne se retire. En 2,5 ans, le serpent avait mangé trois espèces de grenouilles, dont un grand ouaouaron, une salamandre tachetée, des serpents d'eau, des couleuvres, des moineaux, des jeunes rats et trois espèces de souris[8]. Brimley (1944) décrit un spécimen en captivité qui a mangé un spécimen d'A. contortrix, ainsi que des membres de sa propre espèce, en gardant ses crocs insérés dans ses victimes jusqu'à ce qu'ils soient complètement immobilisés[8].
Les jeunes individus ont l'extrémité de la queue jaunâtre ou verdâtre et l'utilisent comme un leurre. Le bout de la queue se tortille pour attirer les proies telles que les grenouilles et les lézards, jusqu'à ce qu'ils soient à portée du serpent. Wharton (1960) a observé des spécimens captifs présentant ce comportement entre 07h20 et 19h40, ce qui suggère qu'il s'agit d'une activité diurne[6].
Prédateurs
Ces serpents peuvent être la proie des Tortues serpentines (Chelydra serpentina), des Alligators d'Amérique (Alligator mississippiensis), des Grands-ducs d'Amérique (Bubo virginianus), des aigles, des faucons, des Pie-grièches migratrices (Lanius ludovicianus), et de grands échassiers comme les hérons, les Gruidae et les aigrettes[6],[8].
Ils sont également la proie des serpents ophiophages, y compris leur propre espèce (cannibalisme). Humphreys (1881) a décrit comment un spécimen de 860 mm a été tué et mangé en captivité par un Lampropeltis getula de 1 100 mm. D'autre part, Neill (1947) a rapporté que les Lampropeltis getula étaient réticents à les attaquer, étant repoussés avec succès par leurs « coups de corps »[8]. Il s'agit d'un comportement défensif spécifique contre les serpents ophiophages, observé à l'origine chez certaines espèces de crotale (Crotalus) par Klauber (1927), qui consiste à élever une section du milieu du corps au-dessus du sol pour différentes hauteurs. Cette boucle soulevée peut alors être maintenue dans cette position pour une durée variable, changer de position, ou se déplacer vers l'agresseur. Dans ce dernier cas, il est souvent jeté ou retourné vigoureusement dans la direction de l'agresseur. Chez A. piscivorus, la boucle est soulevée latéralement, avec le ventre tourné vers l'attaquant[13].
Reproduction
Cette espèce est ovovivipare, avec des femelles donnant naissance à 1 à 16 jeunes vivants voire jusqu'à 20. Cependant, des portées de six à huit jeunes sont les plus communes. Les nouveau-nés mesurent 22-35 cm de longueur, avec les mensurations les plus importantes chez A. p. conanti et les plus petites chez A. p. leucostoma. Si les conditions météorologiques sont favorables et la nourriture est facilement disponible, la croissance est rapide et les femelles peuvent se reproduire à moins de trois ans et à une taille pas plus importante que 60 cm. Les jeunes naissent en août ou septembre, tandis que l'accouplement peut avoir lieu pendant l'un des mois les plus chauds de l'année, au moins dans certaines parties de sa répartition[8].
En ce qui concerne A. p. piscivorus, une étude menée par Stejneger (1895) décrit un couple au zoo de Berlin qui s'est accouplé le , avant de donner naissance à huit nouveau-nés le de cette année. Les jeunes mesuraient 26 cm de long et 1,5 cm d'épaisseur. Ils ont mué pour la première fois après deux semaines, après quoi ils ont accepté de petites grenouilles, mais pas de poisson[8].
Des combats entre mâles ont été signalés à diverses reprises, et sont très similaires dans leur forme à ceux observés chez de nombreuses autres espèces de vipéridés. C'est un facteur important dans la sélection sexuelle, il permet la création d'une reconnaissance de la domination lorsque les mâles sont en concurrence pour les femelles sexuellement actives[13].
Quelques témoignages de femelles qui défendent leur portée de nouveau-nés ont été notés. Wharten (1960, 1966) a signalé plusieurs cas dans lesquels les femelles étaient trouvées près de leurs petits et se tenaient en posture enroulée, et il a considéré cela comme des exemples de surveillance et protection des jeunes. Un autre cas a été décrit par Walters et Card (1996) dans lequel une femelle a été trouvée à l'entrée d'un terrier avec sept nouveau-nés rampant sur ou autour d'elle. Lorsque l'un des jeunes a été déplacé à une courte distance du terrier, elle semblait agitée et faisait face à l'intrus. Finalement, l'ensemble de sa progéniture se retira dans le terrier, tandis que la femelle est restée à l'entrée, prête à attaquer[6].
Venin
Le venin de A. piscivorus est plus toxique que celui de A. contortrix et est riche en enzymes. C'est un venin cytotoxique puissant qui détruit les tissus. Bien que les décès soient rares, la morsure peut laisser des cicatrices et parfois causer une amputation. Il n'y a pas de réaction anaphylactique chez un individu mordu, cependant, le venin ne provoque pas de réactions systémiques chez les victimes et ne contient pas les composants neurotoxiques qui sont présents chez de nombreuses espèces de serpent à sonnettes. Les morsures peuvent être traitées efficacement avec antivenin CroFab ; ce sérum est obtenu en utilisant des composants de venins issus de quatre espèces de vipères américaines (Crotalus atrox, Crotalus adamanteus, Crotalus scutulatus et Agkistrodon piscivorus)[16].
Les morsures de A. piscivorus sont relativement fréquentes dans la basse vallée du fleuve Mississippi et le long de la côte du golfe du Mexique, bien que les décès soient rares[17]. Allen et Swindell (1948) ont compilé un dossier recensant les morsures d'A. piscivorus dans l'état de Floride à partir d'articles de journaux et des données du Bureau des statistiques de l'état civil : 1934, huit morsures et trois décès (aucun autre décès n'a été enregistré après cette année) ; 1935, 10 ; 1936, 16 ; 1937, 7 ; 1938, 6 ; 1939, 5 ; 1940, 3 ; 1941, 6 ; 1942, 3 ; 1943, 1 ; 1944, 3 ; 1998, 1. Wright et Wright (1957) déclarent avoir rencontré ces serpents à d'innombrables reprises, et ont souvent presque marché sur eux, mais sans jamais être mordus. En outre, il n'a été signalé aucune morsure parmi les 400 coupeurs de cyprès dans les marais d'Okefenokee pendant tout l'été de 1921. Ces comptes indiquent que cette espèce n'est pas particulièrement agressive[18].
Brown (1973) a estimé la quantité de venin moyenne dans une morsure à 125 mg de venin séché, avec une variation entre 80 et 237 mg, et la DL50 a été relevée à 4,0, 2,2, 2,7, 3,5 et 2,0 mg/kg par voie intraveineuse, avec une toxicité cutanée de 25,8 mg/kg[15]. Wolff et Githens (1939) ont décrit un spécimen de 152 mg qui a produit 3,5 ml de venin au cours de la première extraction et de 4,0 ml cinq semaines plus tard (soit 1,094 g de venin séché) [18]. Les symptômes comprennent généralement des ecchymoses et une enflure. La douleur est généralement plus importante que pour les morsures d'A. contortrix, mais moins que pour celles des crotales (Crotalus). La formation de vésicules et de bulles est moins fréquente que dans le cas des morsures de serpent à sonnettes, bien qu'une nécrose puisse se produire. Une myokymie est parfois observée[19]. D'autre part, l'US Navy (1991) stipule que le venin a une activité protéolytique forte qui peut conduire à une destruction sévère des tissus[17].
Distribution et habitat
Aire de répartition géographique
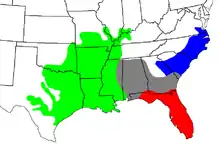
Cette espèce vit dans l'est des États-Unis du Dismal Swamp dans le sud-est de la Virginie, jusqu'à la péninsule de la Floride au sud et jusqu'à l'Arkansas, l'est et du sud de l'Oklahoma, l'est et le centre du Texas et l'ouest et le sud de la Géorgie à l'ouest — mais pas dans les lacs, comme le lac Lanier, malgré des erreurs d'identification communes avec des serpents aquatiques bruns. Quelques observations d'animaux de cette espèce le long du Rio Grande au Texas ont été notées, mais on considère que ce sont des populations isolées, qui ont peut-être disparu aujourd'hui. La localité type est la Caroline, bien que Schmidt (1953) ait proposé de la limiter à la zone autour de Charleston, en Caroline du Sud [20].
Campbell et Lamar (2004) mentionnent cette espèce en Alabama, Arkansas, Floride, Géorgie, Illinois, Indiana, Kentucky, Louisiane, Mississippi, Missouri, Caroline du Nord, Oklahoma, Caroline du Sud, Texas et Virginie[6]. Les cartes fournies par Campbell et Lamar (2004) et Wright et Wright (1957) indiquent également sa présence dans l'ouest et le centre du Tennessee et dans l'extrême sud-est du Kansas, la limitant à la partie occidentale du Kentucky [18],[6].
En Géorgie, on le trouve dans la moitié sud de l’État à quelques kilomètres au nord de la ligne de pente à quelques exceptions près. Son aire de répartition comprend également la vallée de l'Ohio au nord jusqu'au Sud de l'Illinois, et il habite de nombreuses îles barrières au large des côtes des États où il vit[6].
Habitat

La plupart des espèces du genre Agkistrodon sont aquatiques, et généralement associées à des plans d'eau, tels que les ruisseaux, les marais, les marécages et les berges des étangs et des lacs[6]. L'US Navy (1991) le décrit comme habitant les marais, les lacs peu profonds et les ruisseaux lents, mais il est habituellement introuvable dans les eaux fraîches et rapides ou profondes[17]. Behler et King (1979) listent parmi les habitats de ce serpent les marais de plaine, les lacs, les rivières, les fonds de baies, les marécages, les fossés d'irrigation, les canaux, les champs de riz et les petits ruisseaux de montagne à l'eau claire[21].
On le trouve aussi dans les habitats d'eau saumâtre et est parfois vu nager dans l'eau salée. Il a réussi à coloniser les îles barrières de la côte Atlantique et du Golfe de manière plus importante que A. contortrix. Toutefois, même sur ces îles, il préfère les marais d'eau douce. Une étude menée par Dunson et Freda (1985) le décrit comme étant particulièrement peu tolérant au sel[6].
Le serpent ne se limite pas à des habitats aquatiques, cependant, comme Gloyd et Conant (1990) le soulignent, les gros spécimens ne sont jamais rencontrés à plus de 1,6 km de l'eau[8]. Dans divers endroits, l'espèce s'est bien adaptée à des environnements moins humides, comme les fourrés de Palmiers de Floride, les forêts de pins et de palmiers nains, les forêts de pins de l'est du Texas, les bois de pins de Floride, la forêt de feuillus de l'Est, les zones de dunes et de plage, la forêt et les prairies en zone riparienne [6].
Étymologie et taxonomie
Son nom spécifique est dérivé des mots latins piscis et voro, qui signifie « poisson » et « manger ». La sous-espèce Agkistrodon piscivorus conanti est nommée en l'honneur de Roger Conant[22]. Le nom vernaculaire anglais de cette espèce, cottonmouth, qui signifie « bouche de coton », s'inspire de la couleur blanche de sa bouche, bien visible quand il l'ouvre en position de défense.
On recense trois sous-espèces :
| Sous-espèce[23] | Auteur[23] | Nom commun[8] | Geographic range[8] |
|---|---|---|---|
| A. p. conanti | Gloyd, 1969 | Mocassin d'eau de Floride | Aux États-Unis, dans l'extrême Sud de la Géorgie et dans quasiment tout l'État de Floride, dont plusieurs des îles de la côte. |
| A. p. leucostoma | (Troost, 1836) | Mocassin d'eau de l'Ouest | Aux États-Unis, du sud de l'Alabama le long de la côte du Golfe du Mexique, y compris des îles au large, au sud-est et centre du Texas, et nord jusqu'à l'Oklahoma, le Missouri, l'Illinois et l'Indiana. |
| A. p. piscivorus | (Lacépède, 1789) | Mocassin d'eau de l'Est | Aux États-Unis dans la péninsule de Delmarva, la plaine côtière Atlantique, et la Caroline du Nord et du sud y compris les rives, les péninsules et les îles au large, et à l'ouest jusq'en Géorgie. |
Le Mocassin d'eau et l'Homme
Sauvegarde
Cette espèce est classée comme étant de Préoccupation mineure (LC) sur la Liste rouge des espèces menacées (v3.1, 2007) de l'UICN[24]. Les espèces sont inscrites en tant que telles lorsqu'elles ont une vaste aire de répartition, une présumée grande population, ou parce qu'elles sont peu susceptibles d'être en déclin assez rapide pour être inscrites dans une catégorie plus menacée. Lorsque la dernière évaluation en 2007, la tendance de la population est stable[25].
La persécution constante de cette espèce et le drainage des milieux humides pour développer des activités humaines ont causé de lourdes pertes dans les populations locales. Malgré cela, il reste une espèce commune dans de nombreuses régions[8],[12]. Dans l'Indiana, le Mocassin d'eau est répertorié comme une espèce menacée[26].
Dans la culture
- N. H. Bishop donne un description du water-mocassin dans son récit En canot de papier, de Québec au golfe du Mexique (1878) pp.312 et suiv.
- « Cottonmouth », le nom anglais du mocassin d'eau, était le nom de code de O-Ren Ishii au sein du groupe de tueurs des Vipères Assassines, l'un des personnages de Kill Bill.
- Le mocassin d'eau joue un rôle important dans le drame Mud : Sur les rives du Mississippi.
- Il intervient dans le film dramatique I Don't Feel at Home in This World Anymore.
- Dans le jeu vidéo Hitman sorti en 2016 , un des défis de l'épisode Situs Inversus au Japon se nomme « Cottonmouth », probablement en référence à O-ren Ishii.
Publications originales
- Gloyd, 1969 : Two additional subspecies of North American crotalid snakes, genus Agkistrodon. Proceedings of the Biological Society of Washington, vol. 82, p. 219-232 (texte intégral).
- Lacepède, 1789 : Histoire Naturelle des Quadrupèdes Ovipares et des Serpens, vol. 2, lmprimerie du Roi, Hôtel de Thou, Paris, p. 1-671.
- Troost, 1836 : On a new genus of Serpents, and two new species of the genus Heterodon, inhabiting Tennessee. Annals of the Lyceum of Natural History of New York, vol. 3, p. 174-190 (texte intégral).
Liens externes
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- Nonindigenous Aquatic Species
- (en) ARKive
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (en) The Reptile Database
- (en) Système d'information taxonomique intégré
- (en) Union internationale pour la conservation de la nature
- (en) World Register of Marine Species
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (fr+en) Référence ITIS : Agkistrodon piscivorus (Lacépède, 1789) (consulté le )
- (en) Référence NCBI : Agkistrodon piscivorus (taxons inclus) (consulté le )
- (en) Référence Reptarium Reptile Database : Agkistrodon piscivorus (Lacépède, 1789) (consulté le )
- (en) Référence UICN : espèce Agkistrodon piscivorus (Lacépède, 1789) (consulté le )
- (en) Référence Wild Herps : photographies de Agkistrodon piscivorus (consulté le )
Bibliographie
- Allen ER, Swindell D. 1948. "The cottonmouth moccasin of Florida". Herpetologica, 4 (suppl. 1): 1–16.
- Baird SF, Girard C. 1853. Catalogue of North American Reptiles in the Museum of the Smithsonian Institution. Part I.—Serpentes. Washington, District of Columbia: Smithsonian Institution. xvi + 172 pp. (for a discussion of the publication date, see Adler, K. 1963. J. Ohio Herpetol. Soc. 4: 55–57).
- Bonnaterre, P-J. 1790. Ophiologie. pp. 1–76. In Tableau encyclopédique et méthodique des trois règnes de la nature [Encyclopédie Methodique]. Paris, France: Chez Panckoucke, Libraire. i–xliv + 1–76.
- Boulenger GA. 1893–1896. Catalogue of the Snakes in the British Museum (Natural History). Volume I. [1893], Containing the families Typhlopidæ, Glauconiidæ, Boidæ, Ilysiidæ, Uropeltidæ, Xenopeltidæ, Colubridæ Aglyphae, part. xiii + 448 pp. + Plates I-XXVIII. Volume III. [1896], Containing the Colubridæ (Opisthoglyphæ and Proteroglyphæ), Amblycephalidæ, and Viperidæ. xiv + 727 pp. + Plates I-XXV. London: Trustees of the British Museum (Natural History). (Taylor and Francis, printers).
- Brimley CS. 1944. Amphibians and Reptiles of North Carolina. Elon College, North Carolina, Carolina Biol. Supply Co., reprinted from Carolina Tips, 1939–43: 1–63.
- Catesby M. 1743. The natural history of Carolina, Florida and the Bahama Islands: Containing the figures of birds, beasts, fishes, serpents, insects, and plants: Particularly the forest-trees, shrubs, and other plants, not hitherto described, or very incorrectly figured by authors. Together with their descriptions in English and French. To which are added, observation on the air, soil, and waters; With remarks upon agriculture, grain, pulse, roots, &c, To the whole is prefixed a new and correct map of the countries treated of. London, Printed at the expense of the author, 1731–1743: 2 vols. Vol.II: 100 + 200 (appendix).
- Conant R. 1929. Notes on a water moccasin in captivity (Agkistrodon piscivorus) (female). Bull. Antivenin Inst. Amer. 3: 61–64.
- Cope ED. 1860 (dated 1859). Catalogue of the venomous serpents in the museum of the Academy of Natural Sciences of Philadelphia, with notes on the families, genera and species. Proc. Acad. Nat. Sci. Philadelphia 11: 332–347.
- Cope ED. 1875. Check-list of North American Batrachia and Reptiles with a systematic list of higher groups, and an essay on geographical distribution based on specimens contained in the United States National Museum. Washington, D.C.: Government Printing Office. 104 pp.
- Cuvier G. 1829. Le règne animal distribué d'après son organisation, pour servir de base à l'histoire naturelle des animaux det d'introduction à l'anatomie comparée. Tome II, contenant les reptiles, les poissons, les mollusques et les annélidés. Nouvelle édition. Paris: Déterville. xv + 406 pp.
- Daudin FM. 1801–1803. Histoire naturelle, générale et particulière des reptiles: ouvrage faisant suit à l'histoire naturelle générale et particulière, composée par Leclerc de Buffon; et rédigée par C.S. Sonnini, miembre de plusieurs sociétés savantes. 8 vols. Paris: F. Dufart. (for a discussion of the publication date, see F. Harper. 1940. Amer. Midl. Nat. 23: 693).
- Ditmars RL. 1912. The feeding habits of serpents. Zoologica 1: 197–238.
- Duméril A-M-C, Bibron G, Duméril A-H-A. 1854. Erpetologie générale ou histoire naturelle complète des reptiles. Vol. 7. (Parts 1 and 2). Paris: Librarie Encyclopédique de Roret. 1536 pp.
- Dunson WA, Freda J. 1985. Water permeability of the skin of the amphibious snake, Agkistrodon piscivorus. J. Herpetol. 19 (1): 93–98.
- Garman S. 1884 (dated 1883). The reptiles and batrachians of North America. Memoires of the Museum of Comparative Zoology 8 (3): 1–185.
- Garman S. 1890. Notes on Illinois reptiles and amphibians, including several specimens not before recorded from the northern states. Bulletin of the Illinois Natural History Survey 3: 185–190.
- Gloyd HK, Conant R. 1943. A synopsis of the American forms of Agkistrodon (copperheads and moccasins). Bull. Chicago Acad. Sci. 7: 147–170.
- Gray JE. 1842. Synopsis of the species of rattle-snakes, or family of Crotalidae. Zoological Miscellany, London 2: 47–51 (reprinted in 1971 by the Society for the Study of Amphibians and Reptiles).
- Harlan R. 1835. Medical and physical research of original memories in medicine, surgery, physiology, geology, zoology and comparative anatomy. Philadelphia. xxxix + 635 pp.
- Heinrich G, Studenroth KR Jr. 1996. Natural history notes: Agkistrodon piscivorus conanti (Florida cottonmouth). Diet. Herpetol. Rev. 27 (1): 22.
- Higgins SB. 1873. Ophidians, zoological arrangement of the different genera, including varieties known in North and South America, the East Indies, South Africa, and Australia. The poisons, and all that is known of their nature. The galls as antidotes to the snake venom. Pathological, toxicological, and microscopical facts; together with much interesting matter hitherto not published. New York: Boericke and Tafel. 239 pp.
- Holbrook JE. 1838. North American Herpetology; Or, a Description of the Reptiles Inhabiting the United States. Volume 2. Philadelphia, Pennsylvania: J. Dobson: i–iv + 5–125.
- Hubbs B, O'Connor B. 2012. A Guide to the Rattlesnakes and other Venomous Serpents of the United States. Tempe, Arizona: Tricolor Books. 129 pp. (ISBN 978-0-9754641-3-7).
- Humphreys JT. 1881. The king snake (Ophibolus sayi) sups on a full grown water moccasin (Ancistrodon piscivorus). Amer. Nat. 15: 561–562.
- Jan G. 1863. Elenco sistematico degli ofidi descritti e disegnati per l'iconografia generale. Milan, Italy: A. Lombardi. vii + 143 pp.
- Klauber LM. 1927. Some observations on the rattlesnakes of the extreme southwest. Bull. Antivenin Inst. Amer. 1 (1): 7–21.
- Lacépède BGE. 1789. Histoire naturelle des quadrupèdes ovipares et des serpentes, vol. 2 Table Méthodique. Paris, France: Hotel de Thou. 527 pp.
- Merrem B. 1820. Versuch eines Systems der Amphibien. Tentamen systematis amphibiorum. Marburg: J.C. Krieger. xv + 191 pp. + 1 plate.
- Niell Jr. WT. 1947. Size and habits of the cottonmouth moccasin. Herpetologica 3: 203–205.
- Niell Jr. WT. 1948. Hibernation of amphibians and reptiles in Richmond County, Georgia. Herpetologica 4: 107–114.
- Schmidt KP. 1953. A check list of North American amphibians and reptiles. Sixième édition. Chicago (Illinois), Amer. Soc. Icthyol. Herpetol. i–viii + 280 pp.
- George Shaw. 1802. General Zoology or Systematic Natural History. Vol. 3. Part 2. Amphibia. Londres, Thomas Davidson. vi + 313–615.
- Sonnini CS, Latreille PA. 1801. Histoire naturelle des reptiles, avec figures dissinées dápres nature. 4 Vols. Paris (for a discussion of the publication date, see Harper, F. 1940. Amer. Midl. Nat. 23: 692–723).
- Stejneger LH. 1895. The poisonous snakes of North America. Ann. Rept. U.S. Natl. Mus. 1893: 337–487.
- Stewart GD. 1974. Diagnosis of two new American snakes. Baltimore Univ. Comm. (529 N. Howard St. / "an unincorp. free lance organization"), 2:1[1].
- Walters AC, Card W. 1996. Natural history notes: Agkistrodon piscivorus conanti (Florida cottonmouth). Prey. Herpetol. Rev. 27 (4): 203.
- Wharton CH. 1960. Birth and behavior of a brood of cottonmouths, Agkistrodon piscivorus piscivorus, with notes on tail-luring. Herpetologica 16 (2): 125–129.
- Wharton CH. 1966. Reproduction and growth in the cottonmouth, Agkistrodon piscivorus Lacépède, of Cedar Keys, Florida. Copeia 1966 (2): 149–161.
- Wolff NO, Githens TS. 1939. Record venom extraction from water moccasin. Copeia 1939 (1): 52.
- Wood JT. 1954. The distribution of poisonous snakes in Virginia. Virginia Journal of Science 5: 152–167.
- Yarrow HC. 1882. Check list of North American Reptilia and Batrachia, with catalogue of specimens in the United States Museum. Bulletin of the U.S. National Museum 24: 1–249.
Notes et références
- Albert Valdman et Kevin J. Rottet, Dictionary of Louisiana French : as spoken in Cajun, Creole, and American Indian communities, University Press of Mississippi, (ISBN 978-1-60473-404-1 et 1-60473-404-3, OCLC 593259910, lire en ligne), p. 151
- Reptarium Reptile Database, consulté lors d'une mise à jour du lien externe
- Kardong, K. V. (1982). Comparative study of changes in prey capture behavior of the cottonmouth (Agkistrodon piscivorus) and Egyptian cobra (Naja haje). Copeia, 337-343.
- Vincent, S. E., Herrel, A., & Irschick, D. J. (2004). Sexual dimorphism in head shape and diet in the cottonmouth snake (Agkistrodon piscivorus). Journal of Zoology, 264(1), 53-59.
- Rainwater, T. R., Reynolds, K. D., Cañas, J. E., Cobb, G. P., Andersonv, T. A., McMurry, S. T., & Smith, P. N. (2005). Organochlorine pesticides and mercury in cottonmouths (Agkistrodon piscivorus) from northeastern Texas, USA. Environmental toxicology and chemistry, 24(3), 665-673.
- Campbell JA, Lamar WW. 2004. The Venomous Reptiles of the Western Hemisphere. Ithaca and London: Comstock Publishing Associates. 870 pp. 1500 plates. (ISBN 0-8014-4141-2).
- Conant, 1975
- Gloyd HK, Conant R. 1990. Snakes of the Agkistrodon Complex: A Monographic Review. Society for the Study of Amphibians and Reptiles. 614 pp. 52 plates. LCCN 89-50342. (ISBN 0-916984-20-6).
- Roark, A. W. (2003). Comparative genetic analysis in insular and mainland populations of the Florida cottonmouth, Agkistrodon piscivorus conanti (Doctoral dissertation, University of Florida).
- « Cottonmouth », Smithsonian National Zoological Park (consulté le )
- Gibbons JW, Dorcas ME. 2002. Defensive Behavior of Cottonmouths (Agkistrodon piscivorus) toward Humans. SREL Reprint #2583. Summary at the Savannah River Ecology Laboratory at the University of Georgia. Consulté le 29 mai 2007.
- Mehrtens JM. 1987. Living Snakes of the World in Color. New York: Sterling éditeurs. 480 pp. (ISBN 0-8069-6460-X).
- Carpenter CC, Gillingham JC. Ritualized Behavior in Agkistrodon and Allied Genera. 523–531. In Gloyd HK, Conant R. 1990. Snakes of the Agkistrodon Complex: A Monographic Review. Society for the Study of Amphibians and Reptiles. 614 pp. 52 plates. LCCN 89-50342. (ISBN 0-916984-20-6).
- Conant R. 1975. A Field Guide to Reptiles and Amphibians of Eastern and Central North America. Second Edition. prénom published in 1958. Boston: Houghton Mifflin Company. xviii + 429 pp. + 48 plates. (ISBN 0-395-19979-4) (hardcover), (ISBN 0-395-19977-8) (paperback). (Agkistrodon piscivorus, pp. 228–230 + Plate 34 + Map 173.)
- Brown JH. 1973. Toxicology and Pharmacology of Venoms from Poisonous Snakes. Springfield, Illinois: Charles C. Thomas. 184 pp. LCCCN 73-229. (ISBN 0-398-02808-7).
- Agkistrodon piscivorus at Munich AntiVenom INdex (MAVIN). Accessed 18 June 2008.
- U.S. Navy. 1991. Poisonous Snakes of the World. US Govt. New York: Dover Publications Inc. 203 pp. (ISBN 0-486-26629-X).
- Wright AH, Wright AA. 1957. Handbook of Snakes of the United States and Canada. Ithaca and London: Comstock Publishing Associates. (7th printing, 1985). 1,105 pp. (in 2 volumes) (ISBN 0-8014-0463-0). (Ancistrodon piscivorus, pp. 916–925, Figures 263–265 , Map 65.)
- Norris R. 2004. Venom Poisoning in North American Reptiles. In Campbell JA, Lamar WW. 2004. The Venomous Reptiles of the Western Hemisphere. Comstock Publishing Associates, Ithaca and London. 870 pp. 1500 plates. (ISBN 0-8014-4141-2).
- McDiarmid RW, Campbell JA, Touré T. 1999. Snake Species of the World: A Taxonomic and Geographic Reference, Volume 1. Washington, District of Columbia: Herpetologists' League. 511 pp. (ISBN 1-893777-00-6) (series). (ISBN 1-893777-01-4) (volume).
- Behler JL, King FW. 1979. The Audubon Society Field Guide to North American Reptiles and Amphibians. New York: Alfred A. Knopf. 743 pp. LCCCN 79-2217. (ISBN 0-394-50824-6).
- Gloyd, 1969 : Two additional subspecies of North American crotalid snakes, genus Agkistrodon. Proceedings of the Biological Society of Washington, vol. 82, p. 219-232 (texte intégral).
- « Agkistrodon piscivorus » (consulté le )
- G. A. Hammerson, « Agkistrodon piscivorus », (consulté le )
- « 2001 IUCN Red List Categories and Criteria version 3.1 », (consulté le )
- Indiana Legislative Services Agency, « 312 IAC 9-5-4: Endangered species of reptiles and amphibians », sur Indiana Administrative Code, (consulté le )
- Portail de l’herpétologie
