alpha-Toxine staphylococcique
L’α-toxine staphylococcique, ou α-hémolysine, est une toxine produite par le staphylocoque doré, dont elle est un facteur de virulence. Cette protéine cytotoxique est la première toxine porogène (en) à tonneau β identifiée[1]. Il s'agit d'un homoheptamère, constitué de sept monomères identiques de 293 résidus d'acides aminés chacun organisés à 68 % en feuillets β et à 10 % seulement en hélices α. Cet homoheptamère forme un pore dans la membrane plasmique délimité par un tonneau β complet. Ces pores abolissent le rôle protecteur de la membrane plasmique, portant atteinte à l'intégrité de la cellule, ce qui conduit à la mort de cette dernière. L'α-toxine est codée par le gène hla du chromosome du staphylocoque doré.
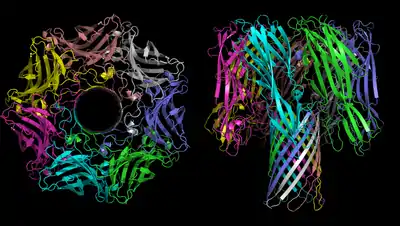
Structure et mode d'action
La structure de l'α-toxine staphylococcique a été résolue par cristallographie aux rayons X[2]. Sept monomères possédant une longue épingle à cheveux β s'associent pour former un tonneau β à 14 brins qui délimitent un pore de 1,4 nm (environ quatre fois le diamètre d'un cation de calcium Ca2+) dans sa plus petite largeur à travers la membrane plasmique.
On a pu montrer que l'α-toxine joue un rôle dans la pathogenèse dans la mesure où l'inactivation du gène hla réduit la virulence et la capacité invasive du staphylocoque doré[3]. On observe deux modes d'action différents selon le dosage de la toxine. À faible concentration, l'α-toxine se lie à des récepteurs membranaires non identifiés et forme des pores heptamériques qui favorisent l'échange d'ions monovalents et conduisent à la fragmentation de l'ADN et à l'apoptose[4]. À concentration plus élevée, l'α-toxine est absorbée dans la bicouche lipidique et forme de grands pores laissant les cations de calcium Ca2+ pénétrer en masse dans la cellule, ce qui déclenche sa nécrose et diverses réactions secondaires délétères[4].
On a également montré que l'α-toxine intervient en induisant l'apoptose de certains leucocytes humains. L'incubation de lymphocytes T, de monocytes et de lymphocytes du sang périphérique (en) avec de l'α-toxine purifiée ou des lysats de cellules de staphylocoque doré déclenche l'apoptose par la voie intrinsèque[4], effet qui disparaît avec l'adjonction de deux anticorps anti-α-toxine. La même étude a montré que l'α-toxine active la caspase 8 et la caspase 9, lesquelles activent à leur tour la caspase 3, déclenchant une dégradation massive de l'ADN et l'apoptose.
Développement de vaccins
L'α-toxine est un facteur de virulence essentiel de la pneumonie à staphylocoque doré[5]. Le degré de virulence d'une souche de staphylocoque doré dépend directement du niveau d'expression d'α-toxine par cette souche[3]. On a pu protéger des souris contre la pneumonie à staphylocoque doré en les immunisant avec une forme mutée d'α-toxine rendue incapable de former des pores dans les membranes plasmiques. Il est également possible de protéger un animal non immunisé en lui administrant des anticorps anti-α-toxine. Des cellules épithéliales humaines de poumon cultivées avec des anticorps anti-α-toxine présentent ainsi une nette réduction des effets d'une infection à staphylocoque doré que des cellules de contrôle cultivées sans ces anticorps. Ces recherches peuvent offrir des perspectives intéressantes pour se protéger de souches bactériennes qui tendent de plus en plus à devenir résistantes aux antibiotiques.
Notes et références
- (en) S. Bhakdi et J. Tranum-Jensen, « Alpha-toxin of Staphylococcus aureus », Microbiology and Molecular Biology Reviews, vol. 55, no 4, , p. 733-751 (PMID 1779933, PMCID 372845, lire en ligne)
- (en) Langzhou Song, Michael R. Hobaugh, Christopher Shustak, Stephen Cheley, Hagan Bayley et J. Eric Gouaux, « Structure of Staphylococcal α-Hemolysin, a Heptameric Transmembrane Pore », Science, vol. 274, no 5294, , p. 1859-1866 (PMID 8943190, DOI 10.1126/science.274.5294.1859, Bibcode 1996Sci...274.1859S, lire en ligne)
- (en) Juliane Bubeck Wardenburg et Olaf Schneewind, « Vaccine protection against Staphylococcus aureus pneumonia », Journal of Experimental Medicine, vol. 205, no 2, , p. 287-294 (PMID 18268041, PMCID 2271014, DOI 10.1084/jem.20072208, lire en ligne)
- (en) Heike Bantel, Bhanu Sinha, Wolfram Domschke, Georg Peters, Klaus Schulze-Osthoff et Reiner U. Jänicke, « α-Toxin is a mediator of Staphylococcus aureus–induced cell death and activates caspases via the intrinsic death pathway independently of death receptor signaling », Journal of Cell Biology, vol. 155, no 4, , p. 637-648 (PMID 11696559, PMCID 2198876, DOI 10.1083/jcb.200105081, lire en ligne)
- (en) Juliane Bubeck Wardenburg2, Taeok Bae, Michael Otto, Frank R DeLeo et Olaf Schneewind, « Poring over pores: α-hemolysin and Panton-Valentine leukocidin in Staphylococcus aureus pneumonia », Nature Medicine, vol. 13, no 12, , p. 1405-1406 (PMID 18064027, DOI 10.1038/nm1207-1405, lire en ligne)
- Portail de la biochimie
- Portail de la biologie cellulaire et moléculaire