Tonneau bêta
Un tonneau β est une structure protéique constituée d'un grand feuillet β qui se tord et s'enroule pour former une structure quasi-cylindrique fermée par des liaisons hydrogène. Les feuillets bêta sont généralement arrangés de façon antiparallèle, le premier brin étant lié au dernier par liaisons hydrogène.
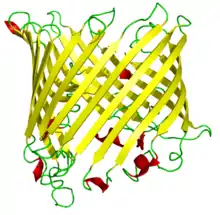
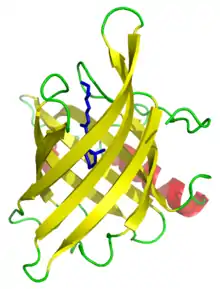
On trouve plusieurs types de tonneaux β de diamètres variables. Les plus grands permettent de ménager un canal central permettant la fixation ou le passage de petites molécules ou d'ions. D'autres sont plus compacts et ne comportent pas de canal central mais utilisent ce motif au sein de la structure de protéines globulaires, dont ils constituent souvent des domaines structuraux.
On trouve ainsi des tonneaux β dans les porines et diverses protéines, (telles des translocases de la membrane mitochondriale interne, ou même au sein de toxines bactériennes comme l'hémolysine) qui s'étendent sur les membranes cellulaires ainsi que dans les protéines qui se lient à des ligands hydrophobes au centre du tonneau, comme les lipocalines. Les structures en tonneau de type porine sont encodées par pas moins de 2 à 3 % des gènes des bactéries à Gram négatif[1]. Un motif en tonneau β compact très commun est le motif dit OB-fold (oligonucleotide-binding fold) qui comporte cinq brins bêta[2], on le retrouve chez toutes les espèces vivantes et il est présent dans environ 300 protéines codées dans le génome humain.
Dans de nombreux cas, les feuillets contiennent des acides aminés polaires et apolaires, de sorte que les résidus hydrophobes sont orientés vers l'intérieur du tonneau pour former un cœur hydrophobe tandis que les résidus hydrophiles sont à l'extérieur du tonneau, au contact du milieu aqueux. Les porines et diverses autres protéines membranaires inversent cette organisation, avec des résidus hydrophobes orientés vers l'extérieur du tonneau au contact de la bicouche lipidique et des résidus hydrophiles orientés vers le pore intérieur.
Tous les tonneaux β peuvent être classifiés en fonction deux nombres entiers : le nombre n de brins dans le feuillet β et le « nombre de cisaillement » S, qui mesure le décalage des brins dans les feuillets β[3]. Ces deux paramètres, n et S, sont liés à l'angle d'inclinaison des feuillets β par rapport à l'axe du tonneau[4],[5].
Typologie des tonneaux β
Les modes de repliement constituant les tonneaux β peuvent se classer en trois types ci-dessous :
Va-et-vient
Le mode de repliement dit en « va-et-vient » (up-and-down en anglais) est la plus simple des configurations formant tonneau β, consistant en une série de feuillets β, généralement antiparallèles, dont chaque brin est lié par liaison hydrogène à celui qui le précède immédiatement et à celui qui le suit immédiatement dans la structure primaire. C'est le mode observé dans les protéines de liaison du rétinol.
Clé grecque
Le mode de repliement dit en « clé grecque » (greek key en anglais) diffère du précédent en ce que les brins en feuillets β liés entre eux par liaison hydrogène ne sont pas nécessairement adjacents dans la structure primaire mais peuvent être reliés par de grandes boucles peptidiques, fréquemment associées à des coudes β. C'est le mode observé dans les cristallines γ, protéines structurelles hydrosolubles du cristallin.
Gâteau roulé
Le mode de repliement dit en « gâteau roulé » (jelly roll ou parfois Swiss roll en anglais) dérive du précédent dans le cas par exemple des feuillets β à huit brins qui s'associent par paires antiparallèles de l'extérieur vers l'intérieur de la structure primaire avant de constituer le tonneau. C'est un mode fréquemment observé dans les protéines de capsides de nombreux virus sphériques tels que le virus de la nécrose du tabac.
Fonctions des tonneaux β
Porines
Les structures en tonneau β à seize ou dix-huit brins sont courantes dans les porines, qui sont des protéines membranaires fonctionnant comme des transporteurs membranaires pour les ions et les petites molécules hydrophiles qui ne peuvent traverser la bicouche lipidique. On observe de telles structures dans la membrane externe des bactéries à Gram négatif, la membrane externe des chloroplastes, et celle des mitochondries (membrane mitochondriale externe). Le pore central de la protéine est tapissé de résidus polaires disposés de telle sorte que les charges positives et négatives se trouvent sur les côtés opposés du pore. Une longue boucle entre deux feuillets β ferme partiellement le canal central, donnant une forme et une conformation spécifique qui contribue à sélectionner les espèces chimiques susceptibles de circuler à travers le pore.
Translocases de préprotéines
Les structures en tonneau β interviennent également dans le transport des protéines à travers les membranes d'organites tels que les mitochondries et les chloroplastes[6] :
- les mitochondries possèdent deux complexes protéiques ayant des tonneaux β qui interviennent comme sous-unités constitutives de pores à travers la membrane mitochondriale externe : Tom40 pour la translocase de la membrane externe (en) et Sam50 du complexe SAM (en) ;
- les chloroplastes possèdent des complexes semblables à ceux des mitochondries, dont le mieux caractérisé est Toc75, du translocon de l'enveloppe externe des chloroplastes.
Lipocalines
Les lipocalines sont des protéines possédant généralement un tonneau β à huit brins qui sont souvent sécrétées dans le milieu extracellulaire. Leur trait le plus caractéristique est leur capacité à se lier et à transporter de petites molécules hydrophobes dans le calice du tonneau. Il s'agit notamment des protéines de liaison du rétinol (RBP) et des protéines urinaires majeures (MUP) : les premières se lient au rétinol tandis que les secondes se lient à plusieurs petites phéromones telles que le 2-sec-butyl-4,5-dihydrothiazole (SBT, ou DHT), la 6-hydroxy-6-méthyl-3-heptanone (HMH) et la 2,3-dihydro-exo-brévicomine (DHB)[7],[8],[9].
Notes et références
- (en) William C Wimley, « The versatile β-barrel membrane protein », Current Opinion in Structural Biology, vol. 13, no 4, , p. 404-411 (PMID 12948769, DOI 10.1016/S0959-440X(03)00099-X, lire en ligne)
- (en) A.G. Murzin, « OB(oligonucleotide/oligosaccharide binding)-fold: common structural and functional solution for non-homologous sequences », EMBO J., vol. 12, , p. 861-867 (PMID 8458342, PMCID 413284)
- (en) Alexey G. Murzin, Arthur M. Lesk et Cyrus Chothia, « Principles determining the structure of β-sheet barrels in proteins I. A theoretical analysis », Journal of Molecular Biology, vol. 236, no 5, , p. 1369-1381 (PMID 8126726, DOI 10.1016/0022-2836(94)90064-7, lire en ligne)
- (en) Alexey G. Murzin, Arthur M. Lesk et Cyrus Chothia, « Principles determining the structure of β-sheet barrels in proteins II. The observed structures », Journal of Molecular Biology, vol. 236, no 5, , p. 1382-1400 (PMID 8126727, DOI 10.1016/0022-2836(94)90065-5, lire en ligne)
- (en) Wei-min Liu, « Shear numbers of protein β-barrels: definition refinements and statistics », Journal of Molecular Biology, vol. 275, no 4, , p. 541-545 (PMID 9466929, DOI 10.1006/jmbi.1997.1501, lire en ligne)
- (en) Enrico Schleiff et Jürgen Soll, « Membrane protein insertion: mixing eukaryotic and prokaryotic concepts », EMBO Reports, vol. 6, no 11, , p. 999-1103 (PMID 16264426, DOI 10.1038/sj.embor.7400563, lire en ligne)
- (en) Mimi Halpern et Alino Martı́nez-Marcos, « Structure and function of the vomeronasal system: an update », Progress in Neurobiology, vol. 70, no 3, , p. 245-318 (PMID 12951145, DOI 10.1016/S0301-0082(03)00103-5, lire en ligne)
- (en) David E. Timm, L.J. Baker, Heather Mueller, Lukas Zidek et Milos V. Novotny, « Structural basis of pheromone binding to mouse major urinary protein (MUP-I) », Protein Science, vol. 10, no 5, , p. 997-1004 (PMID 11316880, PMCID 2374202, DOI 10.1110/ps.52201, lire en ligne)
- (en) Stuart D. ARMSTRONG, Duncan H. L. ROBERTSON, Sarah A. CHEETHAM, Jane L. HURST et Robert J. BEYNON, « Structural and functional differences in isoforms of mouse major urinary proteins: a male-specific protein that preferentially binds a male pheromone », Biochemical Journal, vol. 391, no Pt 2, , p. 343-350 (PMID 15934926, PMCID 1276933, DOI 10.1042/BJ20050404, lire en ligne)
- Portail de la biochimie