Anion non coordinant
Un anion non coordinant, ou, de manière plus exacte, faiblement coordinant, est un anion qui interagit peu avec les autres ions et molécules[1]. Se présentant généralement sous la forme de complexes de grande taille, ils sont utiles pour étudier la réactivité des cations électrophiles. On les rencontre généralement sous forme de contre-ions de complexes métalliques cationiques avec une sphère de coordination insaturée. Ce sont des composants essentiels des catalyseurs homogènes de polymérisation des alcènes, ou oléfines, dans lesquels le catalyseur actif est un complexe d'un cation de métal de transition coordonné. On peut les utiliser par exemple comme contre-ions pour les cations à 14 électrons de valence de la forme [(C5H5)2ZrR]+, où R représente un groupe méthyle –CH3 ou une chaîne de polyéthylène –[CH2–CH2–]n en croissance. Ce sont également des composants importants de nombreux superacides, qui résultent de la combinaison d'acides de Brønsted et d'acides de Lewis.

Des complexes dérivés d'anions non coordinants ont été utilisés pour catalyser des réactions d'hydrogénation, d'hydrosilylation, d'oligomérisation et de polymérisation vivante des alcènes. La popularisation des anions non coordinants a contribué à une meilleure compréhension des complexes agostiques dans lesquels de l'hydrogène et des hydrocarbures jouent le rôle de ligands.
Exemples
Jusque dans les années 1990, les ions tétrafluoroborate BF4−, hexafluorophosphate PF6− et perchlorate ClO4− étaient considérés comme des anions non coordinants. Ces espèces sont connues pour se lier étroitement aux métaux électrophiles[2],[3]. Les anions tétrafluoroborate et hexafluorophosphate sont coordinants avec les ions métalliques très électrophiles, comme les cations contenant des centres Zr(IV), capables de déplacer le fluorure F− de ces anions. D'autres anions, comme les triflates CF3SO3− sont considérés comme faiblement coordinants avec certains cations.

Les recherches relatives aux anions non coordinants ont connu un tournant dans les années 1990 avec l'introduction de l'ion tétrakis[3,5-bis(trifluorométhyl)phényl]borate B[3,5-(CF3)2C6H3]4−, couramment noté [BArF4]− et surnommé familièrement « BARF »[4]. Cet anion est bien moins coordinant que BF4−, PF6− et ClO4− et a par conséquent permis d'étudier des cations encore plus électrophiles[5]. Parmi les anions apparentés, on peut noter l'ion tétrakis(pentafluorophényl)borate B(C6F5)4− et l'ion Al[OC(CF3)3]4−. Ces anions présentent en outre l'avantage de former des sels davantage solubles dans les solvants organiques apolaires comme le dichlorométhane CH2Cl2 et le toluène C6H5CH3. Les solvants polaires, comme l'eau H2O, l'acétonitrile CH3CN et le tétrahydrofurane (CH2)4O se lient aux centres électrophiles, ce qui rend inutile l'utilisation d'un anion non coordinant.
Des sels de l'anion B[3,5-(CF3)2C6H3]4− ont été publiés pour la première fois par Kobayashi et al., raison pour laquelle le BARF est parfois désigné comme l'anion de Kobayashi[6]. Le mode de préparation de cet anion par cette équipe a cependant été remplacée depuis par une voie plus sûre[4].
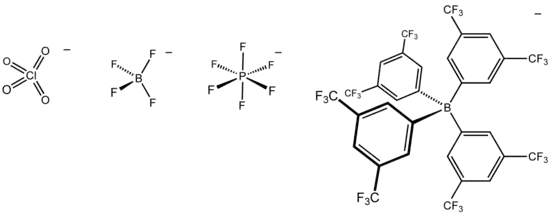
Les molécules neutres dont dérivent les anions non coordinants sont des acides de Lewis forts, comme le trifluorure de bore BF3 et le pentafluorure de phosphore PF5. Un acide de Lewis remarquable de ce type est le tris(pentafluorophényl)borane (C6F5)3B, capable de déplacer des ligands alkyle[7] :
- (C5H5)2Zr(CH3)2 + B(C6F5)3 → [(C5H5)2Zr(CH3)]+[(CH3)B(C6F5)3]−.
Les dérivés du carborane CB11H12− forment une autre grande famille d'anions non coordinants. Cet anion a donné le premier exemple d'un composé de silicium tricoordonné, le [(mésityl)3Si][HCB11Me5Br6], qui contient un anion non coordinant dérivé d'un carborane[8]. La substitution de tous les atomes d'hydrogène par des atomes de fluor donne le carborate [1-R-CB11F10]−, où R représente un groupe méthyle –CH3 ou éthyle –CH2CH3, qui est particulièrement stable et peu basique, et parmi les moins coordinants des anions[9].
Notes et références
- (en) Ingo Krossing et Ines Raabe, « Noncoordinating Anions—Fact or Fiction? A Survey of Likely Candidates », Angewandte Chemie, International Edition, vol. 43, no 16, , p. 2066-2090 (PMID 15083452, DOI 10.1002/anie.200300620, lire en ligne)
- (en) Robert V. Honeychuck et William H. Hersh, « Coordination of "noncoordinating" anions: synthesis, characterization, and x-ray crystal structures of fluorine-bridged hexafluoroantimonate(1-), tetrafluoroborate(1-), and hexafluorophosphate(1-) adducts of [R3P(CO)3(NO)W]+. An unconventional order of anion donor strength », Inorganic Chemistry, vol. 28, no 14, , p. 2869-2886 (DOI 10.1021/ic00313a034, lire en ligne)
- (en) H. Gordon Mayfield et William E. Bull, « Co-ordinating tendencies of the hexafluorophosphate ion », Journal of the Chemical Society A: Inorganic, Physical, Theoretical, , p. 2279-2281 (DOI 10.1039/J19710002279, lire en ligne)
- (en) Neal A. Yakelis et Robert G. Bergman, « Safe Preparation and Purification of Sodium Tetrakis[(3,5-trifluoromethyl)phenyl]borate (NaBArF24): Reliable and Sensitive Analysis of Water in Solutions of Fluorinated Tetraarylborates », Organometallics, vol. 24, no 14, , p. 3579-3581 (PMID 19079785, PMCID 2600718, DOI 10.1021/om0501428, lire en ligne)
- (en) M. Brookhart, B. Grant et A. F. Volpe Jr., « [(3,5-(CF3)2C6H3)4B]−[H(OEt2)2]+: a convenient reagent for generation and stabilization of cationic, highly electrophilic organometallic complexes », Organometallics, vol. 11, no 11, , p. 3920-3922 (DOI 10.1021/om00059a071, lire en ligne)
- (en) Nishida Hiroshi, Takada Naoko, Yoshimura Masaji, Sonoda Takaaki et Kobayashi Hiroshi, « Tetrakis[3,5-bis(trifluoromethyl)phenyl]borate. Highly Lipophilic Stable Anionic Agent for Solvent-extraction of Cations », Bulletin of the Chemical Society of Japan, vol. 57, no 9, , p. 2600-2604 (DOI 10.1246/bcsj.57.2600, lire en ligne)
- (en) Gerhard Erker, « Tris(pentafluorophenyl)borane: a special boron Lewis acid for special reactions », Dalton Transactions, no 11, , p. 1883-1890 (DOI 10.1039/B503688G, lire en ligne)
- (en) Kee-Chan Kim, Christopher A. Reed, Douglas W. Elliott, Leonard J. Mueller, Fook Tham, Lijun Lin, Joseph B. Lambert, « Crystallographic Evidence for a Free Silylium Ion », Science, vol. 297, no 5582, , p. 825-827 (PMID 12161650, DOI 10.1126/science.1073540, Bibcode 2002Sci...297..825K, lire en ligne)
- (en) Daniel Stasko et Christopher A. Reed, « Optimizing the Least Nucleophilic Anion. A New, Strong Methyl+ Reagent », Journal of the American Chemical Society, vol. 124, no 7, , p. 1148-1149 (PMID 11841265, DOI 10.1021/ja0118800, lire en ligne)
- Portail de la chimie