Acide phosphoénolpyruvique
L’acide phosphoénolpyruvique — ou phosphoénolpyruvate sous forme déprotonée, abrégée en PEP — est un composé organique important en biochimie, en raison notamment de son groupe phosphate à haut potentiel de transfert (ΔG°' = −61,9 kJ mol−1, valeur la plus élevée trouvée chez les êtres vivants). Il intervient par conséquent comme métabolite de la glycolyse en relation avec la chaîne respiratoire, fournissant l'énergie nécessaire à la phosphorylation d'une molécule d'ADP en ATP. Il intervient également comme accepteur de CO2 hydraté (HCO3-) chez les plantes au métabolisme C4 ou CAM, pour former l'oxaloacétate, dans une réaction catalysée par la phosphoénolpyruvate carboxylase.
Pour les articles homonymes, voir PEP.
| Acide phosphoénolpyruvique | |
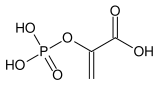 Structure de l'acide phosphoénolpyruvique |
|
| Identification | |
|---|---|
| Nom UICPA | Acide 2-phosphonooxyprop-2-ènoïque |
| No CAS | |
| No ECHA | 100.004.830 |
| No CE | 205-312-2 |
| PubChem | 1005 |
| ChEBI | 44897 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C3H5O6P [Isomères] |
| Masse molaire[1] | 168,042 ± 0,004 6 g/mol C 21,44 %, H 3 %, O 57,13 %, P 18,43 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Rôle dans la glycolyse
'Biosynthèse' 'Dégradation' 
H2O + 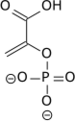

+ ADP + H+ → ATP + 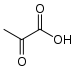
2PG PEP PEP Pyruvate Énolase (phosphopyruvate hydratase) – EC Pyruvate kinase – EC
Biosynthèse
Le 2-phospho-D-glycérate (2PG) produit au cours de la glycolyse est déshydraté par une lyase, l’énolase (ou phosphopyruvate hydratase), pour former le phosphoénolpyruvate (PEP). Un cation Mg2+ est requis comme « catalyseur » de la réaction de déshydratation, tandis qu'un second Mg2+ intervient avec un rôle « conformationnel » en coordination avec le groupe carboxyle du 2PG.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.