Carvacrol
Le carvacrol, ou cymophénol, C6H3CH3(OH)(C3H7), est un phénol monoterpénoïde. Il a un arôme chaud et piquant, caractéristique de l'origan[4].
| Carvacrol | |
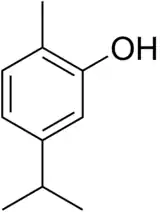
| |
| Structure du carvacrol | |
| Identification | |
|---|---|
| Nom UICPA | 2-méthyl-5-(propan-2-yl)phénol |
| No CAS | |
| No ECHA | 100.007.173 |
| No CE | 207-889-6 |
| PubChem | 10364 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H14O [Isomères] |
| Masse molaire[1] | 150,217 6 ± 0,009 3 g/mol C 79,96 %, H 9,39 %, O 10,65 %, |
| Propriétés physiques | |
| T° fusion | 2,5 °C [2] |
| T° ébullition | 236,85 °C [3] |
| Masse volumique | (20 °C) 0,977 2–0,98 g·cm-3 |
| Thermochimie | |
| ΔfH0gaz | −194,2 kJ·mol-1 [3] |
| ΔfH0liquide | −270 kJ·mol-1 [3] |
| ΔvapH° | 77,74 kJ·mol-1 [3] |
| PCI | −5 650 kJ·mol-1 (liquide)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Sources naturelles
Le carvacrol se trouve dans les huiles essentielles obtenues notamment à partir de l'origan, du thym, du cresson alénois ou de la monarde. Chez le thym, l'huile essentielle contient, selon les sous-espèces, de 5 % à 75 % de carvacrol, tandis que les sous-espèces de sarriette (Satureja) en contiennent de 1 % à 45 %. Dans le genre origan, la marjolaine et le dictame de Crète sont riches en carvacrol, respectivement 50 % et 60 à 80 %[5].
Propriétés biologiques et utilisation
Le carvacrol inhibe la croissance de plusieurs souches de bactéries, par exemple Escherichia coli[6] et Bacillus cereus. Sa faible toxicité ainsi que son goût et son arôme agréables ont conduit à son utilisation comme additif alimentaire pour prévenir la contamination bactérienne[7]. Chez Pseudomonas aeruginosa, il provoque des lésions de la membrane cellulaire de ces bactéries et, contrairement à d'autres terpènes, il inhibe la prolifération de ces germes[8]. On attribue l'origine de ces propriétés antimicrobiennes à une désorganisation de la membrane bactérienne[9],[10].
C'est un activateur potentiel des potentiels récepteurs transitoires V3 (TRPV3) et A1 (TRPA1) des canaux ioniques humains[11]. L'application de carvacrol sur la langue, comme l'activation des TRPV3, provoque une sensation de chaleur. En outre, le carvacrol active, mais les désensibilise rapidement, les récepteurs de douleur TRPA1, ce qui explique son caractère piquant[11].
Chez le rat, le carvacrol est rapidement métabolisé et excrété. La principale voie métabolique est l'estérification du groupe phénolique par l'acide sulfurique et l'acide glucuronique. Une voie secondaire est l'oxydation des groupes méthyl terminaux en alcools primaires. Après un délai de 24 heures seules des traces de carvacrol ou de ses métabolites peuvent être retrouvées dans l'urine, indiquant une excrétion presque totale en un seul jour[12].
Plusieurs formes ou applications sont possibles notamment sous la forme d'émulsions de Pickering auto-assemblées avec des cyclodextrines[13],[14].
Production et synthèse
Le carvacrol peut se préparer par voie synthétique par la fusion de l'acide cymol-sulfonique avec de la potasse caustique ; par l'action de l'acide nitreux sur le 1-méthyl-2-amino-4-propyl benzène ; par le chauffage prolongé de cinq parts de camphre avec une part d'iode ; ou par le chauffage de carvol avec de l'acide phosphorique glacial ou en réalisant la déshydrogénation du carvone avec un catalyseur Pd/C. On peut l'extraire de l'huile d'origan par l'action d'une solution de potasse à 50 %. C'est une huile épaisse qui se prend à 20 °C en une masse de cristaux dont le point de fusion est à 0 °C, et le point d'ébullition à 236-237 °C. L'oxydation par le chlorure ferrique le convertit en dicarvacrol, tandis que pentachlorure de phosphore le transforme en chlorcymol.
Traitement contre la covid-19
Utilisée dans certains pays cette molécule serait un possible traitement de la covid-19 [15]. L'académie de médecine du Venezuela envisage son utilisation [16].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Carvacrol » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- {{Physical Constants of Organic Compounds," in CRC Handbook of Chemistry and Physics, 100th Edition (Internet Version 2019), [John R. Rumble], ed., [CRC Press/Taylor & Francis], Boca Raton, FL.}}, consulté le 15 juillet 2019
- (en) « Phenol, 2-methyl-5-(1-methylethyl)- », sur NIST/WebBook, consulté le 23 mars 2010
- (en) Ultee A, Slump RA, Steging G, Smid EJ, « Antimicrobial activity of carvacrol toward Bacillus cereus on rice », J. Food Prot., vol. 63, no 5, , p. 620–4 (PMID 10826719)
- (en) De Vincenzi M, Stammati A, De Vincenzi A, Silano M, « Constituents of aromatic plants: carvacrol », Fitoterapia, vol. 75, nos 7-8, , p. 801–4 (PMID 15567271, DOI 10.1016/j.fitote.2004.05.002)
- (en) Du WX, Olsen CE, Avena-Bustillos RJ, McHugh TH, Levin CE, Friedman M, « Storage Stability and Antibacterial Activity against Escherichia coli O157:H7 of Carvacrol in Edible Apple Films Made by Two Different Casting Methods », J. Agric. Food Chem., vol. 56, , p. 3082 (PMID 18366181, DOI 10.1021/jf703629s)
- (en) Ultee A, Smid EJ, « Influence of carvacrol on growth and toxin production by Bacillus cereus », Int. J. Food Microbiol., vol. 64, no 3, , p. 373–8 (PMID 11294360, DOI 10.1016/S0168-1605(00)00480-3, lire en ligne)
- (en) Cox SD, Markham JL, « Susceptibility and intrinsic tolerance of Pseudomonas aeruginosa to selected plant volatile compounds », J. Appl. Microbiol., vol. 103, no 4, , p. 930–6 (PMID 17897196, DOI 10.1111/j.1365-2672.2007.03353.x)
- (en) Di Pasqua R, Betts G, Hoskins N, Edwards M, Ercolini D, Mauriello G, « Membrane toxicity of antimicrobial compounds from essential oils », J. Agric. Food Chem., vol. 55, no 12, , p. 4863–70 (PMID 17497876, DOI 10.1021/jf0636465)
- (en) Cristani M, D'Arrigo M, Mandalari G, et al., « Interaction of four monoterpenes contained in essential oils with model membranes: implications for their antibacterial activity », J. Agric. Food Chem., vol. 55, no 15, , p. 6300–8 (PMID 17602646, DOI 10.1021/jf070094x)
- (en) Xu H, Delling M, Jun JC, Clapham DE, « Oregano, thyme and clove-derived flavors and skin sensitizers activate specific TRP channels », Nat. Neurosci., vol. 9, no 5, , p. 628–35 (PMID 16617338, DOI 10.1038/nn1692)
- (en) Austgulen LT, Solheim E, Scheline RR, « Metabolism in rats of p-cymene derivatives: carvacrol and thymol », Pharmacol. Toxicol., vol. 61, no 2, , p. 98–102 (PMID 2959918, DOI 10.1111/j.1600-0773.1987.tb01783.x)
- (en) Loïc Leclercq, Jérémie Tessier, Grégory Douyère et Véronique Nardello-Rataj, « Phytochemical- and Cyclodextrin-Based Pickering Emulsions: Natural Potentiators of Antibacterial, Antifungal, and Antibiofilm Activity », Langmuir, vol. 36, no 16, , p. 4317–4323 (ISSN 0743-7463 et 1520-5827, DOI 10.1021/acs.langmuir.0c00314, lire en ligne, consulté le )
- (en) Loïc Leclercq, Jérémie Tessier, Véronique Nardello-Rataj et Andreea R Schmitzer, « Highly active, entirely biobased antimicrobial Pickering emulsions », ChemMedChem, , cmdc.202100030 (ISSN 1860-7179 et 1860-7187, DOI 10.1002/cmdc.202100030, lire en ligne, consulté le )
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7921315/
- https://academianacionaldemedicina.org/publicaciones/cm-nota-preliminar-sobre-el-antiviral-carvativir-como-medicamento-para-el-covid-19-25-01-2021/
- (en) « Carvacrol », dans Encyclopædia Britannica, 1911 [
 (en) Lire en ligne sur Wikisource].
(en) Lire en ligne sur Wikisource].
- Portail de la chimie