Catalyseur d'oxydation de l'eau
Les catalyseurs d'oxydation de l'eau permettent l'accélération de la conversion de l'eau H2O en oxygène O2 et en protons H+ :
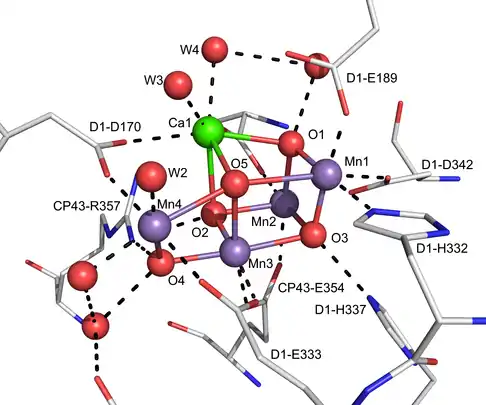
De nombreux types de tels catalyseurs peuvent être utilisés, aussi bien en catalyse homogène qu'en catalyse hétérogène. Le complexe d'oxydation de l'eau du photosystème II dans la photosynthèse en est un exemple. L'intérêt de ce processus réside dans le fait qu'il peut permettre de produire de l'hydrogène[2], comme le craquage de l'eau. Un bon catalyseur d'oxydation de l'eau est caractérisé par un fonctionnement à faible surtension, une bonne stabilité, la mise en œuvre de précurseurs non toxiques, le tout à un coût modéré.
Catalyse homogène
Complexes de ruthénium
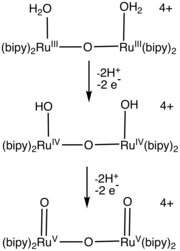
Un certain nombre de complexes aqua-ruthénium catalysent l'oxydation de l'eau. La plupart de ces catalyseurs comprennent des ligands bipyridine et terpyridine[2],[3],[4]. Les catalyseurs à acide picolinique (acide pyridine-2-carboxylique) présentent une constante catalytique de l'ordre 300 s−1 comparable à celle du photosystème II[5],[6]. Des ligands polypyridyle ont également été étudiés[7],[8].
Complexes de cobalt et de fer
Les premiers exemples de catalyseurs de l'oxydation de l'eau à base de cobalt étaient instables[9]. Un catalyseur homogène [Co(Py5)(H2O)](ClO4)2[10] fonctionne par transfert couplé d'électron et de proton (en) (PCET) pour former une espèce [CoIII–OH]2+, qui, lors d'une oxydation supplémentaire, forme un intermédiaire CoIV. L'intermédiaire formé réagit avec l'eau pour libérer l'O2. Le complexe cobalt-polyoxométallate [Co4(H2O)2(α-PW9O34)2]10− est un catalyseur d'oxydation de l'eau très efficace[11].
Certains complexes de fer catalysent également l'oxydation de l'eau, comme le complexe soluble dans l'eau [Fe(OTf)2(Me2PyTACN)], où Me2PyTACN indique le triméthyltriazacyclononane substitué avec une pyridine et OTf indique le triflate, qui est un catalyseur efficace. De nombreux complexes apparentés avec des sites cis labiles sont des catalyseurs actifs. Il s'avère que la plupart d'entre eux se dégrade en quelques heures. On peut obtenir des catalyseurs de plus grande stabilité en utilisant des clathrochélates robustes qui stabilisent les états d'oxydation élevés du fer et empêchent la dégradation rapide du catalyseur[12]. Le nombre et la stéréochimie des sites de coordination réactifs sur l'atome de fer ont été étudiés, mais sans que cela dégage de tendance claire[13].
Complexes d'iridium
Les complexes [Ir(ppy)2(OH2)2]+, où ppy indique la 2-phénylpyridine présentent une constante catalytique élevée mais une vitesse de réaction faible, donc un nombre réduit de sites catalytiques. Le remplacement de la 2-phénylpyridine par le pentaméthylcyclopentadiényle C5Me5, généralement noté Cp*, entraîne en revanche une augmentation de l'activité catalytique mais une diminution de la constante catalytique[14]. L'attaque nucléophile de l'eau sur les espèces Ir=O est à l'origine de la formation d'O2[15].
Catalyse hétérogène
L'oxyde d'iridium est un catalyseur d'oxydation de l'eau solide et stable qui ne demande qu'une surtension assez faible[16].
Une couche mince d'oxyde à base de nickel et de borate peut libérer de l'oxygène dans des conditions quasi neutres et à une surtension d'environ 425 mV en restant stable assez longtemps[17]. Sa structure a pu être étudiée par spectroscopie des rayons X et s'est montrée semblable aux catalyseurs à base de couches minces de cobalt et aux colloïdes de manganèse[18],[19],[20].
L'oxyde de cobalt(II,III) Co3O4 a été étudié également pour un fonctionnement semblable à celui d'autres sels de cobalt[21]. Il existe également des catalyseurs d'oxydation l'eau actifs à pH neutre à base de phosphates de cobalt[22].
Les nanomatériaux du groupe du spinelle enduits sur des susbstrats carbonés peuvent également être des catalyseurs efficaces pour oxyder l'eau[23],[24].
Notes et références
- (en) Yasufumi Umena, Keisuke Kawakami, Jian-Ren Shen et Nobuo Kamiya, « Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å », Nature, vol. 473, no 7345, , p. 55-60 (PMID 21499260, DOI 10.1038/nature09913, Bibcode 2011Natur.473...55U, S2CID 205224374, lire en ligne)
- (en) Feng Liu, Javier J. Concepcion, Jonah W. Jurss, Thomas Cardolaccia, Joseph L. Templeton et Thomas J. Meyer*, « Mechanisms of Water Oxidation from the Blue Dimer to Photosystem II », Inorganic Chemistry, vol. 47, no 6, , p. 1727-1752 (PMID 18330966, DOI 10.1021/ic701249s, lire en ligne)
- (en) Tohru Wada, Kiyoshi Tsuge et Koji Tanaka, « Electrochemical Oxidation of Water to Dioxygen Catalyzed by the Oxidized Form of the Bis(ruthenium – hydroxo) Complex in H2O », Angewandte Chemie International Edition, vol. 38, no 8, , p. 1479-1482 (DOI 10.1002/(SICI)1521-3773(20000417)39:8<1479::AID-ANIE1479>3.0.CO;2-4, lire en ligne)
- (en) Cristina Sens, Isabel Romero, Montserrat Rodríguez, Antoni Llobet, Teodor Parella et Jordi Benet-Buchholz, « A New Ru Complex Capable of Catalytically Oxidizing Water to Molecular Dioxygen », Journal of the American Chemical Society, vol. 126, no 25, , p. 7798-7799 (PMID 15212526, DOI 10.1021/ja0486824, lire en ligne)
- (en) Lele Duan, Andreas Fischer, Yunhua Xu et Licheng Sun, « Isolated Seven-Coordinate Ru(IV) Dimer Complex with [HOHOH]− Bridging Ligand as an Intermediate for Catalytic Water Oxidation », Journal of the American Chemical Society, vol. 131, no 30, , p. 10397-10399 (PMID 19601625, DOI 10.1021/ja9034686, lire en ligne)
- (en) Lele Duan, Fernando Bozoglian, Sukanta Mandal, Beverly Stewart, Timofei Privalov, Antoni Llobet et Licheng Sun, « A molecular ruthenium catalyst with water-oxidation activity comparable to that of photosystem II », Nature Chemistry, vol. 4, no 5, , p. 418-423 (PMID 22522263, DOI 10.1038/nchem.1301, Bibcode 2012NatCh...4..418D, lire en ligne)
- (en) Ruifa Zong et Randolph P. Thummel, « A New Family of Ru Complexes for Water Oxidation », Journal of the American Chemical Society, vol. 127, no 37, , p. 12802-12803 (PMID 16159265, DOI 10.1021/ja054791m, lire en ligne)
- (en) Gang Zhang, Ruifa Zong, Huan-Wei Tseng et Randolph P. Thummel, « Ru(II) Complexes of Tetradentate Ligands Related to 2,9-Di(pyrid-2‘-yl)-1,10-phenanthroline », Inorganic Chemistry, vol. 47, no 3, , p. 990-998 (PMID 18183971, DOI 10.1021/ic701798v, lire en ligne)
- (en) Bruce S. Brunschwig, Mei H. Chou, Carol Creutz, Pushpito Ghosh et Norman Sutin, « Mechanisms of water oxidation to oxygen: cobalt(IV) as an intermediate in the aquocobalt(II)-catalyzed reaction », Journal of the American Chemical Society, vol. 105, no 14, , p. 4832-4833 (DOI 10.1021/ja00352a050, lire en ligne)
- (en) Derek J. Wasylenko, Chelladurai Ganesamoorthy, Javier Borau-Garcia et Curtis P. Berlinguette, « Electrochemical evidence for catalyticwater oxidation mediated by a high-valent cobalt complex », Chemical Communications, vol. 47, no 14, , p. 4249-4251 (PMID 21359324, DOI 10.1039/c0cc05522k, lire en ligne)
- (en) Qiushi Yin, Jeffrey Miles Tan, Claire Besson, Yurii V. Geletii, Djamaladdin G. Musaev, Aleksey E. Kuznetsov, Zhen Luo, Ken I. Hardcastle et Craig L. Hill, « A Fast Soluble Carbon-Free Molecular Water Oxidation Catalyst Based on Abundant Metals », Science, vol. 328, no 5976, , p. 342-345 (PMID 20223949, DOI 10.1126/science.1185372, Bibcode 2010Sci...328..342Y, lire en ligne)
- (en) Sergii I. Shylin, Mariia V. Pavliuk, Luca D’Amario, Fikret Mamedov, Jacinto Sá, Gustav Berggren et Igor O. Fritsky, « Efficient visible light-driven water oxidation catalysed by an iron(iv) clathrochelate complex », Chemical Communications, vol. 55, no 23, , p. 3335-3338 (PMID 30801592, DOI 10.1039/c9cc00229d, lire en ligne)
- (en) Julio Lloret Fillol, Zoel Codolà, Isaac Garcia-Bosch, Laura Gómez, Juan José Pla et Miquel Costas, « Efficient water oxidation catalysts based on readily available iron coordination complexes », Nature Chemistry, vol. 3, no 10, , p. 807-813 (PMID 21941254, DOI 10.1038/nchem.1140, Bibcode 2011NatCh...3..807F, lire en ligne)
- (en) Jonathan F. Hull† David Balcells, James D. Blakemore, Christopher D. Incarvito, Odile Eisenstein, Gary W. Brudvig et Robert H. Crabtree, « Highly Active and Robust Cp* Iridium Complexes for Catalytic Water Oxidation », Journal of the American Chemical Society, vol. 131, no 25, , p. 8730-8731 (PMID 19496565, DOI 10.1021/ja901270f, Bibcode 2742501, lire en ligne)
- (en) James D. Blakemore, Nathan D. Schley, David Balcells, Jonathan F. Hull, Gerard W. Olack, Christopher D. Incarvito, Odile Eisenstein, Gary W. Brudvig et Robert H. Crabtree, « Half-Sandwich Iridium Complexes for Homogeneous Water-Oxidation Catalysis », Journal of the American Chemical Society, vol. 132, no 45, , p. 16017-16029 (PMID 20964386, DOI 10.1021/ja104775j, lire en ligne)
- (en) W. Justin Youngblood, Seung-Hyun Anna Lee, Kazuhiko Maeda et Thomas E. Mallouk, « Visible Light Water Splitting Using Dye-Sensitized Oxide Semiconductors », Accounts of Chemical Research, vol. 42, no 12, , p. 1966-1973 (PMID 19905000, DOI 10.1021/ar9002398, lire en ligne)
- (en) Mircea Dincă, Yogesh Surendranath et Daniel G. Nocera, « Nickel-borate oxygen-evolving catalyst that functions under benign conditions », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 23, , p. 10337-10341 (PMID 20457931, DOI 10.1073/pnas.1001859107, JSTOR 25681784, Bibcode 2010PNAS..10710337D, lire en ligne)
- (en) Marcel Risch, Katharina Klingan, Jonathan Heidkamp, David Ehrenberg, Petko Chernev, Ivelina Zaharieva et Holger Dau, « Nickel-oxido structure of a water-oxidizing catalyst film », Chemical Communications, vol. 47, no 43, , p. 11912-11914 (PMID 21975439, DOI 10.1039/c1cc15072c, lire en ligne)
- (en) Ivelina Zaharieva, M. Mahdi Najafpour, Mathias Wiechen, Michael Haumann, Philipp Kurz et Holger Dau, « Synthetic manganese–calcium oxides mimic the water-oxidizing complex of photosynthesis functionally and structurally », Energy & Environmental Science, vol. 4, no 7, , p. 2400-2408 (DOI 10.1039/c0ee00815j, lire en ligne)
- (en) Matthew W. Kanan, Junko Yano, Yogesh Surendranath, Mircea Dincă, Vittal K. Yachandra et Daniel G. Nocera, « Structure and Valency of a Cobalt−Phosphate Water Oxidation Catalyst Determined by in Situ X-ray Spectroscopy », Journal of the American Chemical Society, vol. 132, no 39, , p. 13692-13701 (PMID 20839862, DOI 10.1021/ja1023767, lire en ligne)
- (en) Anthony Harriman, Ingrid J. Pickering, John M. Thomas et Paul A. Christensen, « Metal oxides as heterogeneous catalysts for oxygen evolution under photochemical conditions », Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases, vol. 84, no 8, , p. 2795-2806 (DOI 10.1039/f19888402795, lire en ligne)
- (en) Matthew W. Kanan, Yogesh Surendranath et Daniel G. Nocera, « Cobalt–phosphate oxygen-evolving compound », Chemical Society Reviews, vol. 38, no 1, , p. 109-114 (PMID 19088970, DOI 10.1039/b802885k, lire en ligne)
- (en) Pathik Sahoo, Jing-Bo Tan, Zhi-Ming Zhang, Shiva Kumar Singh et Tong-Bu Lu, « Engineering the Surface Structure of Binary/Ternary Ferrite Nanoparticles as High-Performance Electrocatalysts for the Oxygen Evolution Reaction », ChemCatChem, vol. 10, no 5, , p. 1075-1083 (DOI 10.1002/cctc.201701790, lire en ligne)
- (en) Jing-Bo Tan, Pathik Sahoo, Jia-Wei Wang, Yu-Wen Hu, Zhi-Ming Zhang et Tong-Bu Lu, « Highly efficient oxygen evolution electrocatalysts prepared by using reduction-engraved ferrites on graphene oxide », Inorganic Chemistry Frontiers, vol. 5, no 2, , p. 310-318 (DOI 10.1039/c7qi00681k, lire en ligne)
- Portail de la chimie
- Portail de l’énergie