Paralepistopsis acromelalga
Clitocybe tortionnaire japonais
| Règne | Fungi |
|---|---|
| Sous-règne | Dikarya |
| Division | Basidiomycota |
| Sous-division | Agaricomycotina |
| Classe | Agaricomycetes |
| Sous-classe | Agaricomycetidae |
| Ordre | Agaricales |
| Famille | Tricholomataceae |
| Genre | Paralepistopsis |
- Clitocybe acromelalga Ichimura[2]
Paralepistopsis acromelalga, plus connu sous son basionyme : Clitocybe acromelalga est une espèce de champignons basidiomycètes de la famille des Tricholomataceae. Sa spore apparaissant lisse sous le microscope optique dans le bleu coton, il est rattaché à la section Gilvaoideae du genre Clitocybe, avant d'être proposé en 2012 pour le nouveau genre Paralepistopsis[3]. Longtemps considéré endémique du Japon, où il est décrit depuis le IXXe siècle, puis signalé en Corée, il pousse généralement au pied des bambous. Nommé en japonais ドクササコ, « Doku sasako » (= Poison des Sasa, les « Bambous nains ») ou ヤケドキン, « Yakédo-kin » (= Champignon aux brûlures).
Très toxique, ce champignon surnommé par Romagnesi « le champignon tortionnaire japonais[4] » provoque un syndrome spectaculaire et unique en Mycotoxicologie : le syndrome acromélalgien[5],[6] qui se manifeste par des œdèmes et sensations de brûlures très douloureuses aux extrémités des articulations des quatre membres, doigts et orteils. En 1996, une espèce voisine, le Clitocybe à bonne odeur (Clitocybe amoenolens) décrit du Maroc par G. Malençon, a été récoltée en France occasionnant des symptômes similaires et voisine d'un point de vue taxinomique et toxicologique, puis en Italie et en Turquie. Toutes deux sont anatomiquement proches du Lépiste comestible, le Clitocybe inversé.
Description
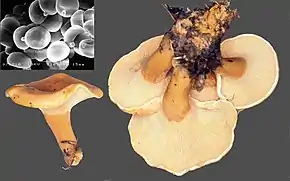
Chapeau[4],[7],[8] de 4 à 7 cm de diamètre, plan-convexe, puis plan-concave, brusquement déprimé au centre en ombilic de 1–3 cm de diamètre et 6–9 mm de profondeur, irrégulier-lobé chez les spécimens cespiteux, régulier et circulaire par ailleurs ; revêtement piléique hygrophane, lisse et brillant sous la pluie, puis mat à subvelouté en séchant, d'un agréable jaune orangé à ocre foncé par imbibition, roux orangé au disque, parsemé de guttules brun-roux vers le centre et vers l'ombilic, bientôt rompu en crevasses concentriques en séchant ; marge lisse, longtemps enroulée, finalement déroulée et récurvée dans la vieillesse, restant pâle, couverte d'une pruine blanchâtre épaisse recouvrant parfois tout le chapeau des jeunes spécimens ; marginelle blanche, crénelée-festonnée.
Lames[4],[7],[8] serrées, jusqu'à 15 lames par cm à la marge et autant de lamellules, larges de 2-3 mm, non séparables, décurrentes-pentues, rarement fourchues, crème orangé pâle. Sporée fraîche : blanchâtre (lb, code Romagnesi 1967[9]).
Pied[4],[7],[8] 3-6,5 x 0,7-1,3 cm, atténué à la base mais subclavé chez les spécimens cespiteux, couvert de fibrilles longitudinales concolores au chapeau, pruineux au sommet comme à la marge piléique, plein puis fistuleux ; mycélium affleurant la surface du sol, agglomérant la litière.
Chair[4],[10],[8] mince, environ 3 mm d'épaisseur, tendre et blanchâtre dans le chapeau, crème jaunâtre pâle sous le revêtement piléique, avec un hypophylle café-au-lait, plus ferme et lavée de roussâtre dans le cortex du pied ; odeur nette et fruitée, plus ou moins agréable. Saveur fongique-amariuscule (rappelant le shiitaké ?), vite contaminée par l'odeur.
Spores[7],[8] 3,2-4,20-5,1 x 2,6-3,17-3,7 µm, Q = 1,32, V = 45 µm3, ovo-elliptiques à subglobuleuses, lisses en microscopie optique, à apicule tronqué, proéminent jusqu'à 0,5 µm de longueur ; paroi organisée en 2 couches, la couche interne épaisse d'environ 0,2 µm et non cyanophile, la couche externe très mince et légèrement cyanophile ; contenu généralement uniguttulé, hyalin, cytoplasme légèrement cyanophile ; spores en majorité [4]uninucléées, mais quelques spores à 2 noyaux çà et là (probablement issues de basides bisporiques).
Basides[10],[8] 18-30 x 4-5,5 µm, cylindro-clavées à légèrement ventrues, à base souvent amincie, la plupart à 4 stérigmates dressés longs de 3-4 µm, quelques basides bisporiques éparses ; contenu à nombreuses gouttelettes lipidiques pluriétranglés jaunâtres. Basidioles cylindroclavées banales. Des articles cystidioïdes épars, fusiformes ou pluriétranglés sont visibles sur l'arête et les faces.
Sous-hyménium[7],[8] filamenteux banal pour le genre, épais d'environ 15 µm, à hyphes grêles x 3,5-4,5 µm. Trame régulière sur la moitié de la lame (vers l'arête), d'épaisseur moyenne 60-100 µm, à hyphes x 5-9 µm peu ramifiées et à peu près parallèles. Hypophylle de même structure que le médiostrate, épais d'env. 30 µm. Revêtement piléique très mince, à hyphes x 2-5 (7) gin, grêles, cylindracées à irrégulièrement digitées-ramifiées à extrémités obtuses ; puis légèrement gélifié et localement redressé en ixotrichoderme désorganisé. Hypoderme très mince et peu différencié, épais de 15-30 µm, hyphes x 3,5-5 µm, à peu près parallèles.
Pigmentation[11],[8] : pigment pariétal jaune terne partout, parfois très légèrement incrustant ; pigment intracellulaire jaune d'or abondant dans l'hypoderme et le suprapellis, mais soluble dans KOH 5 %.
Revêtement du pied à poils abondants dans la partie supérieure, 10-20 x 2,5-3,5 µm, à paroi mince, cylindracés, pluriétranglés ou onduleux, les plus courts souvent irrégulièrement renflés ou couchés[7] ;
Distribution
Au Japon, son aire de répartition a pour centre les départements de Fukui, Ishikawa et Niigata, autour desquels elle s’étend largement puisqu’on le trouve jusque dans les départements de Shiga, Kyôto, Yamagata et Miyagi[12],[6],[13],[14].
Le champignon aux brûlures pousse du mois de septembre au mois de novembre, au-dessus de 200 m, surtout sur des sols pentus orientés à l’ouest, dans l’humus, sous des bambous, l'Orme du Caucase et les Camélias[12],[6],[13],[14].
Position taxinomique et comparaison
Clitocybe acromelalga ressemble par son aspect et sa couleur à des espèces comestibles proches de Lepista inversa et de Clitocybes comme Lepista flaccida, Armillaria mellea et Lactarius sanguifluus. Clitocybe acromelalga se caractérise par ses lames décurrentes, sa chair facile à fendre longitudinalement, la présence de feuilles mortes agglomérées à la base du pied au moment de la récolte, et par la proximité de bambous[8],[12],[6],[15],[16],[14].Clitocybe acromelalga s'insère parfaitement dans la section Gilvaoideae, au voisinage de C. gilvaoides et C. gracilis. Les spores, bien qu'un peu plus petites, sont du même type que celles de C. amoenolens, et l'aspect macroscopique, l'odeur et la structure du revêtement piléique sont très voisines de ce dernier. Cependant, outre les différences morphologiques déjà repérées par Miyauchi (1998), deux différences majeures séparent C. acromelalga de C. amoenolens :
- le sous-hyménium est emmêlé et ramifié chez C. amoenolens, filamenteux peu ramifié chez C. acromelalga ;
- les hyphes à contenu jaunâtre, abondantes chez C. amoenolens, sont absentes de la chair de C. acromelalga.
Les auteurs japonais ne signalent pas l'odeur de C. acromelalga, que D. Guez. qualifie de « fruitée, aromatique ». Ichimura (1918) indique « Smell not marked », ce que plusieurs auteurs ont pu interpréter comme une absence d'odeur[8].
Syndrome acromélalgien
Cette espèce provoque, trois jours environ après ingestion, une érythermalgie (rougissement et élévation de température) des extrémités (doigts, orteils, pénis) avec paresthésie (sensation de fourmillement) et œdèmes, puis des douleurs aiguës sous forme de sensations de brûlures intolérables, réalisant une véritable torture au fer rouge, résistant aux antalgiques, mais temporairement soulagées par l'eau glacée. La marche, le sommeil et peu à peu tous les actes de la vie normale étant empêchés ou perturbés, l'hospitalisation est nécessaire. Les troubles, généralement non mortels, régressent lentement au bout de plusieurs mois : trois à six mois pour la douleur et jusqu'à un an pour les paresthésies[17].
Principes toxiques
Une douzaine de toxines ont été isolées par les chimistes japonais, dont des acides aminés proches de l'acide kaïnique, agoniste du glutamate, l'acide acromélique A et B, la clitidine et la clithionéine. La teneur par kilogramme est pour l'acide acromélique A de 6,8 µg/kg, pour l'acide acromélique B de 2,5 µg/kg et pour la clitidine de 190 µg/kg[18],[19],[20].
Les principes toxiques du champignon tortionnaire japonais sont restés longtemps inconnus. Les cas se multipliant, on remarqua que les personnes ayant consommé ces champignons impunément ou n'ayant eu que des troubles bénins, étaient celles qui les avaient laissé tremper pendant plus de six heures avant de les manger en soupe, ou encore celles qui, en ayant fait une soupe, n’avaient consommé que les champignons, sans la boire[18],[19],[20].
Ceci donnait à penser que la toxine était, d’une part hydrosoluble, et d’autre part, capable de résister à l’ébullition. En analysant l’eau dans laquelle avaient macéré ces champignons, on a d’abord extrait du D-mannitol, puis K. Konno, S. Tono-oka et al. parviennent à isoler certains des composants du Clitocybe acromelalga, et dont ils réussissent en partie la synthèse[18].
Parallèlement, Nakajima et son équipe isolent également la clitidine, qui sera la première substance identifiée. Elle est altérée quand on la chauffe en milieu alcalin, et stable en milieu acide. Le dérivé amide de la clitidine a été obtenu par synthèse, son existence en tant que composant naturel dans le champignon reste encore à démontrer. On pense qu’il est le précurseur de la clitidine, qui se décompose dans l’eau, et quand elle est chauffée à 100 °C pendant cinq minutes, 100 % des dérivés amides sont transformés en clitidine[21],[19],[20]. À 70 °C, seulement 70 % de ces dérivés sont transformés, et aucune transformation n’a lieu si l’eau est laissée 24 h à température ambiante. Si la forme dérivée existe bien dans le champignon, on suppose que c’est le procédé d’extraction qui le transforme en clitidine.
Les acides acroméliques A et B sont des acides aminés dont on n'a pu extraire que des quantités infimes. Ils sont hydrosolubes et fixés par le charbon actif. Ils ont été récemment synthétisés et leur fort pouvoir dépolarisant a pu être mis en évidence. La clithionéine est un acide aminé (bétaïne) comportant un radical (CH3)3N, également hydrosoluble et fixé par le charbon actif[19],[20].
On ne sait pas encore clairement lesquelles de ces substances sont responsables des troubles. Les inoculations faites dans la cavité abdominale des souris montrent que l'acide acromélique est le plus toxique, suivi de la clitidine et la clithionéine. D'après ces tests, on estime la dose létale pour la clitidine à 50-100 mg/kg et à 16 mg/kg pour son dérivé amide synthétique. La toxicité varie selon les espèces animales : une solution à 10 % de Clitocybe acromelalga en injection sous-cutanée provoque la mort pour une dose de 40 ml/kg chez la grenouille rousse et le cobaye, 30 ml/kg chez la souris et 200 ml/kg chez le rat, alors que le lapin résiste même à des doses supérieures à 200 ml/kg[19],[20].
- Cet article est partiellement ou en totalité issu de l'article intitulé « Syndrome acromélalgien » (voir la liste des auteurs).
Notes et références
- (en) Alfredo Vizzini et Enrico Ercole, « Paralepistopsis gen. nov. and Paralepista (Basidiomycota, Agaricales) », Mycotaxon, vol. 120, no 1, , p. 253–267 (DOI 10.5248/120.253, lire en ligne, consulté le )
- Ichimura T., 1918 — « A new poisonous mushroom ». Botanical Gazette (Tokyo), vol. 65, p. 109-111.
- Vizzini A. et al., Mycotaxon 120: 261. (2012).
- Henri Romagnesi, « Curiosité mycologique : un champignon tortionnaire japonais : Clitocybe acromelalga Ichimura », Bulletin trimestriel de la Société Mycologique de France, vol. 105, no 3, , p. 131-132
- encore nommé Acrosyndrome ou Erythermalgie des extrémités.
- Shirahama K., Hoshi M. & Kuribayashi K. Rapport de 3 cas d'intoxication par le champignon Clitocybe acromelalga Ichimura, notamment les symptômes neurologiques et le traitement. 1980, Académie Médicale de Niigata, 94:745-753.
- Récoltes examinées : Nagaoka (département de Niigata, Japon), dans une plantation de bambous (Phyllostachys bambusoides Sieb & Zucc.), mêlée d'Acer palmatum Thunb. ex Murray, Cryptomeria japonica (L.f.) D. Don et Zelkova serrata (Thunb. ex Murray) Makino, pH de l'humus : 6,5, alt. 100 m, 2 novembre 1999, herb. D. Guez no 99-11-02-1, 2 spécimens in herbier. P.-A. Moreau (18 spécimens de tous âges, dont 5 fasciculés, choisis parmi une cinquantaine de basidiomes poussant en rond de sorcière sur la litière). Même station, automne 1998, herb. S. Miyauchi no 98.187, 1 spécimen conservé à la faculté de pharmacie de Grenoble.
- (en) P Moreau, « Analyse taxinomique d'une espèce toxique: Clitocybe amoenolens Malençon », Cryptogamie Mycologie, vol. 22, no 2, , p. 95–117 (DOI 10.1016/S0181-1584(01)80003-8, lire en ligne, consulté le )
- Gérard Lévêque, « Logiciel OCRE : analyse colorimétrique des sporées des russules » [PDF]
- Récoltes examinées (P-A. M.) : Nagaoka (département de Niigata, Japon), dans une petite plantation de bambous (Phyllostachys bambusoides Sieb & Zucc.), mêlée d'Acer palmatum Thunb. ex Murray, Cryptomeria japonica (L.f.) D. Don et Zelkova serrata (Thunb. ex Murray) Makino, pH de l'humus : 6,5, alt. 100 m, 2 novembre 1999, herb. D. Guez 99-11-02-1, 2 spécimens in herb. P.-A. Moreau (18 spécimens de tous âges, dont 5 fasciculés, choisis parmi une cinquantaine de basidiomes poussant en rond de sorcière sur la litière). Même station, automne 1998, herb. S. Miyauchi no 98.187, 1 spécimen conservé à la faculté de pharmacie de Grenoble.
- Récoltes examinées (P-A. M.) : Nagaoka (département de Niigata, Japon), dans une petite plantation de bambous (Phyllostachys bambusoides Sieb & Zucc.), mêlée d'Acer palmatum Thunb. ex Murray, Cryptomeria japonica (L.f.) D. Don et Zelkova serrata (Thunb. ex Murray) Makino, pH de l'humus : 6,5, alt. 100 m, 2 novembre 1999, herb. D. Guez no 99-11-02-1, 2 spécimens in herb. P.-A. Moreau (18 spécimens de tous âges, dont 5 fasciculés, choisis parmi une cinquantaine de basidiomes poussant en rond de sorcière sur la litière). Même station, automne 1998, herb. S. Miyauchi no 98.187, 1 spécimen conservé à la faculté de pharmacie de Grenoble.
- Miura O. Inflammation des extrémités par ingestion de Dokou-Sassako et étude de ce champignon, Glenzebit 1937, 11:1011-1024.
- Imazeki R. & Hongo T. Atlas en couleurs des Champignons du Japon (vol.1). Osaka, 1987, vol.2, 1989, Hoikusha Publ.
- Shimizu T., Tono T. & Izawa. M. Champignons, Tokyo 1985, Ed. Ass. IEO-Hikari
- Hayakawa K. A propos du Yabou-shiméji. Transactions of Japan Mycological Society, 1974,15:101
- Karimai T. & Kobayashi Y. Plantes et Champignons toxiques, Tokyo, 1979, Ed. Hirokawa 84-85.
- Nakamura K., Soyama F., Toyama J. & Tateishi K., 1987 — Dokusasako poisoning. Japanese Journal of Toxicology 0 : 35-39.
- Konno K, Hashimoto K, Ohfune Y, Shirahama H, Matsumoto T. Acromelic acids A and B neuroexcitatory amino acids isolated from Clitocybe acromelalga. Journal of the American Chemical Society, 1988, 110, 4807-4815.
- (en) Philippe F. Saviuc, Vincent C. Danel, Pierre-Arthur M. Moreau et Daniel R. Guez, « Erythromelalgia and Mushroom Poisoning », Journal of Toxicology: Clinical Toxicology, vol. 39, no 4, , p. 403–407 (ISSN 0731-3810, DOI 10.1081/CLT-100105162, lire en ligne, consulté le )
- « Mass spectrometric determination of acromelic acid - Ki-no-ko fungi », sur enfantdesarbres.canalblog.com, (consulté le )
- (en) Nobuhito Nakajima et Masayuki Ueda, « Nicotinic acid treatment for Paralepistopsis acromelalga intoxication: assessment using magnetic resonance imaging », Clinical Toxicology, vol. 54, no 7, , p. 597–600 (ISSN 1556-3650 et 1556-9519, DOI 10.1080/15563650.2016.1188205, lire en ligne, consulté le )
Bibliographie
- Daniel Guez, « Aperçu sur la flore mycologique du Japon (première publication en français sur le Clitocybe acromelalga en Europe; avec photographie en couleur par Toshiho Ueda, qui permettra à l'un des intoxiqués de Savoie de reconnaître le champignon responsable) », Bulletin de la Fédération mycologique Dauphiné-Savoie, no 116, , p. 12-16.
(en) S. Miyauchi S., « Comparison Clitocybe acromelalga with Clitocybe sp. collected in France », Report of the Nagaoka Unviersity of Technology, sect. Bio-Ingeneering Kamitomioka, Nagaoka, Japan, vol. 1603-1, , p. 1-9.
- Philippe Saviuc et Pierre-Arthur Moreau, « Intoxications par les champignons : syndromes à latence longue », EMC - Pathologie professionnelle et de l'environnement, vol. 7, no 3, , p. 1-13 (lire en ligne).
- Philippe Saviuc, « Intoxication par champignons et érythermalgie », Bulletin d'Information Toxicologique (Québec), vol. 15, no 3, , p. 4-7 (lire en ligne).
Liens externes
- (en) Référence MycoBank : Clitocybe acromelalga Ichimura (consulté le )
- (en) Référence Catalogue of Life : Paralepistopsis acromelalga (Ichimura) Vizzini, 2012 (consulté le )
- (fr+en) Référence GBIF : Paralepistopsis acromelalga (Ichimura) Vizzini, 2012 (consulté le )
- (en) Référence Index Fungorum : Paralepistopsis acromelalga (Ichimura) Vizzini, 2012 (+ MycoBank) (consulté le )
- Portail de la mycologie