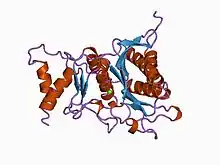
Fructose-1,6-bisphosphatase
La fructose-1,6-bisphosphatase (FBPase) est une hydrolase qui catalyse la réaction de conversion du fructose-1,6-bisphosphate en fructose-6-phosphate dans la néoglucogenèse et le cycle de Calvin, deux voies métaboliques anaboliques, ainsi que dans la voie des pentoses phosphates :
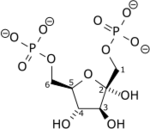 |
+ H2O → Pi + |  |
| β-D-fructose-1,6-bisphosphate | β-D-fructose-6-phosphate |
| Fructose-1,6-bisphosphatase 1 | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | FBP1 | |
| N° EC | 3.1.3.11 | |
| Homo sapiens | ||
| Locus | 9q22.32 | |
| Masse moléculaire | 36 842 Da[1] | |
| Nombre de résidus | 338 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Fructose-1,6-bisphosphatase 2 | ||
| Caractéristiques générales | ||
| Symbole | FBP2 | |
| N° EC | 3.1.3.11 | |
| Homo sapiens | ||
| Locus | 9q22.32 | |
| Masse moléculaire | 36 743 Da[1] | |
| Nombre de résidus | 339 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Il s'agit de la réaction inverse de celle catalysée par la phosphofructokinase au cours de la glycolyse[2],[3].
Chacune de ces enzymes ne catalysent la réaction que dans un sens et sont régulées par des métabolites tels que le fructose-2,6-bisphosphate de sorte qu'une seule de ces enzymes soit active à la fois : le fructose-2,6-bisphosphate inhibe la fructose-1,6-bisphosphatase mais active la phosphofructokinase-1.
Chez l'homme, cette enzyme existe sous deux isoformes codées par les gènes FBPase1 et FBPase1 et présentes dans le foie et les muscles. FBPase1 se trouve principalement dans le foie et les reins, ainsi que dans l'iléon, les leucocytes et le cerveau. Bien que relativement instable dans l'urine, cette enzyme peut être utilisée comme marqueur de lésion tubulaire proximale[4].
La fructose-1,6-bisphosphatase intervient dans plusieurs voies métaboliques et est présente chez la plupart des êtres vivants. Elle requiert des cations métalliques divalents, de préférence Mg2+ et Mn2+) et est puissamment inhibée par le cation de lithium Li+.
Le repliement de la fructose-1,6-bisphosphatase de porc est identique à celui de l'inositol monophosphatase (en) (IMPase)[5]. La séquence de l'inositol-polyphosphate 1-phosphatase (IPPase), l'IMPase et la FBPase partagent un motif d'acides aminés commun :
Cette séquence se lie au cation métallique et participe à la catalyse. Elle se retrouve également dans les IMPases de levures, de bactéries et de mycètes qui sont des protéines homologues éloignées. Ces protéines pourraient appartenir à une famille ancienne d'enzymes dont la structure a été conservée et qui seraient impliquées dans plusieurs voies métaboliques telles que la signalisation cellulaire impliquant de l'inositol, la néoglucogenèse, l'assimilation des sulfates et peut-être également le métabolisme des quinones[6].
On a identifié trois groupes différents de fructose-1,6-bisphosphatases chez les eucaryotes et les bactéries, appelés FBPase I, II et III[7]. Aucun de ces groupes n'a été identifié chez les archées, mais un quatrième groupe de FBPases, qui présente également une activité IMPase, est présent chez ces dernières[8].
Un groupe appelé FBPase V a été identifié chez des archées thermophiles et la bactérie hyperthermophile Aquifex aeolicus[9]. Les membres de ce groupe qui ont pu être caractérisés montrent une spécificité stricte vis-à-vis du substrat pour le fructose-1,6-bisphosphate et pourraient être les véritables FBPases chez ces organismes[10]. Une étude structurelle a montré que le groupe FBPase V possède un repliement inhabituel pour une phosphatase d'ose, avec un arrangement de quatre couches en configuration sandwich alpha–bêta–bêta–alpha, par opposition à la configuration plus courante en sandwich alpha–bêta–alpha–bêta–alpha[10]. L'arrangement des résidus du site actif est cohérent avec le mécanisme catalytique à trois ions métalliques proposés pour les autres FBPases.
Les fructose-1,6-bisphosphatases trouvées chez les Firmicutes, des bactéries à Gram positif et faible taux de GC, ne montrent pas de similitudes séquentielles significatives avec les enzymes d'autres organismes. L'enzyme de Bacillus subtilis est inhibée par l'AMP, bien que cela puisse être neutralisé par le phosphoénolpyruvate, et dépend de Mn2+[11],[12]. Les mutants dépourvus de cette enzyme semblent néanmoins capables de se développer sur des substrats tels que le malate et le glycerol.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
| Pfam | PF06874 |
|---|---|
| Clan Pfam | CL0163 |
| InterPro | IPR009164 |
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Frank Marcus et Peter B. Harrsch, « Amino acid sequence of spinach chloroplast fructose-1,6-bisphosphatase », Archives of Biochemistry and Biophysics, vol. 279, no 1, , p. 151-157 (PMID 2159755, DOI 10.1016/0003-9861(90)90475-E, lire en ligne)
- (en) Frank Marcus, Brigitte Gontero, Peter B. Harrsch et Judith Rittenhouse, « Amino acid sequence homology among fructose-1,6-bisphosphatases », Biochemical and Biophysical Research Communications, vol. 135, no 2, , p. 374-381 (PMID 3008716, DOI 10.1016/0006-291X(86)90005-7, lire en ligne)
- (en) Alina Kępka, Sławomir Dariusz Szajda, Anna Stypułkowska, Napoleon Waszkiewicz, Anna Jankowska, Sylwia Chojnowska et Krzysztof Zwierz, « Urinary fructose-1,6-bisphosphatase activity as a marker of the damage to the renal proximal tubules in children with idiopathic nephrotic syndrome », Clinical Chemistry and Laboratory Medicine (CCLM), vol. 46, no 6, , p. 831-835 (PMID 18601606, DOI 10.1515/CCLM.2008.171, lire en ligne)
- (en) Y.P. Zhang, J.Y. Liang et W.N. Lipscomb, « Structural Similarities between Fructose-1,6-bisphosphatase and Inositol Monophosphatase », Biochemical and Biophysical Research Communications, vol. 190, no 3, , p. 1080-1083 (PMID 8382485, DOI 10.1006/bbrc.1993.1159, lire en ligne)
- (en) J. D. York, J. W. Ponder et P. W. Majerus, « Definition of a metal-dependent/Li(+)-inhibited phosphomonoesterase protein family based upon a conserved three-dimensional core structure », Proceedings of the National Academy of Sciences of the United States of America, vol. 92, no 11, , p. 5149-5153 (PMID 7761465, DOI 10.1073/pnas.92.11.5149, lire en ligne)
- (en) Janet L. Donahue, Jennifer L. Bownas, Walter G. Niehaus et Timothy J. Larson, « Purification and Characterization of glpX-Encoded Fructose 1,6-Bisphosphatase, a New Enzyme of the Glycerol 3-Phosphate Regulon of Escherichia coli », Journal of Bacteriology, vol. 182, no 19, , p. 5624-5627 (PMID 10986273, DOI 10.1128/JB.182.19.5624-5627.2000, lire en ligne)
- (en) Boguslaw Stec, Hongying Yang, Kenneth A. Johnson, Liangjing Chen et Mary F. Roberts, « MJ0109 is an enzyme that is both an inositol monophosphatase and the 'missing' archaeal fructose-1,6-bisphosphatase », Nature Structural & Molecular Biology, vol. 7, , p. 1046-1050 (PMID 11062561, DOI 10.1038/80968, lire en ligne)
- (en) Naeem Rashid, Hiroyuki Imanaka, Tamotsu Kanai, Toshiaki Fukui, Haruyuki Atomi et Tadayuki Imanaka, « A Novel Candidate for the True Fructose-1,6-bisphosphatase in Archaea », Journal of Biological Chemistry, vol. 277, no 34, , p. 30649-30655 (PMID 12065581, DOI 10.1074/jbc.M202868200, lire en ligne)
- (en) Hiroshi Nishimasu, Shinya Fushinobu, Hirofumi Shoun et Takayoshi Wakagi, « The First Crystal Structure of the Novel Class of Fructose-1,6-Bisphosphatase Present in Thermophilic Archaea », Structure, vol. 12, no 6, , p. 949-959 (PMID 15274916, DOI 10.1016/j.str.2004.03.026, lire en ligne)
- (en) Y. Fujita et E. Freese, « Purification and properties of fructose-1,6-bisphosphatase of Bacillus subtilis », Journal of Biological Chemistry, vol. 254, no 12, , p. 5340-5349 (PMID 221467, lire en ligne)
- (en) Yasutaro Fujita, Ken-Ichi Yoshida, Yasuhiko Miwa, Nobuo Yanai, Eishi Nagakawa et Yasuhiro Kasahara, « Identification and Expression of the Bacillus subtilis Fructose-1,6-Bisphosphatase Gene (fbp) », Journal of Bacteriology, vol. 180, no 16, , p. 4309-4313 (PMID 9696785, lire en ligne)
- Portail de la biochimie