Halogénure de métal
Les halogénures de métal (ou halogénures métalliques) sont des composés chimiques constitués de métaux et d'halogènes. Certains sont ioniques, comme le chlorure de calcium, alors que d'autres présentent des liaisons covalentes comme l'hexafluorure de platine. Les halogénures de métal peuvent être des molécules discrètes, comme l'hexafluorure d'uranium, ou peuvent former des structures polymériques, comme le chlorure de palladium (en)[1].
Tous les halogènes peuvent réagir avec des métaux, selon l'équation suivante :
- 2 M + n X2 → 2 MXn
où M est le métal, X l'halogène et MXn l'halogénure de métal.
 Structure cristalline du chlorure de sodium
Structure cristalline du chlorure de sodium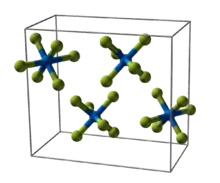 Molécules discrètes de UF6
Molécules discrètes de UF6-chloride-xtal-3D-balls.png.webp) Chaînes infinies d'une forme de dichlorure de palladium
Chaînes infinies d'une forme de dichlorure de palladium
Préparation

En principe, la plupart des halogénures de métal peuvent être préparés par combinaison directe des éléments qui le composent. Par exemple, pour le chlorure d'étain(IV) :
- Sn + 2 Cl2 → SnCl4
En pratique, ce type de réaction peut être très exothermique, et donc impossible à mettre en place comme méthode de préparation. De plus, la plupart des métaux de transition peuvent adopter plusieurs états d'oxydation, ce qui complique le problème. Comme les halogènes sont des oxydants puissants, la combinaison directe des éléments forme habituellement un halogénure de métal à haut nombre d'oxydation. Par exemple, le chlorure de fer(III) (ou chlorure ferrique) peut être préparé de cette manière, mais pas le chlorure de fer (II) (ou chlorure ferreux). Le chauffage des halogénures plus élevés peut produire les halogénures à degré d'oxydation plus bas, par un mécanisme de décomposition thermique ou par dismutation, par exemple à partir du chlorure d'or(III) pour former le chlorure d'or (I)[1]:
- AuCl3 → AuCl + Cl2 à 160 °C
Les halogénures de métal sont aussi préparés par neutralisation d'un oxyde, hydroxyde ou carbonate métallique avec l'acide halogénohydrique approprié. Par exemple, pour le chlorure de sodium[1] :
- NaOH + HCl → NaCl + H2O
L'eau ainsi formée peut être éliminée par chauffage, par le vide ou par la présence d'acide halogénohydrique anhydrique. Les chlorures de métaux anhydriques adaptés à la préparation d'autres composés de coordination peuvent être déshydratés par traitement avec le chlorure de thionyle [1],[2] :
- MCln·xH2O + x SOCl2 → MCln + x SO2 + 2x HCl
Les cations argent (I) et (II), et thallium (I) ont une haute affinité pour les anions halogénures en solution, et l'halogénure de métal précipite quantitativement en solution aqueuse. Cette réaction est si efficace que le nitrate d'argent est utilisé pour tester la présence et la quantité d'anions halogénure. La réaction avec le bromure est la suivante :
- Ag+(aq) + Br−(aq) → AgBr(s)
Certains halogénures de métal peuvent être préparés par réaction d'oxydes avec des halogènes en présence de carbone :
- TiO2 + 2 Cl2 + C → TiCl4(l) + CO2(g)
Structure et réactivité
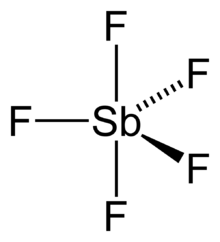
Les halogénures de métal « ioniques » (principalement des alcalins et alcalino-terreux) ont tendance à avoir de hautes températures de fusion et d'ébullition. Ils se dissolvent facilement dans l'eau, et certains sont déliquescents. Généralement, ils se dissolvent peu dans les solvants organiques.
Certains métaux de transition dans un état d'oxydation faible ont des halogénures qui se dissolvent bien dans l'eau, comme le chlorure ferreux, le chlorure de nickel (II) et le chlorure de cuivre (II). Les cations métalliques ayant un degré d'oxydation élevé subissent plutôt une hydrolyse, comme le chlorure ferrique, le chlorure d'aluminium ou le tétrachlorure de titane[1].
Les halogénures de métal discrets ont des températures de fusion et d'ébullition plus faibles. Par exemple, le tétrachlorure de titane fond à −25 °C et bout à 135 °C. Il est donc liquide à température ambiante. Ils sont généralement insolubles dans l'eau, mais solubles dans les solvants organiques[1].
Les halogénures de métal polymériques ont généralement des températures de fusion et d'ébullition plus élevées que leurs monomères, mais plus faibles que les halogénures ioniques. Ils sont seulement solubles en présence de ligands, qui libèrent les unités discrètes. Par exemple, le chlorure de palladium(II) est presque insoluble dans l'eau, mais se dissout bien dans une solution concentrée de chlorure de sodium[3]:
- PdCl2 (s) + 2 Cl−(aq) → PdCl42−(aq)
Le chlorure de palladium est insoluble dans la plupart des solvants organiques, mais il forme des monomères solubles dans l'acétonitrile et le benzonitrile[4] :
- [PdCl2]n + 2n CH3CN → n PdCl2(CH3CN)2
De la même manière, les tétrahalogénures tétraédriques de la première ligne des métaux de transition sont préparés par addition d'un chlorure d'ammonium quaternaire à l'halogénure de métal[5],[6] :
- MCl2 + 2 Et4NCl → (Et4N)2MCl4 avec M = Mn, Fe, Co, Ni, Cu
Le pentafluorure d'antimoine est un acide de Lewis fort. En réagissant avec le fluorure d'hydrogène, il forme l'acide fluoroantimonique, l'un des plus forts connus. Le pentafluorure d'antimoine est l'acide de Lewis prototypique ; il est utilisé pour comparer la basicité d'autres composés de Lewis. Cette mesure de la basicité est connue comme le nombre donneur de Gutmann (en)[7].
Ligands halogénures
| Complexe | Couleur | Config. électronique | Géométrie |
|---|---|---|---|
| [TiCl4] | incolore | (t2g)0 | tétraédrique |
| [Ti2Cl10]2− | incolore | (t2g)3 | bioctaédrique |
| [TiCl6]2− | jaune | (t2g)0 | octaédrique |
| [CrCl6]3− | ? | (t2g)3 | octaédrique |
| [MnCl4]2− | rose pâle | (eg)2(t2g)3 | tétraédrique |
| [FeCl4]2− | incolore | (eg)3(t2g)3 | tétraédrique |
| [CoCl4]2− | bleu | (eg)4(t2g)3 | tétraédrique |
| [NiCl4]2− | bleu | (eg)4(t2g)4 | tétraédrique |
| [CuCl4]2− | vert | (eg)4(t2g)5 | tétraédrique |
| [PdCl4]2− | marron | d8 | plan carré |
| [PtCl4]2− | rose | d8 | plan carré |

Les halogénures sont des ligands en chimie des complexes. Les halogénures sont habituellement de bons donneurs d'électrons σ et π. Ces ligands sont généralement terminaux, mais ils peuvent parfois agir comme des ponts. Par exemple, les ligands chlorure du chlorure d'aluminium relient deux atomes d'aluminium. Ainsi, le composé a pour formule empirique AlCl3 mais a une formule moléculaire Al2Cl6 dans les conditions normales. A cause de leur basicité π, les ligands halogénures sont des ligands à champ faible. Les complexes halogénures de la première ligne des métaux de transition sont tous à haut spin si possible, car l'énergie de séparation du champ cristallin est plus faible. Ces complexes sont à bas spin pour la deuxième et troisième ligne des métaux de transition.
Les complexes halogénures de métal homoleptiques ont plusieurs stoechiométries connues, mais les principales sont les hexahalométallates et les tétrahalométallates. Les hexahalogénures adoptent une géométrie de coordination octaédrique alors que les tétrahalogénures sont généralement tétraédriques. Des tétrahalogénures plan carré sont connus pour des coordination de 2 et 3[pas clair].
Alfred Werner étudia le chlorure d'hexaamminecobalt (III) (en) et fut le premier à proposer les structures correctes des complexes de coordination. Le cisplatine, de formule cis-Pt(NH3)2Cl2, est un médicament à base de platine portant deux ligands chlore. Ces deux ligands sont facilement remplacés, permettant à l'atome de platine de se lier à deux unités guanine, endommageant ainsi l'ADN.
Par la présence d'orbitales pπ pleines, les ligands halogénure sur les métaux de transition peuvent renforcer la "π-backbonding" sur les π-acides. Ils sont aussi connus pour rendre les cis-ligands labiles[8].
Applications
La volatilité des complexes de tétrachlorure et de tétraiodure de titane (en) sont exploités dans la purification du titane dans le procédé Kroll et le procédé Van-Arkel-de-Boer, respectivement.
Les halogénures de métal sont des acides de Lewis. Le chlorure de fer(III) et le chlorure d'aluminium sont des catalyseurs de la réaction de Friedel-Crafts, mais sont souvent ajoutés en quantité stœchiométrique grâce à leur faible coût.
L'acide chloroplatinique (H2PtCl6) est un catalyseur important de l'hydrosilylation.
Précurseur de composés inorganiques
Les halogénures de métal sont des précurseurs facilement disponibles pour d'autres composés inorganiques. Comme indiqué ci-dessus, ils peuvent être déshydratés par la chaleur, le vide ou par traitement avec un chlorure d'acide.
Pour beaucoup de composés des métaux de transition, un site de coordination vide est stabilisé par une moélcule de solvant qui sert de ligand comme l'eau, le tétrahydrofurane, etc. Les ligands halogénure peuvent être aussi facilement déplacés par des ligand de type amine comme un salen[9]. Cette réaction est techniquement une transmétallation et le retrait de l'halogénure est privilégié par la précipitation de l'halogénure alcalin produit dans un solvant organique. Les halogénures alcalins ont habituellement une énergie réticulaire élevée.
Par exemple, le cyclopentadiénure de sodium réagit avec le chlorure de fer(II) pour donner du ferrocène[10] :
Bien que les composés inorganiques utilisés pour la catalyse peuvent être préparés puis isolés, ils peuvent parfois être générés in situ par l'addition d'un halogénure de métal et du ligand souhaité. Par exemple, le chlorure de palladium et la triphénylphosphine peuvent souvent être utilisés à la place du chlorure de bis(triphénylphosphine)palladium(II) (en) pour les réactions de couplage catalysées au palladium.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Metal halides » (voir la liste des auteurs).
- (en) N.N. Greenwood et A. Ernshow, Chemistry of the Elements, Butterworth-Heinemann, , 819-824 p.
- Alfred R. Pray, Richard F. Heitmiller et Stanley Strycker, « Anhydrous Metal Chlorides », Inorganic Syntheses, vol. 28, , p. 321–323 (ISBN 978-0-470-13259-3, DOI 10.1002/9780470132593.ch80)
- (en) Daniele Choueiry et Ei-ichi Negishi, Handbook of Organopalladium Chemistry for Organic Synthesis, New York, Ei-ichi Negishi et John Wiley & Sons, Inc., , 3279 p., Google Books excerpt (ISBN 0-471-31506-0, lire en ligne), chap. II.2.3 (« Pd(0) and Pd(II) Complexes Containing Phosphorus and Other Group 15 Atom Ligands »)
- Gordon K. Anderson et Minren Lin, « Bis(Benzonitrile)Dichloro Complexes of Palladium and Platinum », Inorg. Synth., vol. 28, , p. 60–63 (DOI 10.1002/9780470132593.ch13)
- Gill, N. S. et Taylor, F. B., « Tetrahalo Complexes of Dipositive Metals in the First Transition Series », Inorg. Synth., vol. 9, , p. 136–142 (DOI 10.1002/9780470132401.ch37)
- G. D. Stucky, J. B. Folkers et T. J. Kistenmacher, « The Crystal and Molecular Structure of Tetraethylammonium Tetrachloronickelate(II) », Acta Crystallographica, vol. 23, no 6, , p. 1064–1070 (DOI 10.1107/S0365110X67004268)
- V. Gutmann, « Solvent effects on the reactivities of organometallic compounds », Coord. Chem. Rev., vol. 18, no 2, , p. 225 (DOI 10.1016/S0010-8545(00)82045-7)
- (en) J. F. Hartwig, Organotransition Metal Chemistry, Sausalito (Calif.), University science books, , 1127 p. (ISBN 978-1-891389-53-5 et 1-891389-53-X), chap. 4 (« Covalent (X-Type) Ligands Bound Through Metal-Heteroatom Bonds »)
- Pier Giorgio Cozzi, « Metal-Salen Schiff base complexes in catalysis: Practical aspects », Chem. Soc. Rev., vol. 33, no 7, , p. 410–21 (PMID 15354222, DOI 10.1039/B307853C)
- Geoffrey Wilkinson, « Ferrocene », Org. Synth., vol. 4, , p. 473