Haustorium
Un haustorium ou haustorie (du latin haustos « puiser ») est un organe d'une plante ou d'un champignon parasite biotrophe ou symbionte (lichen), qui s'insère dans les tissus de la plante hôte, pour absorber l'eau et les nutriments contenus dans les cellules.
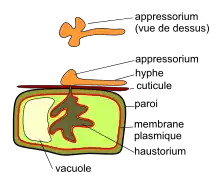
On emploie aussi le terme de suçoir intercellulaire (intracellulaire en apparence), pour désigner l'expansion développée par ces parasites et qui traverse la paroi pectocellulosique en repoussant légèrement la membrane de la cellule, sans la rompre. Cette expansion, ainsi nichée dans un repli de la membrane, la rend perméable et pompe des petites molécules de la cellule, ce qui réclame à ces parasites que peu ou pas de digestion, et rend la réaction de défense des plantes contre ce parasite (par exemple accumulation de tannins toxiques dans les vacuoles) sans effet[1].
Haustorium est le nom de la revue officielle, publiée deux fois par an, de la Société internationale des plantes parasites (International Parasitic Plant Society)[2].
Plantes vasculaires
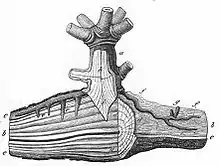
(a = partie inférieure de la tige du gui, h = bois du gui, i = racine principale du gui, f = racines du gui, qui poussent sur l'écorce (c) de la branche d'arbre, g = bourgeons de gui, e = suçoirs; d : coupe transversale du bois (b) de l'hôte[3].)
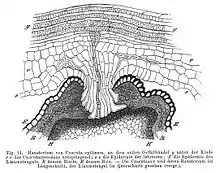
(Haustorium en coupe longitudinale, lin en coupe transversale. Cuscute : e = épiderme, r = écorce, g = faisceau vasculaire. Lin: E = épiderme, R = écorce et fibre, H = bois)[3].
Chez la plupart des plantes vasculaires parasites, les haustoriums sont développés à partir des racines, comme chez :
- le gui qui établit préalablement le contact avec les tissus de la plante hôte grâce à un épithélium d'adhésion, dont les cellules ressemblent à des poils sécrétoires,
- les Orchidaceae ou le genre Rafflesia.
L'haustorium est primaire s'il est directement formé à partir de l'apex racinaire (par exemple, chez Striga asiatica) ou secondaire, s'il est créé à partir d'autres tissu que ceux de l'apex de la racine, comme des apex racinaires secondaires ou des tissus latéraux de la racine (par exemple, chez Ximenia ou Dasistoma).
Les haustoriums (ou haustoria) peuvent aussi naître de la tige chez les holoparasites, par exemple, chez les orobanches, les Conopholis, les Balanophora ou les cheveux du diable (cuscutes)[4],[5]. Ils viennent en contact avec les faisceaux vasculaires de la plante hôte. Le xylème et le phloème sont preforés. Chez les cheveux de Vénus (Cuscute du thym), les haustoriums ont la forme d'un doigt[6].
En embryologie des angiospermes, on trouve également la formation d'haustoriums, composés de parties du sac embryonnaire, de l'embryon ou de l'endosperme.
Champignons
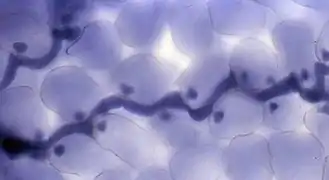
La structure sombre allongée est l'hyphe, les petites sphères sombres les haustoriums.
Les champignons de toutes les divisions forment des haustoriums. En mycologie, ce sont les hyphes qui se transforment en filaments mycéliens spécialisés, permettant au champignon d'accroître la surface de contact avec la membrane plasmique de l'hôte. La libération d'une enzyme provoque la perforation des parois des cellules qu'ils parasitent, ce qui facilite le transfert des composés organiques vers le parasite. C'est ainsi qu'on peut considérer qu'un insecte hébergeant un champignon parasite comme le Cordyceps, est « digéré de l'intérieur », au fur et à mesure de la croissance du champignon.
L'haustorium est formé par des hyphes intercellulaires, des appressoriums ou des hyphes externes. L'hyphe devient plus étroit alors qu'il franchit la membrane cellulaire, puis s'élargit en invagination dans la cellule. Un col épais, opaque en microscopie électronique, se dépose autour de l'hyphe, à l'endroit où il s'invagine[7]. Ensuite, la membrane de la cellule hôte se modifie profondément dans la zone invaginée. Les inclusions, normalement présentes dans la membrane plasmique, sont alors absentes et la couche externe contient plus de polysaccharides. L'haustorium comporte un grand nombre de mitochondries et de ribosomes. Il a un reticulum endoplasmique développé. La paroi des deux partenaires est fortement amincie. Entre la paroi cellulaire des cellules hôtes et le plasmalemme de l'haustorium se forme une couche amorphe (capsule), par laquelle s'effectuent tous les processus d'échange entre l'hôte et le parasite. L'haustorium peut être en forme de vésicule, de spirale, de haricot ou de doigt. Parfois, une même cellule fongique peut créer plusieurs haustoriums.
Des échanges fonctionnels se produisent dans le complexe haustorial. L'haustorium émet des protéines dans la cellule parasitée. L'hôte fournit des composés organiques au champignon et l'activité métabolique dans le complexe est très supérieure à ce qu'elle est en dehors de celui-ci. Le carbone organique fourni par l'hôte est absorbé par le champignon et immédiatement transporté dans le reste du thalle. La plante hôte semble obéir aux signaux émis par le champignon et le complexe paraît être sous le contrôle de l'envahisseur[8].
Parmi les champignons les plus étudiés, on trouve, pour leur importance en agriculture, l'oïdium (Blumeria graminis) et la rouille[9].
Lichens
Dans les lichens, les haustoriums mettent en liaison des cellules d'algues (appressoriums) avec des hyphes du champignon. Ils permettent des échanges trophiques entre les partenaires symbiotiques (photosymbiote, endocytobiose). Parfois il n'y a que contact des parois, mais, souvent, la paroi squelettique de l'algue ou la gaine muqueuse des cyanobactéries est perforée (haustorium intracellulaire ou haustorium intrapariétal), alors que la membrane cytoplasmique de la cellule du photosymbiote n'est jamais perforée[10].
Mousses
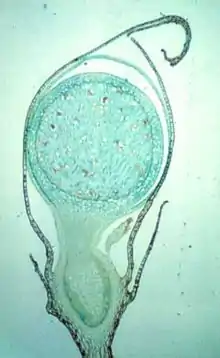
Chez les mousses, la base du sporogone est appelée haustorium. Le sporogone l'utilise pour prélever les éléments nutritifs dans les gamétophytes.
Fougères
L'embryon de la fougère développe également un pied, appelé haustorium, par entre en contact avec le prothalle.
Histoire
L'haustorium est découvert, chez les champignons, par le phytopathologiste allemand Anton de Bary.
Notes et références
- Marc-André Selosse, Les Goûts et les couleurs du monde. Une histoire naturelle des tannins, de l'écologie à la santé, Actes Sud Nature, , p. 87
- Julius Sachs, Vorlesungen über Pflanzenphysiologie, 2eédition, Leipzig, 1887.
- Eduard Strasburger, Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner, Lehrbuch der Botanik für Hochschulen, p. 172, 35e édition, Éditions académiques Spektrum, Heidelberg, 2002, (ISBN 3-8274-1010-X).
- Walter Eschrich, Funktionelle Pflanzenanatomie, p. 155 sq., éditions Springer, Berlin, 1995, (ISBN 3-540-59131-1).
Voir aussi
Bibliographie
- (cs) Jaroslav Klán, Co víme o houbách, p. 310, Éditions pédagogiques d'État, Prague, 1989, .
- (de) Gerhard Wagenitz, Wörterbuch der Botanik, p. 137, 2e édition, Éditions académiques Spektrum, Heidelberg, Berlin, 2003, (ISBN 3-8274-1398-2).
- (en) M. Birschwilks, S. Haupt, D. Hofius, S. Neumann, Transfer « of phloem-mobile substances from the ost plants to the holoparasite Cuscuta sp. », dans Journal of Experimental Botany, vol. 57, p. 911 à 921, 2006.
- (en) L. López-Curto, J. Márquez-Guzmán, D. M. Díaz-Pontones, « Invasion of Coffea arabica (Linn.) by Cuscuta jalapensis (Schlecht): in situ activity of peroxidase », dans Environmental and Experimental Botany, vol. 56, n° 2, p. 127 à 135, 2006.
- (en) Guo YiQing, Kim KilUng, Lee InJung, J. I. Yoder, Shin DongHyun, « Haustorium induction of parasitic plant: a new bioassay method to determine allelopathic potential », dans Allelopathy Journal, vol. 22, n° 2, p. 371 à 378, 2008.
- (en) Henning S. Heide-Jørgensen, Parasitic Flowering Plants, éditions Brill, Leyde, 438 p., 2008, (ISBN 978 90 04 16750 6).
- (en) Zhang RuMin, Chen HongWei, Zhang Dan, Bai Jing, Gao Yan, « Chemical induction on the seed germination and haustorium formation of Cistanche deserticola », dans Scientia Silvae Sinicae, vol. 45, n° 6, p. 39 à 44, 2009.
- (en) M. Albert, S. van der Krol, R. Kaldenhoff, « Cuscuta reflexa invasion induces Ca2+ release in its host », dans Plant Biology, vol. 12, n° 3, p. 554 à 557, 2010.
- (en) P. C. G. Bandaranayake, T. Filappova, A. Tomilov, N. B. Tomilova, D. Jamison-McClung, Q. Ngo, K. Inoue, J. I. Yoder, « A single-electron
reducing quinone oxidoreductase is necessary to induce haustorium development in the root parasitic plant Triphysaria », dans Plant Cell, n° 22, p. 1 404 à 1 419, 2010.
- (en) J. H. Westwood, J. I. Yoder, M. P. Timko, C. W. de Pamphilis, « The evolution of parasitism in plants », dans Trends in Plant Science, vol. 15, n° 4, p. 227 à 235, 2010.
- (ru) N. P. Cherepanov, A. V. Tobias, Морфология и размножение грибов, éditions de l'Académie des sciences, 2006.
Lien externe
- Portail de la botanique
- Portail de la mycologie
- Portail de la protection des cultures