Leucémie dérivée des cellules dendritiques plasmocytoïdes
La leucémie dérivée des cellules dendritiques plasmocytoïdes (LpDC) est une hémopathie maligne rare. Elle a initialement été considérée comme une forme de lymphome cutanée dérivé de lymphocytes et nommée alternativement cancer hématodermique CD4+CD56+, lymphome à cellules NK blastiques[1], et lymphome agranulaire à cellules NK CD4+[2]. Plus tard, toutefois, la maladie a été déterminée comme étant une hémopathie maligne de cellules dendritiques plasmocytoïdes plutôt qu’à lymphocytes et par conséquent appelée leucémie dérivée des cellules dendritiques plasmocytoïdes. En 2016, l’Organisation Mondiale de la Santé a désigné la LpDC comme étant une catégorie à part entière au sein des leucémies myéloïdes[3]. Il est estimé que les LpDC constituent 0,44% des hémopathies malignes[4].
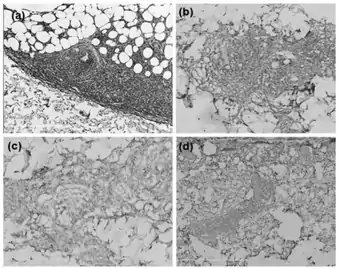
La leucémie dérivée des cellules dendritiques plasmocytoïdes est une hémopathie maligne agressive avec des éléments de lymphome cutané (e.g. envahissement de cellules dendritiques plasmocytoïdes malignes dans la peau formant des lésions simples ou multiples) et/ou de leucémie (i.e. cellules dendritiques plasmocytoïdes malignes dans le sang et la moelle osseuse)[2]. Tandis qu’elle présente communément ces tableaux cliniques, la LpDC, particulièrement dans des stades avancés, peut aussi être associée à des infiltrations envahissantes de cellules dendritiques plasmocytoïdes malignes, et donc des lésions, dans le foie, la rate, les ganglions lymphatiques, le système nerveux central ou d’autres tissus. Cette leucémie apparaît chez des personnes de tout âge, mais prédomine chez les personnes âgées et les enfants ; elle affecte tout autant les femmes et les hommes mais chez l’adulte est beaucoup plus fréquente (environ 75% des cas) chez la femme[5].
La leucémie dérivée des cellules dendritiques plasmocytoïdes répond généralement bien aux protocoles de chimiothérapie utilisés pour traiter les hémopathies malignes. Bien trop souvent, néanmoins, la maladie peut récidiver et le fait sous une forme résistante aux médicaments[5]. De surcroît, la maladie peut apparaître en association avec le syndrome myélodysplasique ou se transformer en leucémie aigüe myéloblastique[4]. En conséquence, la LpDC a un taux de survie très bas de 5 ans[4]. Des études actuelles de recherche translationnelle sur un traitement de la LpDC se sont donc concentrés sur des traitements non chiomiothérapeutiques qui ciblent les voies moléculaires qui favorisent la maladie[6].
Des recherches sur cette pathologie sont en cours. En France, devant la rareté des cas, un réseau national «leucémie pDC » a été mis en place afin de recruter de nouveaux cas et d’étudier les différents caractéristiques cytologiques, phénotypiques, cytogénétiques, anatomopathologiques et moléculaires de ces cellules[7].
Présentation
La leucémie dérivée des cellules dendritiques plasmocytoïdes peut survenir chez les enfants[5], nouveau-nés inclus[8], mais est plus commune chez les adultes, en particulier ceux entre 60 et 80 ans[5]. La LpDC se présente habituellement (i.e. entre 61[5]et 90%[9]des cas) avec des lésions de la peau à type de nodules, de tumeurs, de papules rouges ou violettes, de plaques ecchymotiques, et/ou d’ulcères qui apparaissent le plus souvent au niveau de la tête, de la face, et du torse supérieur[2]. Les lésions sont dues à l’envahissement diffus de la peau par des pDC malignes.
Dans une vaste étude, cette présentation clinique a été accompagnée d’adénopathies, habituellement dans le cou, dues à l’envahissement de pDC malignes (environ 50% des cas) ; d’une hépatomégalie (environ 16% des cas) et/ou d’une splénomégalie(26% des cas), aussi dues à l’envahissement de pDC malignes[5]; une concentration accrue de pDC malignes dans le sang (i.e. > 2% des cellules nucléées) (environ 40% des cas), dans la moelle osseuse (environ 65% des cas) et dans le liquide cérébrospinal (47% des cas pédiatriques mais moins fréquent dans les cas adultes)[5].
Les cas les plus avancés ou les plus graves peuvent présenter une augmentation extrême du volume d’organes ou de ganglions lymphatiques, des lésions cutanées sur pratiquement n’importe quelle zone, et des signes cliniques d’envahissement de pDC malignes dans les seins, les yeux, les reins, les poumons, le tube digestif, les os, les sinus, les oreilles, ou les testicules[5].
Environ 10% des personnes atteintes de LpDC présentent les symptômes de la leucémie[4], i.e. ils présentent des pDC malignes circulantes, une anémie, une thrombocytopénie, et/ou une leucopénie due à l’envahissement étendu de pDC dans la moelle osseuse. Une phase leucémique de la maladie est un élément commun du stade terminal et de la rechute de la LpDC[2].
Physiopathologie
Il existe trois types de cellules dendritiques : les cellules dendritiques plasmocytoïdes (pDC) et deux types de cellules dendritiques conventionnelles (cDC), les cellules myéloïdes cDC1 et cDC2[10]. Les pDC circulent dans le sang, représentant moins de 0,4% de toutes les cellules sanguines, et sont présentes dans différents organes lymphoïdes secondaires comme les ganglions lymphatiques et la rate[2].
Leur principale fonction est de détecter des pathogènes intracellulaires afin d’initier une réponse immune, particulièrement le virus de l’herpès, le VIH et des virus des hépatites mais aussi des bactéries comme Mycobacterium tuberculosis, des champignons comme Aspergillus fumigatuset des parasites comme Plasmodium falciparum. Après détection de ces pathogènes intracellulaires, les pDC initie une réponse immune aussi bien en produisant une quantité importante d’interféron de type I[11]et de type III[10]qu’en se différenciant (i.e. en maturant) en cellules dendritiques conventionnelles qui en outre favorisent les réponses immunes en fonctionnant, par exemple, comme une cellule présentatrice de l’antigène[11].
Les pDC malignes de la LpDC ont une apparence de cellules dendritiques plasmocytoïde immatures. Elles se distinguent des autres cellules dendritiques, myéloïdes, lymphoïdes et NK par au moins plusieurs des propriétés suivantes :
- une morphologie plasmocytoïde ;
- une production d’une quantité importante d’interféron de type I lors d’une stimulation appropriée ;
- l’aptitude de se différencier en cDC lors d’une réponse appropriée ;
- l’expression de marqueur clé protéique comme la granzyme B[11], TCF4[12], interleukine-3-receptor (i.e. CD123), CLEC4C, et la neuropiline[10];
- l’absence d’expression de certains marqueurs protéiques qui sont communément exprimés par les cellules des lignées myéloïdes, lymphoïdes et NK[12].
La leucémie à cellules dendritiques plasmocytoïdes survient généralement après l’acquisition en série de multiples anomalies génétiques des pDC ou de leurs précurseurs cellulaires. Les mutations inactivatrices (i.e. des mutations qui causent au gène une activité moindre ou nulle) du gène TET2 sont les anomalies génétiques les plus communes de la maladie[12], apparaissant dans 32 à 67% de tous les cas de LpDC et sont souvent accompagnées de mutations soit du gène NPM1soit du gène SRSF2.
De nombreuses autres anomalies génétiques sont associées à la maladie :
- mutation de NRAS, ASXL1, et TP53;
- délétion du locus CDKN2A-ARF-CDKN2B sur le bras court du chromosome 9, du locus CDKN1B sur le bras court du chromosome 12, du locus RB1 sur le bras long du chromosome 13, ou du locus NRC1 sur le bras long du chromosome 5;
- fusion de KMT2A sur le bras long du chromosome 11 avec MLLT1 sur le bras court du chromosome 10, de SUPT3H sur le bras court du chromosome 8 avec MYC sur le bras long du chromosome 8, ou de KMT2A sur le bras long du chromosome 11 avec MLLT1 sur le bras long du chromosome 19[13];
- duplication ou perte de chromosomes entiers, en particulier les chromosomes 9, 13, ou 15[4].
Des études en laboratoire indiquent que les pDC malignes ont une voie NF-κB pathologiquement suractivées qui encourage leur survie et la production de nombreuses cytokines qui stimulent leur propre prolifération[9]. Vraisemblablement, ces anomalies génétiques mènent à l’activation de la voie NF-κB et/ou d’autres voies cellulaires activatrices qui promeuvent la survie, la prolifération et/ou d’autres traits phénotypiques malins chez les pDC et ainsi causent la LpDC[13].
Diagnostic
La LpDC est évoquée devant une biopsie de lésions cutanées qui révèle l’envahissement par des cellules blastiques de taille moyenne (i.e. immature) dans le derme, épargnant l'épiderme[4]. Ces cellules présentent un noyau irrégulier, une chromatine peu condensée, et au moins un petit nucléole[9]. De telles cellules blastiques peuvent aussi être observées dans la circulation, la moelle osseuse ou d’autres tissus et suggèrent une LpDC. Toutefois, le diagnostic de cette maladie requiert la détermination que ces cellules correspondent bien à des pDC blastiques et non pas à une LAM, un lymphome T, ou une leucémie NK agressive. Diverses études ont proposé des critères similaires mais pas identiques pour cette détermination.
Toutes les études s’accordent sur le fait que les pDC devraient avoir une morphologie typiquement plasmocytoïde et exprimer un profil particulier de marqueurs protéiques détectés par test immunologique ou cytométrie en flux. Néanmoins, les études ne s’accordent pas sur les marqueurs protéiques du profil. Une étude en particulier a analysé le profil :
- CD4, CD56, CD123(i.e. Interleukin-3 receptor), et TLC1, qui sont exprimés par 80 à 100% des pDC et inhabituel dans la LAM ou les leucémies blastiques T ou NK
- CD2AP et CLEC4C qui sont spécifiques aux pDC
- myéloperoxidase, lysozyme, CD34, CD14, CD11c, et CD163 qui sont spécifiques des LAM ou des leucémies blastiques T ou NK[4].
Deux autres études ont recommandé d’analyser des ensembles de marqueurs protéiques quelque peu différents[2],[13].
Traitement
Il n’existe pas d’étude contrôlée définissant le traitement opitmal pour la LpDC[9]. Des études sur un petit nombre de personnes atteints de la maladie ont pointé que le protocole chimiothérapeutique standard utilisé pour l’induction du traitement de la LAM, la LAL et le lymphome de haut grade permet un taux de rémission complète de 77%, 93% et 80%, respectivement, contre la LpDC pédiatrique et 47%, 77% et 53%, respectivement, contre la LpDC adulte. Toutefois, ces rémissions étaient de courte durée : la durée moyenne post-traitement de la survie ou de l’absence de rechute était de 12 mois pour les enfants et de 6,8 mois pour les adultes[5].
Étant donné ces taux faibles de rémission et de survie, d’autres traitements ont été ajoutés aux protocoles de traitement initiaux. Des études ont montré que l’administration d’un traitement prophylactique par voie intrathécale dans le canal spinal prolonge la période sans atteinte du système nerveux central et augmente la durée de survie. La transplantation de cellules souches hématopoïétiques après une rémission initiale induite par chimiothérapie prolonge aussi la rémission et il est suggéré qu’elle guérit la maladie.
Une réaction du greffon contre la leucémie peut avoir contribué aux bénéfices observés après la transplantation[4]. Les études n’ont pas encore déterminé si la greffe allogénique (i.e. de cellules souches prélevées sur quelqu’un d’autre) ou autologue (i.e. de cellules souches prélevées sur la même personne) atteint de meilleurs résultats même si une étude rétrospective au Japon a découvert que les propres cellules souches ont donné généralement un meilleur taux significatif de survie sans progression de la maladie[9].
Un essai clinique de phase I pour tester la sécurité et l’efficacité d’une combinaison de traitements chimiothérapeutiques consistant au méthotrexate, L-asparaginase, idarubicine et dexaméthasone suivi par une transplantation allogénique ou autologue de moelle osseuse chez 26 participants nouvellement diagnostiqués avec une LpDC est planifiée mais elle n’est pas encore à sa phase de recrutement[14].
Alors que peu d’études portent sur le traitement de la LpDC en récidive d’une thérapie initiale, la perfusion de lymphocytes de donneurs couplée avec des traitements chimiothérapeutiques ont induit une seconde rémission complète ou partielle chez quelques patients[4].
Pronostic
À cause du fort taux de récurrence suivant la thérapie initiale et le faible durée totale de survie des personnes atteintes de LpDC, le pronostic de cette maladie est mauvais. Néanmoins, des études sur des protocoles de traitement qui incluent de la chimiothérapie par voie intrathécale et la transplantation de cellules souches hématologiques en traitement initial (voir section précédente) et de nouvelles perspectives non chimiothérapeutiques (voir section suivante) pourraient améliorer cette situation[9].
Traitements innovants
CAR-T123
Les CAR-T123 sont des cellules dotées d’un récepteur antigénique chimérique, i.e. ce sont des lymphocytes T conçus pour porter un anticorps monoclonal qui reconnait spécifiquement et tue les cellules de la LpDC.
Aux États-Unis, la perfusion intraveineuse de ces cellules chez des personnes atteintes de LpDC en est en essai clinique de phase I[15] mais en , la FDA les a suspendu car un des patients a développé un syndrome de libération des cytokines[15]. La suspension a été levée en novembre 2017 après que l’étude utilise des quantités réduites de cellules avec l’application de conditions supplémentaires[16]. Un nouvel essai clinique de phase I recrute actuellement 76 nouveaux patients pour étudier la sécurité et l’efficacité des CAR-T123 dans le traitement de la LpDC. L’étude a commencé en et est prévue de finir en [17].
SL-401
Le SL-401 est un agent biologique correspondant à de l’IL-3 génétiquement fusionnée à de la DT tronquée avec un lien clivable. Une étude française a démontré la cytotoxicité dose-dépendante de cet agent biologique contre les pDC malignes et leurs précurseurs[18]. Le SL-401 a été présenté comme d’une efficacité supérieure à d’autres traitements chimiothérapeutiques testés (cytosine, arabinoside, cyclophosphamide, vincristine, dexaméthasone, méthotrexate, Erwinia, L-asparaginase, et asparaginase) excpeté l'idarubicine[18]. Une correlation entre l’expression du marqueur CD123 et l’efficacité du SL-401 a de même été découverte. Un essai clinique de phase I/II réalisé sur 11 patients atteints de LpDC a indiqué qu’un cycle de SL-401 permettait 78% de réponses importantes chez les patients[19].
Venetoclax
BCL-2 est une protéine cellulaire qui peut agir pour inhiber l’induction de la mort cellulaire par apoptose. Le gène BCL-2 est un des plus suractivés dans la LpDC[9]. Le venetoclax inhibe l’action d’induction de l’apoptose de BCL-2 et a prouvé une activité dans le traitement de deux patients avec une LpDC récidivante ou réfractaire. Un essai clinique de phase I testant la sécurité et l’efficacité de ce médicament contre la LpDC est planifiée mais n’en est pas encore à sa phase de recrutement[20].
Notes et références
- D. N. Slater, « The new World Health Organization-European Organization for Research and Treatment of Cancer classification for cutaneous lymphomas: a practical marriage of two giants », The British Journal of Dermatology, vol. 153, no 5, , p. 874–880 (ISSN 0007-0963, PMID 16225594, DOI 10.1111/j.1365-2133.2005.06905.x, lire en ligne, consulté le )
- Agnieszka Owczarczyk-Saczonek, Małgorzata Sokołowska-Wojdyło, Berenika Olszewska et Marta Malek, « Clinicopathologic retrospective analysis of blastic plasmacytoid dendritic cell neoplasms », Postepy Dermatologii I Alergologii, vol. 35, no 2, , p. 128–138 (ISSN 1642-395X, PMID 29760611, PMCID PMCPMC5949541, DOI 10.5114/ada.2017.72269, lire en ligne, consulté le )
- Daniel A. Arber, Attilio Orazi, Robert Hasserjian et Jürgen Thiele, « The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia », Blood, vol. 127, no 20, 05 19, 2016, p. 2391–2405 (ISSN 1528-0020, PMID 27069254, DOI 10.1182/blood-2016-03-643544, lire en ligne, consulté le )
- Jill M. Sullivan et David A. Rizzieri, « Treatment of blastic plasmacytoid dendritic cell neoplasm », Hematology. American Society of Hematology. Education Program, vol. 2016, no 1, , p. 16–23 (ISSN 1520-4383, PMID 27913457, PMCID PMC6142460, DOI 10.1182/asheducation-2016.1.16, lire en ligne, consulté le )
- Marie Jeong-Min Kim, Ahmed Nasr, Bilaal Kabir et Joseph de Nanassy, « Pediatric Blastic Plasmacytoid Dendritic Cell Neoplasm: A Systematic Literature Review », Journal of Pediatric Hematology/Oncology, vol. 39, no 7, , p. 528–537 (ISSN 1536-3678, PMID 28906324, DOI 10.1097/MPH.0000000000000964, lire en ligne, consulté le )
- Francine Garnache-Ottou, Philippe Saas et Jean Feuillard, « Une nouvelle entité : les leucémies CD4+ CD56+ ou leucémies dérivées des cellules dendritiques plasmocytoïdes », Spectra Biologie, vol. 147, , p. 49-58 (spectrabiologie.fr/wp-content/uploads/2012/05/SB147_49-58.pdf)
- Irene Roberts, Nicholas J. Fordham, Anupama Rao et Barbara J. Bain, « Neonatal leukaemia », British Journal of Haematology, vol. 182, no 2, , p. 170–184 (ISSN 1365-2141, PMID 29806701, DOI 10.1111/bjh.15246, lire en ligne, consulté le )
- Shunan Wang, Xingtong Wang, Mingsuo Liu et Ou Bai, « Blastic plasmacytoid dendritic cell neoplasm: update on therapy especially novel agents », Annals of Hematology, vol. 97, no 4, , p. 563–572 (ISSN 1432-0584, PMID 29455234, DOI 10.1007/s00277-018-3259-z, lire en ligne, consulté le )
- Matthew Collin et Venetia Bigley, « Human dendritic cell subsets: an update », Immunology, vol. 154, no 1, , p. 3–20 (ISSN 1365-2567, PMID 29313948, PMCID PMC5904714, DOI 10.1111/imm.12888, lire en ligne, consulté le )
- Solana Alculumbre, Salvatore Raieli, Caroline Hoffmann et Rabie Chelbi, « Plasmacytoid pre-dendritic cells (pDC): from molecular pathways to function and disease association », Seminars in Cell & Developmental Biology, vol. 86, , p. 24–35 (ISSN 1096-3634, PMID 29444460, DOI 10.1016/j.semcdb.2018.02.014, lire en ligne, consulté le )
- Lhara Sumarriva Lezama, Karen M. Chisholm, Eugene Carneal et Alexandra Nagy, « An analysis of blastic plasmacytoid dendritic cell neoplasm with translocations involving the MYC locus identifies t(6;8)(p21;q24) as a recurrent cytogenetic abnormality », Histopathology, vol. 73, no 5, , p. 767–776 (ISSN 1365-2559, PMID 29884995, DOI 10.1111/his.13668, lire en ligne, consulté le )
- Sakurako Suma, Mamiko Sakata-Yanagimoto, Tran B. Nguyen et Keiichiro Hattori, « Blastic plasmacytoid dendritic cell neoplasm arising from clonal hematopoiesis », International Journal of Hematology, vol. 108, no 4, , p. 447–451 (ISSN 1865-3774, PMID 29705980, DOI 10.1007/s12185-018-2461-z, lire en ligne, consulté le )
- (en) « Combination Chemotherapy in Patients With Newly Diagnosed BPDCN - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov (consulté le )
- (en) Selina McKee, « FDA holds trials of Cellectis’ cell therapy after patient death », sur PharmaTimes, (consulté le )
- (en-US) « FDA Lifts Clinical Hold on Cellectis' UCART123 Trials in AML, BPDCN », sur Immuno-Oncology News, (consulté le )
- (en) « Study to Evaluate the Safety and Clinical Activity of UCART123 in Patients With BPDCN - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov (consulté le )
- Fanny Angelot-Delettre, Anne Roggy, Arthur E. Frankel et Baptiste Lamarthee, « In vivo and in vitro sensitivity of blastic plasmacytoid dendritic cell neoplasm to SL-401, an interleukin-3 receptor targeted biologic agent », Haematologica, vol. 100, no 2, , p. 223–230 (ISSN 1592-8721, PMID 25381130, PMCID PMC4803130, DOI 10.3324/haematol.2014.111740, lire en ligne, consulté le )
- A. E. Frankel, J. H. Woo, C. Ahn et N. Pemmaraju, « Activity of SL-401, a targeted therapy directed to interleukin-3 receptor, in blastic plasmacytoid dendritic cell neoplasm patients », Blood, vol. 124, no 3, , p. 385–392 (ISSN 0006-4971 et 1528-0020, DOI 10.1182/blood-2014-04-566737, lire en ligne, consulté le )
- (en) « Study of Venetoclax, a BCL2 Antagonist, for Patients With Blastic Plasmacytoid Dendritic Cell Neoplasm (BPDCN) - Full Text View - ClinicalTrials.gov », sur clinicaltrials.gov (consulté le )