Mécanisme réactionnel
En chimie, un mécanisme réactionnel est l'enchainement d'étapes, de réactions élémentaires, par lequel un changement chimique a lieu[1].
Bien que, pour la plupart des réactions, seul le bilan global (transformation des réactifs en produits) soit observable directement, des expériences permettent de déterminer la séquence possible des étapes du mécanisme réactionnel associé.
Description
Un mécanisme réactionnel décrit en détail ce qui se passe à chaque étape d'une transformation chimique. Il décrit chaque état de transition et intermédiaire réactionnel, quelles liaisons sont rompues et dans quel ordre, quelles liaisons sont reformées et dans quel ordre, ainsi que la vitesse relative de chaque étape. Un mécanisme réactionnel complet fournit aussi la quantité de chaque réactif consommé et celle de chaque produit formé. Il décrit la catalyse éventuelle et la stéréochimie des espèces chimiques qui entrent en jeu. L'ordre de réaction par rapport à chaque réactif doit aussi être indiqué.
Une réaction en une seule étape est, en réalité, souvent constituée de plusieurs sous-étapes. Les intermédiaires sont souvent des molécules instables, des radicaux libres ou des ions. Les états de transition correspondent à des maxima sur la coordonnée de réaction et à des points selles sur la surface d'énergie potentielle de la réaction.
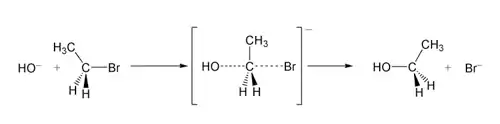
Représentation
Mouvement des électrons
Outre la représentation topologique des molécules mises en jeu dans la réaction, des flèches indiquent le mouvement (réel ou théorique) des électrons lors de la réaction.
- Une flèche simple (⟶) indique le mouvement de deux électrons.
- Une demi-flèche (⇀) indique le mouvement d'un seul électron.
Flèches de transformation
Lorsqu'une ou plusieurs molécules se transforment en une autre molécule, la nature de la flèche indique le type de transformation :
- ⟷ est une flèche de mésomérie. Il ne s'agit ni d'une réaction chimique, ni d'un équilibre.
- ⇌ est une flèche représentant un équilibre entre les molécules à gauche et à droite de la flèche
- ⟶ représente une transformation chimique irréversible (contrairement à l'équilibre).
Cinétique chimique
Des informations sur le mécanisme d'une réaction sont souvent fournies par l'étude de la cinétique chimique pour déterminer la loi de vitesse et l'ordre de réaction par rapport à chaque réactif.[2]
Soit la réaction suivante par exemple:
- CO + NO2 → CO2 + NO
Il a été montré expérimentalement que la cinétique de cette réaction est régie par la loi de vitesse : . Cette forme suggère que l'étape cinétiquement déterminante est une réaction entre deux molécules de NO2, et un mécanisme possible qui est conforme à la loi de vitesse serait le suivant :
- 2 NO2 → NO3 + NO (lent)
- NO3 + CO → NO2 + CO2 (rapide)
Chaque étape est dite « étape élémentaire » et chacune a sa propre loi de vitesse et molécularité. La réaction globale est la combinaison de ces étapes. Quand on détermine la cinétique globale de la réaction, l'étape la plus lente est celle qui détermine la vitesse de réaction. Ici, la première étape est la plus lente, elle est donc cinétiquement déterminante. Comme il s'agit d'une collision entre deux molécules NO2, la réaction est bimoléculaire, avec une loi de vitesse qui s'écrit comme ceci : . Si on additionne les deux étapes, on retrouve la réaction globale.
D'autres réactions peuvent avoir des mécanismes de plusieurs étapes consécutives, avec la possibilité de réaction de réarrangement comme étape. En chimie organique, l'un des premiers mécanismes réactionnels a été établi en 1903 par A. J. Lapworth, pour la condensation de benzoïne.
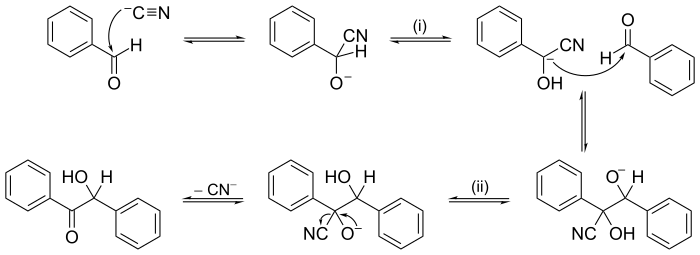
Il existe aussi des mécanismes plus complexes tels les réactions en chaîne, ayant des étapes de propagation de la chaîne en boucle fermé.
Modélisation
Pour construire un modèle prédictif satisfaisant, il faut disposer d'un mécanisme réactionnel correct. Or, pour de nombreuses combustions ou pour de nombreux systèmes qui se présentent sous la forme de plasma, les mécanismes détaillés ne sont pas connus. Et même dans le cas contraire, identifier et rassembler les données de sources variées et parfois contradictoires, extrapoler à des conditions différentes, etc., peut être difficile sans l'aide d'un expert. Les constantes de vitesse et les données thermochimiques sont souvent indisponibles dans la littérature, ce qui oblige, pour obtenir certains paramètres de manière théorique, à utiliser des techniques de chimie assistée par informatique.
Molécularité
La molécularité en chimie est le nombre d'entités moléculaires impliquées dans une seule étape de réaction. Une réaction qui met en jeu une seule entité est dite « unimoléculaire », elle est « bimoléculaire » pour deux entités et « termoléculaire » pour trois entités.
Voir aussi
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Reaction mechanism » (voir la liste des auteurs).
- (en) Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 1985, 3e édition, New York, Wiley, (ISBN 0-471-85472-7).
- (en) James H. Espenson, Chemical Kinetics and Reaction Mechanisms 2e édition, McGraw-Hill, 2002, chap.6 : « Deduction of Reaction Mechanisms » (ISBN 0-07-288362-6).
- Portail de la chimie