Encéphalite à tiques
L'encéphalite à tiques ou méningoencéphalite à tiques ou méningo-encéphalite verno-estivale à tiques (MEVE) est une encéphalite virale due à un arbovirus de la famille des Flaviviridae, le TBEV qui semble presque exclusivement vectorielle et presque toujours transmise par des tiques dures et notamment en Europe par Ixodes ricinus. Elle touche les humains ainsi que la plupart des mammifères.
.png.webp)
| Causes | Virus de la méningo-encéphalite à tiques |
|---|---|
| Transmission | Transmission par les tiques (d) |
| Incubation min | 7 j |
| Incubation max | 14 j |
| Symptômes | Céphalée, myalgie, fièvre, fatigue, photophobie, meningeal syndrome (d), somnolence (en), coma, vomissement, nausée, examen des signes méningés (d), paralysie et confusion (en) |
| Médicament | Thérapie par immunoglobulines, Ribonucléase, interféron, (RS)-baclofène, Tizanidine, tolperisone (en), vitamine B3 (en), gabapentine, carbamazépine, lamotrigine, piracetam, médecine hyperbare et diazépam |
|---|---|
| Spécialité | Infectiologie et neurologie |
| CIM-10 | A84 |
|---|---|
| CIM-9 | 063 |
| DiseasesDB | 29274 |
| MeSH | D004675 |
| Patient UK | Tick-borne-encephalitis-pro |
![]() Mise en garde médicale
Mise en garde médicale
Le virus est neurotrope pour le système nerveux central, il peut infecter les membranes (méningite) qui entourent le cerveau et la moelle épinière, les infectant à leur tour (encéphalite, myélite), d'où les termes de méningoencéphalite, encéphalomyélite, etc[1].
La maladie est encore mal connue. Elle se répartit sur le nord de l'Eurasie (de l'est de la France au Japon). Elle se présente sous des formes de gravité variable, liées à la répartition géographique, à l'espèce de tique vectrice, et à trois sous-types de virus (européen, sibérien et extrême-oriental).
Le nombre de cas augmente dans la plupart des pays européens, à l'exception de l’Autriche.
Quatre vaccins jugés sûrs et efficaces sont homologués par l'OMS dans les années 2010. Deux sont disponibles en Europe et au Canada. Les deux autres sont russes. En règle générale, ils sont recommandés en fonction des situations à risques, notamment pour les travailleurs ou voyageurs en région forestière endémique.
Histoire
Découverte
La maladie est décrite pour la première fois en 1931, par H. Schneider sous la forme d'une épidémie saisonnière (printemps-été) de méningites dans le district de Neunkirchen (Basse-Autriche). Elle est retrouvée en URSS, lors d’épidémies en 1934 sur des chantiers de défrichage en Sibérie, et en 1939 elle est signalée dans la partie européenne de la Russie[2].
Le virus est isolé en 1937 en Russie par Zilber et Soloviev, qui montrent aussi sa transmission par la tique Ixodes persulcatus, mais cette information ne sera publiée que 10 ans plus tard, après la guerre. En dehors de la Russie, un virus européen est isolé en 1949, transmis par la tique Ixodes ricinus et dans les années qui suivent, l'encéphalite à tiques est identifiable dans la plupart des pays européens[2],[3].
Dans le nord de la Chine, près de la frontière soviétique, la maladie est signalée en 1943. Le premier cas au Japon est diagnostiqué en 1993. En Corée du sud, le virus est présent chez les tiques, mais aucun cas humain n'a été détecté à la date de 2017[4].
Le premier cas français a été décrit en 1968, chez un garde-chasse de la forêt d'Illkirch, au sud de Strasbourg[5],[3].
Synonymes
La maladie a été appelée : Central European Encephalitis (CEE) ; Russian Spring Summer Encephalitis (RSSE) ; Taïga Spring Summer Encephalitis ; Früh Sommer Meningo-Enzephalitis (FSME) ; Zentraleuropäische Enzephalitis ; Zecken Enzephalitis ; encéphalite d’Europe Centrale ; encéphalite verno-estivale russe ; méningoencéphalite diphasique ; fièvre de lait diphasique ; méningoencéphalite biondulante ; maladie de Kumlinge (du nom d’une île finlandaise (Kumlinge), où de nombreux cas ont été étudiés) ; maladie de Schneider (du nom de son premier descripteur)[3].
Sa dénomination la plus courante au XXIe siècle est Tick Borne Encephalitis (TBE) en anglais ou « encéphalite à tiques » en français. Par usage ou convention, « encéphalite à tiques » sans précision, est utilisé et compris comme « encéphalite virale par arbovirus TBE, transmis par les tiques », ce qui exclut les encéphalites bactériennes transmises par des tiques (comme l'encéphalite par maladie de Lyme), et d'autres encéphalites virales par d'autres arbovirus, non transmis par les tiques (comme l'encéphalite japonaise, transmise par des moustiques).
Classification
Jusqu'aux années 1970, on distinguait deux maladies que l'on attribuait à deux virus différents[6] :
- l'encéphalite (à tiques) d’Europe centrale ;
- l’encéphalite (à tiques) verno-estivale russe.
Depuis, on considère que ces deux maladies, de présentation clinique différente, sont dues à des variantes plus ou moins virulentes d'un même virus, le TBEV Tick Borne Encephalitis Virus[6].
Au XXIe siècle, sur la base du séquençage génomique, trois sous-types du virus TBEV sont distingués, responsables d'encéphalites qui sont, par ordre de gravité croissante[7],[8],[9] :
- TBEV-Eu (Europe) : sous-type européen ou occidental (Est de la France à l'Europe centrale), dont le vecteur principal est la tique Ixodes ricinus, qui donne la forme la moins sévère des trois ;
- TBEV-Sib (Siberia) : sous-type sibérien (Europe de l'est et Sibérie de l'ouest), vecteur principal Ixodes persulcatus ;
- TBEV-FE (Far East) : sous-type extrême oriental (Sibérie de l'est, nord de la Chine et Japon), vecteur principal Ixodes persulcatus, qui donne la forme la plus grave.
Les trois sous-types peuvent circuler en même temps dans la Baltique, la partie européenne de la Fédération de Russie et en Sibérie[10].
Depuis 2018, deux nouveaux sous-types sont proposés à la discussion : le sous-type du lac Baïkal TBEV-Bkl et le sous-type de l'Himalaya (TBEV-Him)[11].
Virologie
Le virus de l’encéphalite à tiques appartient au genre Flavivirus de la famille des Flaviviridæ, qui renferme environ 70 virus dont les virus de la dengue, le virus de la fièvre jaune, le virus de l’encéphalite japonaise et le virus West Nile[12].
Le virion est constitué d’une molécule d’ARN monocaténaire associée à une protéine structurale « C », et enfermées dans une membrane centrale et une protéine d’enveloppe. Il se présente sous une forme sphérique, son diamètre est de 50 nm, soit 1/20e de micron. L'enveloppe externe est porteuse de deux protéines ; « M » et « E », la seconde étant impliquée dans l'identification du virus et son immunogénicité (déterminants antigéniques et induction de l'immunité protectrice chez l'hôte).
L'ARN, séquencé depuis 1989, est traduit et dupliqué sur les membranes extracellulaires du réticulum endoplasmique et de l'appareil de Golgi.
Les trois sous-types (occidental, sibérien et extrême-oriental) sont étroitement apparentés sur le plan génétique et antigénique. Ces sous-types ne présentent pas de variation antigénique importante, les vaccins disponibles contre le sous-type occidental seraient donc protecteurs contre les deux autres[13].
Le virus est sensible à la chaleur, il est détruit ou inactivé par la pasteurisation, mais il peut survivre de façon prolongée dans le lait cru et les produits laitiers non pasteurisés, et résister à l'environnement acide lors d'un éventuel passage dans l'estomac[14].
Vecteurs et réservoirs
Les tiques dures du genre Ixodes sont les principaux vecteurs et réservoirs du virus TBE. En Eurasie, plus de 8 espèces ont été identifiées comme étant capables de transmettre le virus[15]. Les plus importantes sont Ixodes ricinus et I. hexagonus en Europe, I. persulcatus en Sibérie, et Haemaphysalis concinna en Asie[11].
Cycle biologique de la tique

La tique se développe en 3 stades (larve, nymphe, adulte) durant en moyenne un 1 an (allant de 6 mois à plusieurs années selon les conditions climatiques[5]). Le virus peut être transmis à tous les stades.
Les tiques hibernent de préférence dans les sous-bois humides, près des cours d’eau. La femelle pond des centaines d’œufs qui peuvent déjà être infectés.
Les larves à six pattes issues des œufs s'activent et font leur premier repas de sang dès que la température extérieure dépasse 5 °C. Les conditions climatiques déterminent l'activité des tiques qui peut être retardée (hiver rigoureux et printemps tardif) ou avancée (hiver doux et printemps précoce)[5].
Elles attendent leur victime sur un brin d’herbe, pour les accrocher au passage. Au cours de leur repas, elles peuvent transmettre le virus à leur hôte (un petit animal : souris, écureuil etc.) ou au contraire s’infecter si leur victime est porteuse du virus.
Il existe un phénomène de « co-feeding », lorsque des larves ou nymphes (infectées et non infectées) se nourrissent simultanément sur un même hôte immunocompétent contre le TBE. Les spécimens infectés transmettent le virus aux non infectés alors que l'animal parasité n'a pas de virémie[11] ,[15] (voir la section physiopathologie sur la multiplication locale du virus dans le derme).
Après son repas, qui peut durer plusieurs jours, la larve se laisse tomber et devient après métamorphose une nymphe à 8 pattes. Après un autre repas sanguin, 1 à 2 ans plus tard la tique atteint le stade adulte. Elle mesure alors quelques millimètres de longueur et peut escalader les buissons jusqu’à 80 cm de hauteur pour atteindre un animal plus gros (renard, gros gibier). Après ce nouveau repas sanguin, la tique s’accouple, pond des œufs et le cycle reprend.
Le virus se multiplie et diffuse dans la cavité générale puis dans tous les organes de la tique, y compris dans les glandes salivaires (transmission par morsure de tique) et dans les ovaires (transmission transovarienne de la femelle à sa descendance)[16], ce qui fait des tiques à la fois des vecteurs et des réservoirs.
Le virus reste inactif dans les tiques (qui ne développent pas de maladies), mais les tiques infectées le restent jusqu'à la fin de leur vie.
Autres espèces réservoirs
Plus d'une centaine d'espèces animales différentes (mammifères, reptiles et oiseaux) peuvent être infectées par le virus, mais pas toutes constituent un réservoir.
.jpg.webp)
Le réservoir principal (autre que les tiques elles-mêmes) sont les petits rongeurs. Chez eux, la virémie est de longue durée à des niveaux élevés. Les espèces de rongeurs les plus souvent citées sont le mulot à collier Apodemus flavicollis, le campagnol des bois Myodes glareolus, et d'autres appartenant à la famille des gliridae[11],[15].
Les gros mammifères et les oiseaux ont une virémie plus faible et de courte durée. Pour les gros mammifères, les espèces réservoirs sont surtout des cervidés sauvages (comme le chevreuil Capreolus capreolus) et pour les oiseaux des passereaux des forêts[11].
Ces grands mammifères et oiseaux jouent un rôle réservoir de virus moins important que les micromammifères, mais ils ont un rôle-clé dans l'écologie des tiques (phase d'accouplement et de ponte, maintien de la population de tiques), tout en assurant une dissémination à distance[16]. Une dissémination à très grande distance par oiseaux migrateurs parait improbable, car les tiques se détachent de leur hôte au bout de 5 à 9 jours[11].
Le virus est peu pathogène chez l'animal. De rares cas de maladie sévère ont été décrits chez le chien, le cheval, le singe, le mouton, la chèvre et le mouflon[11].
Lors de la virémie (multiplication des virus qui passent dans le sang), le passage peut se faire dans le lait chez les vaches, chèvres ou brebis infectées[16].
À la différence d'autres flavivirus transmis par les moustiques, les humains ne participent pas à la transmission du virus TBE (cycle naturel)[11]. L'humain est un hôte occasionnel qui constitue une impasse pour le cycle puisque dans ce cas la tique ne retourne généralement pas dans la nature après son repas de sang.
Transmission
Les deux périodes de transmission maximale du virus TBE sont la fin du printemps (mai-juin) et la fin de d'été (septembre-octobre), l'été chaud et sec est moins favorable aux tiques. Les cas d'encéphalite se retrouvent dans la population humaine exposée un mois plus tard[5].

Chez l’être humain, la tique remonte généralement le long des jambes pour atteindre une zone cutanée mince et humide, plus facile à piquer où elle se niche, l’ombilic, l’aisselle ou la racine des cheveux au niveau de la nuque. Après une période de 2 à 3 jours la tique commence son repas de sang qui dure 1 jour puis, repue de sang elle se laisse tomber au sol[17].
La transmission du virus se fait le plus souvent par injection de salive lors de la morsure de tiques infectées. Cette salive a aussi un effet anesthésiant, la piqûre est indolore, passant le plus souvent inaperçue[2]. Dans les zones endémiques à risque, la transmission du virus serait de l'ordre de 1 pour 200 morsures[5].
Une transmission alimentaire est possible par le lait et les produits laitiers non pasteurisés provenant d'animaux infectés (quelques cas humains décrits en Pologne, Slovaquie et Estonie)[15]. C'est ce qu'il s'est produit au printemps 2020 en France : une quarantaine de cas ont été recensés dans l'Ain, tous liés à l'ingestion de fromage de chèvre au lait cru issu d'un même producteur[18].
La transmission interhumaine, y compris sexuelle, n'a jamais été documentée. Elle reste théoriquement possible (par transfusion sanguine, par allaitement maternel…) mais n'a jamais été observée[10],[15]. Des transmissions à la suite de greffes d'organes contaminés ont été documentées[19].
La prévalence du virus chez les tiques varie selon les lieux et les périodes. En Autriche et dans le sud de l'Allemagne, 1 à 3 % des tiques sont porteuses du virus, et dans des zones locales très touchées de Lituanie, de Russie ou de Suisse, jusqu'à 10 à 30 % des tiques[10].
Risques après une morsure de tique
En Suisse, le risque de développer une encéphalite à tique après une morsure est inférieur à 1 pour 1000[20]. Après une morsure de tiques dans une région endémique, entre une personne sur 1 000 et une personne sur 5 000 développera une MEVE avec des symptômes neurologiques[20]. Chez la moitié des adultes et 75 % des enfants cette atteinte neurologique sera une méningite passagère[20].
Le risque d'être touchées sévèrement après une morsure de tique est donc de 1 sur 10 000 adultes et 1 sur 20 000 enfants après morsure de tique dans une région endémique[20]. Le risque d’une MEVE grave après une morsure de tique existe mais est rare[20].
Au regard de la rareté des cas sérieux, l'analyse PCR par un laboratoire, des tiques retirées d’un patient, pour mettre en évidence le virus MEVE ou les borrélia est ininterprétable et inutile[20].
Épidémiologie
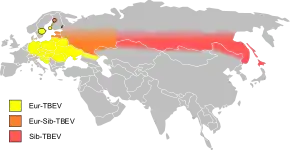
Le virus TBE se situe uniquement en Eurasie, dans les zones forestières non-tropicales, de l'Alsace-Lorraine jusqu'à l'île d'Hokkaidō au Japon. Cette répartition est inégale, elle se fait en foyers dispersés correspondant à des conditions optimales de vie des tiques et de leurs hôtes (petits rongeurs et grand gibier). Ce sont des zones à risques et des poches à forte incidence, dans et autour des forêts essentiellement.
Il n'existe pas de définition internationale de ces zones à risques, dont les déterminants exacts sont mal connus[10]. Ces foyers pourraient être régionaux (plusieurs km2 au moins) ou réductibles en zones locales (jusqu'à 500 m2)[11].
Le nombre de cas augmente dans la plupart des pays des pays européens[21], à l'exception de l’Autriche[22].
Incidence
L'encéphalite à tiques est la plus importante arbovirose européenne. La Russie et l'Europe rapportent autour de 10 000 cas annuels (de 5 000 à 13 000 selon les années[23]). Les incidences les plus élevées se trouvent dans l'Ex-URSS et les pays baltes (Lettonie surtout), représentant plus de la moitié des cas. Puis viennent ceux d'Europe centrale (Pologne, Tchéquie, Slovaquie, Hongrie, ex-Yougoslavie), l'Allemagne (Bavière, Bade-Wurtemberg surtout), l'Autriche et la Suisse[15]. 10 000 cas sont hospitalisés dans le monde chaque année et ce chiffre a tendance à augmenter[24]
Rapportés à la population générale, ces chiffres indiquent pour la fédération de Russie en 2006, une incidence moyenne nationale de 2,44 cas pour 100 000 habitants en moyenne, mais 5 fois plus en Sibérie, et jusqu'à 10 fois selon les zones de la Sibérie. En 2009, l'incidence était de 6,89 en Lituanie ; 7,50 en Lettonie ; 9,90 en Slovénie ; et 10,40 en Estonie[10].
En Chine, les données étaient mal connues, mais des publications récentes indiquent que, dans le nord de la Chine (province de Heilongjiang) l'incidence moyenne de la TBE est de 0,33 cas pour 100 000 habitants et par an (période 1980-1998), mais avec une zone hyperendémique (préfecture de Daxing'anling) de 88,6 cas pour 100 000 habitants et par an (période 1990-1998)[4].
En France, de 1990 à 2005, une quarantaine de cas ont été signalés dans les départements d'Alsace-Lorraine[15]. Depuis les années 2010, de 7 à 20 cas sont diagnostiqués chaque année[25],[26]. On note une incidence particulièrement élevée en 2020 (plus de quarante cas rien que dans l'Ain et pour les mois d'avril-mai), liée à des cas groupés d'encéphalite à tiques à la suite de l'ingestion de fromage ou de faisselle de lait de chèvre cru contaminé[18].
La maladie touchait d'abord des groupes à risques bien identifiés, professionnels ou semi-professionnels : travailleurs agricoles et forestiers, chasseurs, cueilleurs de baies et champignons de sous-bois. Avec le tourisme croissant en zone forestière (randonneurs, sports et activités de pleine nature...), la majorité des infections a lieu lors de loisirs, faisant de l'encéphalite à tiques « une maladie du voyageur »[15],[16].
Les continents américain et australien sont dépourvus de virus TBE. Quelques cas peuvent survenir lors de retours de voyage. Aux États-Unis, de 2000 à 2017, 8 cas de TBE ont été diagnostiqués au retour d'Europe ou de Chine[23].
Séroprévalence
Les études de séroprévalence indiquent qu'en Autriche et en Allemagne, 4 à 8% des personnes non vaccinées (en population générale) présentent des anticorps spécifiques, et ont été en contact avec le virus (immunisation naturelle)[15].
En France, chez les professionnels forestiers (non vaccinés) du Grand Est, cette prévalence était de 3,4 %, et chez les bûcherons de 17,5 %[27].
Physiopathologie
Après morsure de tique et inoculation par injection de salive infectée, le virus se multiplie localement une première fois dans les cellules dermiques, sur le site même de la morsure, puis diffuse dans les circulations sanguine et lymphatique. Les défenses immunitaires peuvent bloquer l'infection à ce stade[16].
Sinon, le virus envahit plusieurs organes et tissus, surtout du système réticulo-endothélial. Là, il se multiplie une nouvelle fois de façon massive, jusqu'à ce que la charge virale soit suffisante pour franchir la barrière hémato-méningée[2]. Après invasion des cellules endothéliales constituant cette barrière, le virus peut atteindre le système nerveux central, en particulier la substance grise. Il provoque une réaction inflammatoire avec prolifération des cellules gliales et nécrose tissulaire[2],[16].
Dans des conditions de laboratoire, le virus pourrait emprunter des filets nerveux pour atteindre le système nerveux central. Par exemple, lors d'infections en laboratoire par aérosols, via la muqueuse nasale et le nerf olfactif[2].
Dans les cas de dissémination digestive (par ingestion de lait cru contaminé) l'incubation est beaucoup plus courte (1 à 2 jours) que par morsure de tique[15].
Manifestations cliniques
Le tableau clinique de la TBE dépend de la virulence du virus et du statut du patient (âge, immunité, génétique…). La sévérité de la maladie varie selon le sous-type auquel appartient le virus[28],[29]. Le sous-type extrême-oriental est plus virulent que le sous-type européen. La gravité augmente avec l'âge : l'enfant présente des formes moins graves (méningite) que le sujet âgé de plus de 40 ans (encéphalite).
Dans les régions endémiques, il existe des formes asymptomatiques (sans symptômes) comme l'indiquent les études de séroprévalence.
Dans la moitié des cas la notion de piqûre de tique n’est pas retrouvée, elle n’a même pas été remarquée par la victime.
L'incubation dure le plus souvent de 7 à 14 jours (extrêmes 2 et 28 jours) après la morsure de tique. C'est une phase silencieuse où le virus se multiplie localement.
TBE européenne
Le cours typique de la maladie provoquée par le sous-type européen est biphasique. Après une période d’incubation d’environ une semaine débute la phase virémique qui dure un à dix jours, suivie d'une phase asymptomatique de sept à dix jours et enfin, chez environ un tiers des patients, apparaissent les premières manifestations d’atteinte neurologique[28].
Phase virémique
La première phase clinique est virémique, correspondant au passage du virus dans la circulation générale. Chez un nombre estimé de 10 à 30 % des personnes infectées[20] l'infection se manifeste par des signes non spécifiques de type syndrome grippal (fatigue, maux de tête, courbatures, malaises, fièvre à 38 °C et plus) et troubles digestifs. Elle dure de 1 à 10 jours.
C'est le seul stade où le virus est détectable dans le sang. Dans deux tiers des cas environ, l'infection se termine là, jugulée par le système immunitaire
Intervalle libre
Dans près de 35 % des cas, le patient n'est pas spontanément guéri. Le virus entame une nouvelle phase de duplication dans les différents tissus et organes qu'il a pu atteindre. Cette phase dure en moyenne une semaine, c'est aussi de phase de rémission asymptomatique, où le patient ne présente plus de symptômes.
Phase neurologique
Elle est marquée par le passage du virus dans le système nerveux central. Elle se traduit par une reprise fébrile plus intense que lors de la phase virémique[28].
La forme la plus fréquente (50 % des cas touchés par la phase neurologique) se manifeste comme une méningite virale à liquide clair (surtout chez l'enfant). Dans 40 % des cas touchés par la phase neurologique, comme une méningo-encéphalite incluant des troubles tels que syndrome pyramidal, syndrome cérébelleux, atteintes des nerfs crâniens. La moitié des patients adultes développe une encéphalite[30]. En règle générale, dans la TBE européenne, l'évolution de ces deux formes est favorable.
Plus rarement, dans environ 10 % des cas touchés par la phase neurologique soit 3 % du total[28],[31], la maladie se manifeste aussi comme une myélite (méningoencéphalomyélite) qui comporte en plus une paralysie flasque du membre supérieur, notamment des muscles de l'épaule (ceinture scapulaire) avec un risque de séquelle élevé[2].
La maladie dure de quelques jours à plusieurs semaines.
La guérison est sans séquelle dans 90 % des cas. 1 à 2 % environ des patients meurent à ce stade et 10 à 20 % des victimes présentent des séquelles neurologiques permanentes. Un tiers des patients présentent des troubles résiduels plusieurs années après la maladie (céphalées, troubles sensitifs ou neurovégétatifs... réalisant un syndrome post encéphalitique)[32].
Les cas de décès par complications neurologiques s'observent chez les malades âgés de plus de 60 ans.
TBE non européennes
Le sous-type d'extrême-orient se caractérise par une phase d'un seul tenant (phase virémique silencieuse) évoluant rapidement vers une atteinte neurologique, parfois avec fièvre hémorragique. Le taux de létalité s’élève à 20 %, et jusqu’à 60 % des survivants présentent des séquelles neurologiques résiduelles.
Le sous-type sibérien est de gravité intermédiaire entre l'européen et l'extrême-oriental, avec un taux de létalité de 6% à 8%. Il se caractérise par des formes chroniques plus fréquentes.
Les causes de ces différences sont mal connues et discutées : liées au sous-type de virus et à sa virulence, susceptibilité génétique des malades, mais aussi différences de critères pour la sélection des patients étudiés (pas de consensus international), accès aux services médicaux, différences d'exposition selon l'âge[32].
Conséquence à long terme
Trois évolutions cliniques peuvent être identifiées. Chez environ un quart des patients il est observé une guérison complète en 2 mois. Chez les autres patients, il est observé soit une dysfonction prolongée, principalement cognitive soit une paralysie persistante du nerf spinal avec ou sans autres symptômes post-encéphaliques. Jusqu'à 46 % des patients présentent ainsi des séquelles permanentes. Les séquelles les plus souvent signalées étant diverses affections cognitives ou neuropsychiatriques, des troubles de l'équilibre, des céphalées, une dysphasie, des troubles auditifs et une paralysie de la colonne vertébrale[33].
En Suisse, les moins de 16 ans ont des symptômes moins sévères que chez l’adulte et plus rarement des séquelles (0.5% contre 5% des malades)[20].
Diagnostic
Les signes cliniques n'étant pas spécifiques, le diagnostic d'encéphalite à tique est un diagnostic biologique de laboratoire.
À la phase initiale, virémique, de la maladie, le virus est détectable dans l'hémoculture. Lors de la phase neurologique, le virus peut être isolé à partir du liquide cérébrospinal (LCS)
La mise en culture est difficile, et réservée à des laboratoires spécialisés. Elle tend à être remplacée par la réaction en chaîne par polymérase (PCR).
Les anticorps anti-TBEV sont détectables au début de la phase neurologique. La recherche d’IgM anti-TBE, effectuée par méthode Elisa, s'effectue dans le sérum et le LCS ; elle permet de faire la différence entre une infection en cours et la trace sérologique d’une infection ancienne passée inaperçue (IgG).
Traitement
Il n'existe pas de traitement antiviral spécifique, le traitement est symptomatique. En règle générale, les patients sont hospitalisés sans être isolés (absence de transmission inter-humaine)[15]. Un traitement de soutien ainsi que des soins intensifs et une ventilation assistée dans les formes graves peuvent être nécessaires[34].
Les patients reçoivent des soins de réanimation basés sur la gravité des manifestations : antalgiques, antipyrétiques (aspirine et AINS ne sont pas recommandés[35]), vitamines, hydratation et électrolytes ; si nécessaire, antiémétiques, anticonvulsivants[15],[36].
Dans les formes graves avec paralysie des muscles respiratoires, ou en cas d'œdème cérébral, on applique le traitement correspondant à la complication. Par exemple intubation et ventilation assistée pour la paralysie respiratoire[36].
Les traitements post-exposition par immunoglobulines spécifiques ont été abandonnés au début des années 2000, à cause d'effets secondaires[37], mais elles se poursuivent en Fédération de Russie qui signale un certain effet protecteur[38].
Dans certaines régions endémiques, comme la Lituanie, les patients atteints reçoivent des fortes doses de corticostéroïdes[39]. Ce traitement se base sur des expériences cliniques avec des améliorations rapides de l'état des patients[39]. Cependant, les études rétrospectives existantes n'ont pas réussi à montrer les effets bénéfiques des corticostéroïdes par rapport au traitement symptomatique[39].
Les patients atteints de maladies rhumatismales traités par le rituximab seraient à risque et le vaccin serait inefficace[40].
Prophylaxie

Dans les régions endémiques, la prévention repose sur la pasteurisation du lait et selon le niveau de risques, sur la vaccination.
Pour éviter les morsures et l'infection par les tiques, les experts conseillent les précautions suivantes :
- éviter les zones infestées par les tiques particulièrement pendant les mois les plus chauds ;
- porter des vêtements de couleur claire pour que les tiques soient plus facilement visibles. Porter une chemise longue, un chapeau, un pantalon long, et remonter les chaussettes par-dessus les jambes du pantalon ;
- marcher au centre des sentiers pour éviter l'herbe et les buissons ;
- vérifier régulièrement au bout de quelques heures l’absence de tiques sur votre corps quand vous passez beaucoup de temps dehors dans des zones infestées par les tiques. Les tiques sont trouvées le plus souvent sur les cuisses, les bras, les aisselles et les jambes. Les tiques peuvent être très petites (pas plus grosses qu'une tête d'épingle). Inspecter soigneusement toute nouvelle « tache de rousseur » ;
- utiliser un répulsif d'insecte contenant du DEET sur votre peau ou de la perméthrine sur les vêtements ;
- extraire immédiatement les tiques accrochées à la peau.
Les tiques devraient être enlevés rapidement et soigneusement avec des pinces brucelles et en appliquant une traction régulière et douce. le corps de la tique ne devrait pas être écrasé au moment de l’extraction et les brucelles devraient être placées aussi près de la peau que possible pour éviter de laisser des morceaux du rostre de la tique dans la peau. Les tiques ne devraient pas être extraites à main nue. Des mains devraient être protégées par des gants et/ou une étoffe et être soigneusement lavées à l'eau et au savon et après l’opération. Cette manœuvre devrait être exécutée avec le plus grand soin.
Il existe également des crochets spécifiques (tire-tique) disponibles en pharmacie et permettant de retirer les tiques facilement, sans laisser le rostre.
Recherche
Un étude de 2017 a montré que chez des souris infectées par le virus de l'encéphalite à tiques, il était possible d'obtenir une protection de 90 % avec l'injection d'une forte dose d'immunoglobuline intraveineuse contenant des titres plus élevés d'anticorps spécifiques au virus mais qu'aucun effet immunothérapeutique n'était observable chez les souris traitées avec une dose d'immunoglobuline sans anticorps spécifiques au virus[41]. Cette étude suggère que l'injection d'une forte dose d'immunoglobuline intraveineuse contenant des titres élevés d'anticorps spécifiques au virus pourraient représenter une prophylaxie post-exposition ou un traitement efficace de première ligne des patients atteints d'une forme grave de virus de l'encéphalite à tiques[41].
L'injection d'anticorps monoclonaux dirigés contre le virus de l'encéphalite à tiques chez des souris s'est révélé efficace en particulier en injection prophylactique mais aussi avec une injection un jour après l'infection[42].
Vaccination
Vaccins historiques
Dès 1937, quelques mois après l'identification en Sibérie du virus de la « Spring-summer encephalitis » (encéphalite verno-estivale), un vaccin militaire est aussitôt mis au point pour les besoins de l'Armée rouge. C'est le premier vaccin (en utilisation de masse) contre un flavivirus, et le troisième vaccin contre une maladie virale[43].
Ce vaccin était obtenu à partir d'une suspension virale (culture sur cerveau de souris) inactivée par formaldéhyde. Ce vaccin s'avère efficace, mais avec un taux élevé de complications allergiques, tenant à la présence de myéline dans la préparation. Avec l'apparition des cultures cellulaires, les soviétiques produisent d'autres vaccins à partir de virus cultivés sur cellules d'embryon de poulet. Le problème des effets secondaires est réduit, mais pas résolu pour autant[43].
Le premier vaccin chinois, analogue au soviétique, est disponible en 1953 pour les travailleurs forestiers du nord-est de la Chine[4].
Les premières recherches vaccinales contre le sous-type européen débutent dans les années 1960 en Tchécoslovaquie[43].
Dans les années 1970, une coopération entre instituts autrichien et britannique permet de développer un vaccin inactivé destiné à être produit commercialement en grande quantité. Ce vaccin se fait aussi à partir de cultures cellulaires d'embryon de poulet, mais hautement purifiées selon des méthodes introduites en 1979[43].
Depuis 1981, l'Autriche propose une vaccination de masse contre l'encéphalite à tiques (non obligatoire mais recommandée chaque printemps aux enfants de plus de deux ans)[44],[45].
En 1999-2001, ce vaccin autrichien subit plusieurs modifications, entre autres pour répondre aux nouvelles recommandations européennes portant sur le retrait du thiomersal des vaccins[43].
Vaccins actuels
Dans les années 2010, quatre vaccins sont reconnus de qualité et homologués par l'OMS. Ils ont en commun d'être produits sur des cellules ou fibroblastes d’embryons de poulet, inactivés au formaldéhyde et d'utiliser l'hydroxyde d’aluminium comme adjuvant[46].
Deux sont européens : le vaccin autrichien commercialisé sous le nom de FSME-Immun (homologué à l'origine en 1976 sous le nom de Ticovac) et le vaccin allemand sous le nom d' Encepur (homologué en 1994). Ces vaccins ont une formulation pédiatrique (enfant de plus de 1 ans) et sont préparés à partir de souches européennes du virus[47].
Les deux autres sont russes : le vaccin TBE-Moscow et le vaccin EnceVir, préparés à partir de souches extrême-orientales.
Selon l'OMS, ces quatre vaccins sont sûrs et efficaces, les vaccins russes disposant de moins de données en étant contre-indiqués pour les enfants de moins de 3 ans. Ils sont interchangeables car ils confèrent apparemment une protection croisée contre tous les sous-types viraux en circulation[47].
Il existe également un vaccin chinois de deuxième génération (mis au point en 2004, sur culture cellulaire de rein de hamster) utilisé dans les zones frontalières du nord de la Chine[4].
Recommandations
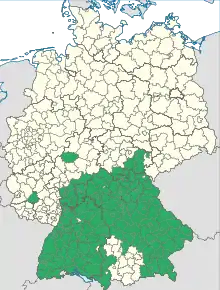
Les recommandations de l'OMS reposent sur la nécessaire connaissance préalable de la maladie (surveillance, évaluation des risques, rapport coût efficacité...). En fonction de ces données, dans les pays de forte endémie (période prévaccinale), d'au moins 5 cas pour 100 000 habitants par an, la vaccination généralisée est recommandée. Dans les pays à risque modéré ou faible, la vaccination est recommandée pour les groupes à risques, ou au cas par cas[47].
Dans tous les cas, en zone d'endémie, les informations relatives à la maladie, vecteurs et modes de transmission, prévention… doivent être facilement disponibles au public.
En 2008, près de 80 millions de doses vaccinales ont été utilisées en Europe depuis 1980. Aux Amériques, les deux vaccins européens ne sont disponibles qu'au Canada (qui les propose comme vaccins du voyageur[44]). L'Autriche est le seul pays à vacciner systématiquement contre l'encéphalite à tiques depuis 1981, avec un taux de couverture vaccinale de 88% de la population générale en 2005[45].
Pour les autres pays européens, les recommandations varient selon la situation épidémiologique et l'évaluation des risques au niveau régional/national. Elles sont susceptibles d'évoluer selon les changements de situation[48].
En Suisse, la vaccination contre le TBE est recommandée en situation à risques, dès l'âge de 6 ans, dans tous les cantons, sauf ceux de Genève et du Tessin[49].
En France, compte tenu de la relative rareté de la maladie, la vaccination généralisée (dans les départements les plus à risques) n'est pas recommandée. L'indication du vaccin se fait au cas par cas, chez les personnes à risques (travailleurs agricoles et forestiers, chasseurs, randonneurs…). Pour les voyageurs, il est recommandé pour les touristes en zone forestière, jusqu'à 1 500 m d'altitude, d'Europe centrale et de l'Est, Scandinavie, Chine du Nord, Corée du sud, Japon, Kirghizstan, Mongolie, Russie orientale[50], pendant la saison des tiques (février à novembre)[51].
En région de forte endémie, en zone forestière et durant la saison de forte transmission, le risque du voyageur non vacciné de contracter la maladie est estimé à 1 sur dix mille et par mois. Le risque devient négligeable si l'on reste en zone urbaine ou non-forestière et sans consommer de produits laitiers crus[23].
Facteurs d'émergence
Le nombre de cas augmente dans la plupart des pays des pays européens[52], à l'exception de l’Autriche[53]. De 1974 à 2003, l'incidence a été multipliée par 10 en Allemagne, et par 5 en Lituanie[54]. Différents facteurs (biotiques et abiotiques) peuvent expliquer l'émergence et/ou la propagation récente de l'encéphalite à tiques à travers l'Europe.
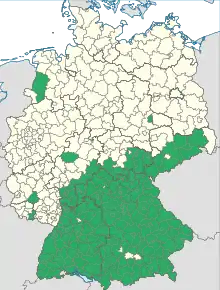
L'extension parait se faire vers le nord et en altitude, selon les conditions changeantes de température et d'hygrométrie favorables aux populations de tiques. Celles-ci se développent au mieux à une température de plus de 7 °C avec une humidité relative de l'air de plus de 80%. Ces conditions se retrouvent principalement en microfoyers dans des forêts et prairies en période de pluies[11].
L'augmentation rapide détectée depuis la fin du XXe siècle correspond en partie à une meilleure surveillance et de meilleurs diagnostics, mais aussi, semble-t-il en raison de changements environnementaux (réchauffement climatique et écopaysager : fragmentation du paysage, espèces introduites ou invasives, diffusion de parasites par déplacement croissant des humains et des espèces, etc.)[11].
Réchauffement climatique
Une étude suédoise, publiée en 2001, a montré une corrélation entre un climat plus doux et une augmentation des cas de TBE. Sur 30 ans, plus le climat avait été doux, plus les tiques avaient été nombreuses et plus ces encéphalites avaient également été nombreuses. Dans le comté de Stockholm, l'incidence de cette maladie a considérablement augmenté (triplement) depuis le milieu des années 1980 avec un pic en 1994 (triplement du nombre de cas humains). Les chercheurs ont intégré d'autres facteurs d'influence (dont l'augmentation de la population vivant (en chalet d'été) dans les régions où les tiques et la maladie sont aujourd'hui endémiques, et augmentation des populations animales vectrices de tiques et/ou du microbe (facteur pour partie lié au climat). L'accès à la vaccination contre l'encéphalite à Tique en Suède (depuis 1986) et une sensibilisation accrue aux risques posés par les tiques pourraient même avoir fait encore sous-estimer ces liens de cause à effet[55].
Facteurs sociaux et comportementaux
Selon une étude des pays baltes, le réchauffement climatique ne peut cependant pas expliquer à lui seul l'augmentation des cas de TBE. Des paramètres socio-économiques (modifications économiques et des comportements après la chute de l'URSS) pourraient être aussi en cause[56].
De façon générale, les facteurs sociaux mentionnés sont le déplacement de populations pour des habitats sub-urbains (en lisère de forêts), nouveaux modes de loisirs en forêts, modification des pratiques agricoles, reboisement[15].
Écologies du paysage et des populations

Une étude réalisée dans les Alpes italiennes (province de Trente[57]) a porté sur d'éventuelles corrélations entre l'augmentation des cas humains de TBE, les variables climatiques et de structure de la forêt, l'abondance des tiques et de leurs hôtes. Le meilleur modèle explicatif de l'augmentation de l'incidence de la maladie chez l'homme est celui qui intègre les changements dans la structure forestière et en particulier le ratio taillis/hauteur des forêts et les changements de densité dans la population de chevreuils (Capreolus capreolus).
Les pratiques de gestion de la faune chassable (agrainage du gibier, piégeage ou chasse des prédateurs et grands prédateurs naturels) ont fortement favorisé les espèces-réservoirs du virus (rongeurs et chevreuils).
Selon une étude suédoise[58], l'augmentation des cas humains semble corrélée avec l'abondance de la tique Ixodes ricinus au stade larvaire, qui s'infectent chez les rongeurs avant de s'alimenter sur les cervidés, comme le chevreuil. Le nombre de chevreuils n'a pas cessé de croître durant des décennies en Suède avant de peu à peu diminuer des années 1990 à 2010, imposant sans doute aux tiques de se nourrir sur des rongeurs qui sont des meilleurs réservoirs pour le virus de l'encéphalite TBEV, ce qui a probablement augmenté le nombre de tiques adultes infectées et vectrices de la maladie.
Les 2 hivers 2009 et 2011 ont été très froids, ce qui a fait chuter le nombre de chevreuils et a probablement réorienté les tiques en quête de repas vers les campagnols roussâtres (Myodes glareolus) qui avaient à l'époque soudainement proliféré, plutôt que sur le chevreuil. L'année 2011 a été très chaude, ce qui a encouragé les gens à être plus souvent et plus longtemps dans les zones infestées, ce qui pourrait expliquer au moins 284 cas humains d'encéphalite dans le pays, phénomène qui pourrait durer en raison d'une saison des tiques de 2012 anormalement précoce et chaude.
Adaptation des tiques aux biocides
De plus, comme de nombreux autres organismes face aux biocides, les tiques ont montré une capacité de résistance aux acaricides[59], forçant les éleveurs et les producteurs d'antiparasitaires à rechercher de nouvelles molécules pesticides[60] ce qui est coûteux[61]. Des stratégies alternatives sont recherchées[62],[63]. L'usage massif d'insecticides ou acaricides sur les animaux domestiques et d'élevage pourrait aussi contribuer à renforcer la capacité des tiques à déjouer cette barrière.
Bibliographie
- Xavier Haller, Méningoencéphalites à tiques (thèse d'exercice de docteur en médecine), Strasbourg, Université Louis Pasteur, (lire en ligne).
- (en) Stanley A. Plotkin (dir.) et P. Noel Barrett, Vaccines, Philadelphie, Saunders Elsevier, , 1725 p. (ISBN 978-1-4160-3611-1, lire en ligne), chap. 32 (« Tick-borne encephalitis virus vaccines »), p. 841-856.
- OMS, « Note de synthèse : position de l’oms sur les vaccins contre l’encéphalite à tiques », Relevé épidémiologique hebdomadaire, vol. 86, no 24, , p. 241-256. (lire en ligne).
- Philibert Mougel, La méningo-encéphalite à tiques (thèse d'exercice de docteur en pharmacie), Nancy, Université Henri Poincaré Nancy 1, (lire en ligne).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Tick-borne encephalitis » (voir la liste des auteurs).
- (en) Kaiser R, « Tick-borne encephalitis », Infect. Dis. Clin. North Am., vol. 22, no 3, , p. 561–75, x (PMID 18755391, DOI 10.1016/j.idc.2008.03.013, lire en ligne)
- Stanley A. Plotkin 2008, p. 841-842.
- Xavier Haller 1992, p. 15-17.
- Kentaro Yoshii, Joon Young Song, Seong-Beom Park et Junfeng Yang, « Tick-borne encephalitis in Japan, Republic of Korea and China », Emerging Microbes & Infections, vol. 6, no 9, , e82 (ISSN 2222-1751, PMID 28928417, PMCID 5625319, DOI 10.1038/emi.2017.69, lire en ligne, consulté le )
- Eric Menot, « Encéphalite à tique d'Europe centrale », La Revue du Praticien - Médecine générale, vol. 9, no 319, , p. 42-46.
- Jean-Louis Camicas, « Tiques et arbovirus », Cahiers ORSTOM Entomologie médicale et parasitologie, vol. 16, no 2, , p. 166-167 (lire en ligne)
- Charrel, RN; Attoui, H; Butenko, AM; Clegg, JC; Deubel, V, et al. Tick-borne virus diseases of human interest in Europe. Clinical microbiology and infection. 2004;10:1040–1055. [PubMed]
- Gritsun, TS; Nuttall, PA; Gould, E. Tick-borne flaviviruses. Advances in Virus research. 2003;61:317–371. PubMed
- Gérard Duvallet, Entomologie médicale et vétérinaire, Quae - IRD, (ISBN 978-2-7099-2376-7), p. 580-582.
- OMS 2011, p. 242-243.
- (en) Anna Michelitsch, Kerstin Wernike, Christine Klaus et Gerhard Dobler, « Exploring the Reservoir Hosts of Tick-Borne Encephalitis Virus », Viruses, vol. 11, no 7, (PMID 31336624, DOI 10.3390/v11070669, lire en ligne, consulté le )
- OMS 2011, p. 244-245.
- OMS 2011, p. 253.
- (en) Jarmo Oksi, Derrick Crook et Uga Dumpis, « Tick-Borne Encephalitis », Clinical Infectious Diseases, vol. 28, no 4, , p. 882–890 (ISSN 1058-4838, DOI 10.1086/515195, lire en ligne, consulté le )
- Stanley A. Plotkin 2008, p. 843-844.
- Patrice Bourée, « Encéphalites à tiques », La Revue du Praticien - Médecine générale, vol. 21, no 790, , p. 1152-1153.
- Thomas Krech, « Méningo-encéphalite verno-estivale », Forum Médical Suisse, no 6, , p. 268-274 (lire en ligne)
- « Foyer de cas d’encéphalite à tiques liés à la consommation de fromage de chèvre au lait cru dans l’Ain. Point au 19 juin 2020. », sur www.santepubliquefrance.fr (consulté le )
- (en) Dariusz Lipowski, Marta Popiel, Karol Perlejewski et Shota Nakamura, « A Cluster of Fatal Tick-borne Encephalitis Virus Infection in Organ Transplant Setting », The Journal of Infectious Diseases, vol. 215, no 6, , p. 896–901 (ISSN 0022-1899, DOI 10.1093/infdis/jix040, lire en ligne, consulté le )
- Prof. Dr. med. Christoph Berger, « Morsures de tiques, méningo-encéphalite verno-estivale et vaccination de l’enfant contre l’encéphalite à tiques », Universitäts-Kinderklinike Formation continue, vol. 22, no 1, (lire en ligne)
- (en) Suss J, « Tick-borne encephalitis in Europe and beyond--the epidemiological situation as of 2007 », Euro Surveill., vol. 13, no 26, (PMID 18761916, lire en ligne)
- (en) Kunze U, « Tick-borne encephalitis: from epidemiology to vaccination recommendations in 2007. New issues--best practices », Wien Med Wochenschr, vol. 157, nos 9-10, , p. 228–32 (PMID 17564770, DOI 10.1007/s10354-007-0424-8, lire en ligne)
- « Tickborne Encephalitis - Chapter 4 - 2020 Yellow Book | Travelers' Health | CDC », sur wwwnc.cdc.gov (consulté le )
- J. Gaudelus, « Méningo-encéphalite à tiques chez l’enfant », Archives de Pédiatrie, zoonoses en pédiatrie : Quoi de neuf en 2008 ? 24es Journées annuelles du Groupe de Pathologie Infectieuse Pédiatrique, vol. 16, , S108–S114 (ISSN 0929-693X, DOI 10.1016/S0929-693X(09)75312-6, lire en ligne, consulté le )
- (en) « Encéphalite à tiques », sur www.santepubliquefrance.fr (consulté le )
- « Maladies vectorielles à tiques en France », sur has-sante.fr,
- « Séroprévalence de la borréliose de Lyme et de l'encéphalite à tiques chez des professionnels exposés dans le grand Est », sur santepubliquefrance.fr (consulté le )
- Netgen, « Encéphalite à tiques : premier cas autochtone et surveillance épidémiologique dans le canton du Valais », sur Revue Médicale Suisse (consulté le )
- (en) Gritsun Ts et Lashkevich Va, « Tick-borne Encephalitis », sur Antiviral research, 2003 jan (PMID 12615309, consulté le )
- (en) Lindquist L et Vapalahti O, « Tick-borne Encephalitis », sur Lancet (London, England), (PMID 18514730, consulté le )
- (en) Kaiser R, « The Clinical and Epidemiological Profile of Tick-Borne Encephalitis in Southern Germany 1994-98: A Prospective Study of 656 Patients », sur Brain : a journal of neurology, 1999 nov (PMID 10545392, consulté le )
- OMS 2011, p. 244-245.
- (en) Haglund M et Günther G, « Tick-borne Encephalitis--Pathogenesis, Clinical Course and Long-Term Follow-Up », sur Vaccine, (PMID 12628810, consulté le )
- (en) Niccolò Riccardi, Roberta Maria Antonello, Roberto Luzzati et Joanna Zajkowska, « Tick-borne encephalitis in Europe: a brief update on epidemiology, diagnosis, prevention, and treatment », European Journal of Internal Medicine, vol. 62, , p. 1–6 (ISSN 0953-6205, DOI 10.1016/j.ejim.2019.01.004, lire en ligne, consulté le )
- CMIT, E. Pilly Maladies Infectieuses et Tropicales 2018, Paris, Alinéa Plus, , 720 p. (ISBN 978-2-916641-66-9), chap. 100 (« Arboviroses »), p. 493.
- Petra Bogovic et Franc Strle, « Tick-borne encephalitis: A review of epidemiology, clinical characteristics, and management », World Journal of Clinical Cases : WJCC, vol. 3, no 5, , p. 430–441 (ISSN 2307-8960, PMID 25984517, PMCID 4419106, DOI 10.12998/wjcc.v3.i5.430, lire en ligne, consulté le )
- (en) J.F. Valarcher, « Tick borne encephalitis », Revue Scientifique et Technique de l'Office International des Epizooties, vol. 34, no 2, , p. 453-466. (lire en ligne)
- OMS 2011, p. 254 et 256.
- (en) Wengse C et Ericsson J, « [Rapid Improvement of Tick-Borne Encephalitis After Treatment With Corticosteroids] », sur Lakartidningen, (PMID 28632298, consulté le )
- (en) Ann Knight, Karlis Pauksens, Gunnel Nordmark et Eva Kumlien, « Fatal outcome of tick-borne encephalitis in two patients with rheumatic disease treated with rituximab », Rheumatology, vol. 56, no 5, , p. 855–856 (ISSN 1462-0324, DOI 10.1093/rheumatology/kew495, lire en ligne, consulté le )
- (en) Jana Elsterova, Martin Palus, Jana Sirmarova et Jan Kopecky, « Tick-borne encephalitis virus neutralization by high dose intravenous immunoglobulin », Ticks and Tick-borne Diseases, vol. 8, no 2, , p. 253–258 (ISSN 1877-959X, DOI 10.1016/j.ttbdis.2016.11.007, lire en ligne, consulté le )
- (en) Andrey Matveev, Leonid Matveev, Oleg Stronin et Ivan Baykov, « Characterization of neutralizing monoclonal antibody against tick-borne encephalitis virus in vivo », Vaccine, vol. 38, no 27, , p. 4309–4315 (ISSN 0264-410X, DOI 10.1016/j.vaccine.2020.04.051, lire en ligne, consulté le )
- Stanley A. Plotkin 2008, p. 845-846.
- « Déclaration sur l'encéphalite à tiques », sur Agence de santé publique du Canada, Relevé des maladies transmissibles au Canada, (consulté le )
- Stanley A. Plotkin 2008, p. 852.
- OMS 2011, p. 246 et 250.
- OMS 2011, p. 254-255.
- « Vaccination contre l'encéphalite à tiques », sur health.belgium.be, (consulté le )
- Office fédéral de la santé publique OFSP, « Méningo-encéphalite à tiques (FSME) », sur www.bag.admin.ch (consulté le )
- « Encéphalite à tiques », sur vaccination-info-service.fr (consulté le )
- France info — Les tiques sont (déjà) de retour : ce qui fonctionne pour éviter les piqûres
- (en) Suss J, « Tick-borne encephalitis in Europe and beyond--the epidemiological situation as of 2007 », Euro Surveill., vol. 13, no 26, (PMID 18761916, lire en ligne)
- (en) Kunze U, « Tick-borne encephalitis: from epidemiology to vaccination recommendations in 2007. New issues--best practices », Wien Med Wochenschr, vol. 157, nos 9-10, , p. 228–32 (PMID 17564770, DOI 10.1007/s10354-007-0424-8, lire en ligne)
- Stanley A. Plotkin 2008, p. 843-844.
- E. Lindgren et R. Gustafson, « Tick-borne encephalitis in Sweden and climate change », Lancet (London, England), vol. 358, no 9275, , p. 16–18 (ISSN 0140-6736, PMID 11454371, DOI 10.1016/S0140-6736(00)05250-8, lire en ligne, consulté le )
- Dana Sumilo, Loreta Asokliene, Antra Bormane et Veera Vasilenko, « Climate Change Cannot Explain the Upsurge of Tick-Borne Encephalitis in the Baltics », PLoS ONE, vol. 2, no 6, (ISSN 1932-6203, PMID 17551580, PMCID 1876807, DOI 10.1371/journal.pone.0000500, lire en ligne, consulté le )
- G. CARPI, F. CAGNACCI, M. NETELER et A. RIZZOLI, « Tick infestation on roe deer in relation to geographic and remotely sensed climatic variables in a tick-borne encephalitis endemic area », Epidemiology and Infection, vol. 136, no 10, , p. 1416–1424 (ISSN 0950-2688, PMID 18081949, PMCID 2870723, DOI 10.1017/S0950268807000039, lire en ligne, consulté le )
- Thomas GT Jaenson, Marika Hjertqvist, Tomas Bergström et Åke Lundkvist, « Why is tick-borne encephalitis increasing? A review of the key factors causing the increasing incidence of human TBE in Swedena », Parasites & Vectors, vol. 5, , p. 184 (ISSN 1756-3305, PMID 22937961, PMCID 3439267, DOI 10.1186/1756-3305-5-184, lire en ligne, consulté le )
- Jones K.E., Patel N.G., Levy M.A., Storeygard A., Balk D., Gittleman J.L. & Daszak P. 2008. Global trends in emerging infectious diseases. Nature, 451, 990-U4
- Frisch JE. 1999. Towards a permanent solution for controlling cattle ticks. Int. J. Parasitol. 29: 57-71.
- Chevillon C. et al. 2007. Accumulation of acaricide resistance mechanisms in Rhipicephalus microplus (Acari: Ixodidae) populations from New Caledonia island. Vet. Parasitol. 147: 276-288
- Ghosh S., Azhahianambi P. & Yadav M.P. 2007. Upcoming and future strategies of tick control: a review. Journal of Vector Borne Diseases, 44, 79-89
- Pegram, RG, Tatchell RJ, de Castro JJ, Chizyuka HGB, Creek MJ, McCosker PJ, Moran MC & Nigarura G. 1993. Tick control: new concepts. World Anim. Rev. 74/75: 2-11.
Voir aussi
Articles connexes
Liens externes
- France Lyme, Association de lutte contre les Maladies Vectorielles à Tiques.
- « Étude des 3 pathologies transmises par les tiques en Alsace », sur santepubliquefrance.fr (consulté le ).
- « Aide au diagnostic de fièvre post piqure de tique », sur infectiologie.com, .
- Portail de la virologie
- Portail des maladies infectieuses
- Portail des neurosciences