Nitrilotriacétonitrile
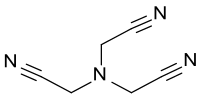
Le nitrilotriacétonitrile est un composé organique qui consiste en un atome d'azote substitué par trois groupes cyanométhyle. NTAN est un précurseur de l'acide nitrilotriacétique (NTA), un agent chélatant biodégradable et donc un adjuvant pour détergents, pour la tris(2-aminoéthyl)amine, un tripode tétradentate,connue sous l'abréviation tren comme un agent chélatant commun, et pour la réticulation de résine époxy aminoéthylpipérazine.
| Nitrilotriacétonitrile | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2-[bis(cyanométhyl)amino]acétonitrile[1] |
| Synonymes |
2,2',2"-nitrilotriacétonitrile; tri(cyanométhylène)amine; NTAN |
| No CAS | |
| No ECHA | 100.028.004 |
| No CE | 230-804-9 |
| PubChem | 81762 |
| SMILES | |
| InChI | |
| Apparence | solide mou mouillé d'une partie plus ou moins liquide, incolore[1],[2] |
| Propriétés chimiques | |
| Formule | C6H6N4 [Isomères] |
| Masse molaire[3] | 134,138 6 ± 0,006 g/mol C 53,72 %, H 4,51 %, N 41,77 %, |
| Propriétés physiques | |
| T° fusion | |
| Solubilité | eau : très soluble 6 g·l-1 à 20 °C[6], soluble in nitrométhane[4] et in acétone[5]. |
| Masse volumique | 1,295 9 g·cm-3 à 126 °C[7] |
| Point d’éclair | 211 °C[8] |
| Cristallographie | |
| Système cristallin | orthorhombique |
| Classe cristalline ou groupe d’espace | (no 62) [9] |
| Précautions | |
| SGH[8] | |
 |
|
| Écotoxicologie | |
| DL50 | 50 mg/kg (souris, oral)[10] 10 mg/kg (souris, i.p.)[10] 50 mg/kg (rat, oral)[10] 50 mg/kg (rat, i.p.)[10] > 1 g/kg (cochon d'Inde, c.)[10] > 2 g/kg (lapin, c.)[10] |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse et Propriété
La synthèse du nitrilotriacétonitrile commence à partir de l'ammoniac, le formaldéhyde et le cyanure d'hydrogène, comme blocs de base de construction, placés en milieu aqueux acide et en procédant soit de façon discontinue ou en continu. La triple cyanométhylation de l'ammoniac peut être menée de plusieurs manières[2],[4] :
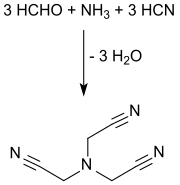
L'ammoniac sous forme gazeuse ou de l'hexaméthylènetétramine[11] ou du sulfate d'ammonium mélangé avec du formaldéhyde comme solvant (env. 37% en poids), est mélangé à une solution aqueuse de formaldéhyde à pH <2 puis traité, à 100 °C, avec une solution aqueuse d'acide cyanhydrique ou du cyanure d'hydrogène liquide, éventuellement sans purification du produit intermédiaire mais directement à partir du procédé Andrussow ou du procédé BMA d'Evonik Degussa[12]. Lorsque les eaux-mères sont recyclées, des rendements supérieurs à 90% sont atteints.
La tendance du NTAN à précipiter à des températures inférieures à 90 °C, qui peut conduire à un blocage des réacteurs et des conduites tubulaires et à une réaction d'emballement de la réaction, est particulièrement problématique dans les synthèses en continu[13].
Spectroscopie
En spectroscopie infrarouge, le nitrilotriacétonitrile présente un pic d'absorption très bien marqué à 981,25(5) cm−1[1]. Son spectre RMN 1H consiste en un unique singulet qui sort à 28,2 ± 0,2 ppm[1].
Structure
NTAN cristallise dans le système orthorhombique, groupe d'espace Pnma (no 62) avec comme paramètres de maille a = 710,85(1) pm, b = 993,20(2) pm et c = 938,69(2)[9].
Utilisation
Le nitrilotriacétonitrile est fondu en présence de catalyseurs basiques, comme du méthanolate de sodium ou de l'iminodiacétonitrile, NH(CH2CN)2 jusqu'à obtenir un solide polymérique de couleur foncé issu de leur co-polymérisation puis chauffé sous atmosphère inerte comme sous azote à des températures > 1 000 °C jusqu'à carbonisation[14]. Les produits résultants n'ont pas trouvé d'application en tant que polymères conducteurs.
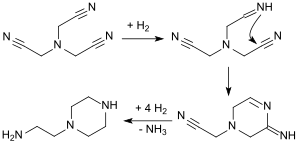
L'hydrogénation de NTAN convertit tout d'abord un groupe cyano en un groupe imino qui attaque plus rapidement un groupe cyano adjacent car il est alors stériquement bien placé pour former un système cyclique à six chaînons. Celui-ci est encore hydrogéné et produit le groupe amine primaire. Par conséquent, le produit final de l'hydrogénation catalytique du nitrilotriacétonitrile est la 1-(2-aminoéthyl)pipérazine :
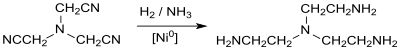
En revanche, réaliser l'hydrogénation catalytique de NTAN avec par exemple du nickel de Raney en présence d'un grand excès d'ammoniac, donne de la tris(2-aminoéthyl)amine (tren)[15] :
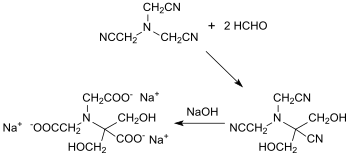
Le nitrilotriacétonitrile forme avec le formaldéhyde à pH 9,5 du 2,2-dihydroxyméthyl-nitrilotriacétonitrile, qui est hydrolysé avec une solution d'hydroxyde de sodium à 100 °C en sel trisodique de l'acide 2-hydroxyméthylsérine-N,N-diacétique transformé en l'acide par acidification avec un rendement global de 51%[16] :
Ce composé est utile en tant qu'agent complexant des ions de métaux lourds et des métaux alcalino-terreux, en tant que stabilisateur de blanchiment, par exemple, avec le perborate de sodium, dans des formulations détergentes solides et comme adjuvant dans des détergents pour empêcher la formation de dépôts (incrustations) dans les textiles des linges.
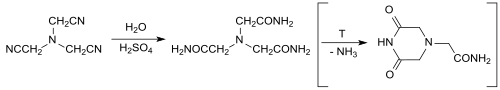
L'hydrolyse du nitrilotriacétonitrile avec de l'acide sulfurique concentré fournit dans des conditions douces du nitrilotriacétamide de façon quantitative , qui a été étudié comme ligand tétradenté neutre pour la complexation des métaux[17]. À haute température, il se forme par cyclisation du 3,5-dioxopipérazine-1-acétamide, qui peut être converti quantitativement en nitrilotriacétamide après neutralisation et en chauffant à nouveau avec un excès d'ammoniaque[18],[19] :
Le nitrilotriacétonitrile est principalement utilisé comme matière première pour la production par hydrolyse des groupes cyano, du biodégradable mais présumé cancérigène acide nitrilotriacétique, un agent complexant, par voie soit acide[20], soit basique[2],[21] :
Des niveaux résiduels d'ions cyanure dans l'hydrolysat peuvent apparaître par post-traitement avec des oxydants, tels que l'hypochlorite de sodium, et peuvent être éliminés à pH 8[20].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Nitrilotriacetonitril » (voir la liste des auteurs).
- PubChem CID 81762
- Brevet US 3337607 Process for preparation of an amine nitrile, J.C. Wollensak, Ethyl Corp., déposé le 25 janvier 1965, publié le 22 août 1967.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Brevet US 3840581 Process for the manufacture of nitrilotriacetonitrile, H. Neumaier, W. Vogt, K. Sennewald, R. Schuller, G. Lenz, Knapsack AG, dépose le 26 mai 1970-5-26, publié le 8 octobre 1974-10-8.
- M.D. Larranaga, R.J. Lewis, R.A. Lewis, Hawley’s Condensed Chemical Dictionary, 16e éd., Wiley, Hoboken, USA, 2016, p.974. (ISBN 978-1-118-13515-0).
- fiche Nitrilotriacetonitrile sur le site de l'ECHA (Agence européenne des produits chimiques).
- Carl L. Yaws, Thermophysical Properties of Chemicals and Hydrocarbons, 2e éd., Elsevier Inc., Oxford, Royaume-Uni,2014, p. 279. (ISBN 978-0-323-28659-6).
- (pdf) fiche MSDS Nitrilotriacetonitrile sur le site de Pfalts & Bauer (pfaltzandbauer.com).
- I.S.Bushmarinov, D.G.Golovanov, K.A.Lyssenko, Experimental Crystal Structure Determination, 2014, DOI:10.5517/cc11p2vn, CCDC 973581.
- (en) « Nitrilotriacétonitrile », sur ChemIDplus.
- Brevet US 3061628 Process and preparation of amino nitriles and acetic acids, J.J. Singer, Jr., M. Weisberg, Hampshire Chemical Corp. , déposé le 12 septembre 1958, publié le 30 novembre 1962
- Brevet 0102343B1 EP Process for producing nitrilotriacetonitrile, C.Y. Shen, Monsanto Co., déposé le 25 août 1983, publié le 26 février 1986.
- E. Fiedler, Emergency Runaway Reaction – What Precedes? What Follows? , Chem. Engineer. Transactions, 2016, chapitre 48, p. 361-366. (ISBN 978-88-95608-39-6), DOI:10.3303/CET1648061.
- Brevet US 3578643 New polymers from nitrilotriacetonitrile and iminodiacetonitrile, L.L. Wood, R.A. Hamilton, W.R. Grace & Co.,déposé le 6 juin 1969, publié le 11 mai 1971.
- Brevet US 3565957 Hydrogenation of nitrilotriacetonitrile, S.B. Mirviss, D.J. Martin, E.D. Weil, Stauffer Chemical Co., déposé le 20 septembre 1968, publié le 23 février 1971.
- G. Anderegg, V. Gramlich, 1:1 Metal Complexes of Bivalent Cobalt, Nickel, Copper, Zink, and Cadmium with the Tripodal Ligand tris[2-(dimethylamino)ethyl]amine: Their stabilities and the X-ray crystal structure of its copper(II) complex sulfate, Helv. Chim. Acta., 1994, vol.77(3), p. 685-690. DOI:10.1022/hlca.19940770312.
- D.A. Smith, S. Sucheck, S. Cramer, D. Baker, Nitrilotriacetamide: Synthesis in concentrated sulfuric acid and stability in water, Synth. Commun., 1995, vol. 25(24), p. 4123-4132. DOI:10.1080/00397919508011491.
- Brevet GB 1170399 A process for preparing 3,5-dioxo-1-piperazineacetamide and nitrilotriacetic acid triamide, W.R. Grace & Co., déposé le 12 juin 1968, publié le 12 novembre 1969.
- D.A. Smith, S. Cramer, S. Sucheck, E. Skrzypzak-Jankun, Facile synthesis of substituted nitrilotriacetamides, Tetrahedron Lett., 1992, vol. 33(50), p. 7765-7768. DOI:10.1016/0040-4039(93)88040-P.
- Brevet US 8362298B2 Hydrolyzed nitrilotriacetonitrile compositions, nitrilotriacetonitrile hydrolysis formulations and methods for making and using same, O.M. Falana, A. Hikem, S.R. Kakadjian, F. Zamora, Clearwater International, LLC, dépose le 20 mai 2011, publié le 29 janvier 2013.
- Brevet US 4547589 Hydrolysis of nitrilotriacetonitrile, C.Y. Shen, Monsanto Co., déposé le 3 janvier 1984, publié le 15 octobre 1985.
- Portail de la chimie