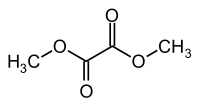
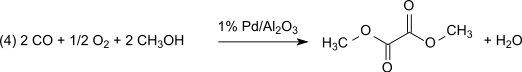Oxalate de diméthyle
L'oxalate de diméthyle (DMO) est un composé organique de la famille des oxalates, de formule (CH3O2C)2. C'est le diester de méthyle de l'acide oxalique. Il se présente sous la forme de cristaux incolores solubles dans l'eau.
| Oxalate de diméthyle | |
| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.008.231 |
| No CE | 209-053-6 |
| No RTECS | RO2850000 |
| PubChem | 11120 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores[1] |
| Propriétés chimiques | |
| Formule | C4H6O4 [Isomères] |
| Masse molaire[2] | 118,088 ± 0,004 8 g/mol C 40,68 %, H 5,12 %, O 54,19 %, |
| Propriétés physiques | |
| T° fusion | 50 à 54 °C[1] |
| T° ébullition | 163,5 °C[1] |
| Masse volumique | 1,148 g·cm-3 (25 °C)[1] |
| Point d’éclair | 75 °C (coupelle fermée)[1] |
| Propriétés optiques | |
| Indice de réfraction | = 1,39[1] |
| Précautions | |
| SGH[1] | |
 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
L'oxalate de diméthyle peut être obtenu par estérification de l'acide oxalique par le méthanol, en utilisant de l'acide sulfurique comme catalyseur :
Carbonylation oxydante
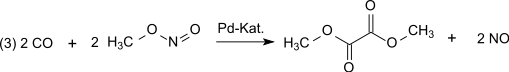
L'oxalate de diméthyle peut également être préparé par carbonylation oxydante à partir du méthanol et du monoxyde de carbone, une méthode qui présente l'intérêt de ne nécessiter que des réactifs de type C1[3] :
La réaction est catalysée par l'ion Pd2+[4],[5]. Les gaz utilisés dans cette synthèse sont en général produits à partir de charbon ou de biomasse ; cela fait de cette synthèse une réaction de choix pour convertir des molécules C1, extraites directement de matières premières, en molécule C2, dans des conditions relativement douces, avec un fort rendement.
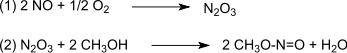
L'oxydation est faite par le trioxyde de diazote, lui-même formé à partir du monoxyde d'azote et du dioxygène (1), qui régit avec le méthanol pour former le nitrite de méthyle[6] (2) :
L'étape suivante est la réaction du monoxyde de carbone avec deux équivalents de nitrite de méthyle, formant l'oxalate de diméthyle en phase vapeur, à pression atmosphérique vers 80 à 120 °C, avec un catalyseur au palladium (3) :
Pour une équation-bilan globale :
Cette méthode et sans perte vis-à-vis du nitrite de méthyle qui agit en pratique comme porteur d'équivalents d'oxydation. Cependant, l'eau formée doit être évacuée pour empêcher l'hydrolyse de l'oxalate de diméthyle produit. Avec 1% de catalyseur Pd/α-Al2O3, l'oxalate de diméthyle est produit de façon sélective par dicarbonylation ; dans les mêmes conditions mais avec un 2% d'un catalyseur Pd/C , c'est le carbonate de diméthyle qui est produit par monocarbonylation:
Il est également possible de conduire la carbonylation oxydante du méthanol avec un haut rendement et une bonne sélectivité avec la 1,4-benzoquinone comme oxydant, en utilisant un système Pd(OAc)2/PPh3/benzoquinone avec un ratio de masse 1/3/100 à 65 °C et une pression de 70 atm de CO[5] :
Utilisations
L'oxalate de diméthyle est utilisé comme agent de méthylation[7] et dans l'industrie cosmétique comme chélateur[8].
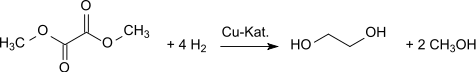
Pour des pays pauvres en pétrole mais avec de grandes réserves de charbon – voire à l'avenir, de biomasse – (c'est-à-dire des pays ayant un fort potentiel de développement chimique à partir de gaz de synthèse, comme la Chine), la carbonylation oxydante du méthanol se pose comme une approche prometteuse pour la synthèse de composés C2 de base comme l'éthylène glycol[9], l'oxalate de diméthyle pouvant être converti en éthylène glycol avec de hauts rendements (94,7%[10]) par hydrogénation avec des catalyseurs au cuivre[11] :
Le méthanol formé peut même être recyclé dans le procédé de carbonylation oxydante ; ainsi, au global, les seules matières premières consommées sont le monoxyde de carbone, le dihydrogène et le dioxygène.
La Chine s'est ainsi lancée au début des années 2010 dans des projets « CTO » (coal-to-olefins – production d'alcènes à partir de charbon). Une première usine d'une capacité de 200 000 tonnes d'éthylène glycol par an a été ouverte à Baotou, en Mongolie-Intérieure, en 2010[12], et en 2019, il y avait 25 unités opérationnelles de CTO et MTO (methanol-to-olefins), pour une production totale d'éthylène de 5,21 millions de tonnes par an, soit 21% de la production chinoise. Cependant, du fait de la chute des cours du pétole à partir de 2014, des normes environnementales plus strictes (avec la volonté du gouvernement chinois de réduire son utilisation de charbon), et la hausse du prix du méthanol, la croissance de ce secteur a drastiquement baissé, notamment face à la concurrence de nouvelles unités de vapocraquage[13].
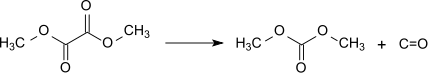
Il est également possible de convertir l'oxalate de diméthyle en carbonate de diméthyle par décarbonylation vers 100 °C en présence d'alcoolates de métaux alcalins[14] :
Le monoxyde de carbone ainsi formé peut être réutilisé dans la formation d'oxalate de diméthyle.
L'oxalate de diphényle peut être obtenu par transestérification de l'oxalate de diméthyle par le phénol en présence de catalyseurs au titane[15], qui peut ensuite être decarbonylé en carbonate de diphényle, en phase liquide ou gazeuse. Le carbonate de diphényle peut ensuite être utilisé comme substitut au très toxique phosgène dans la production de polycarbonates[16].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Dimethyl oxalate » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Dimethyl oxalate, consultée le 14 octobre 2019.+ (pdf) fiche MSDS.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, S. 168; (ISBN 978-3-527-31540-6).
- US 4467109, Susumu Tahara et al., "Process for Continuous preparation of diester of oxalic acid", issued 1983-05-19, assigned to Ube Industries et EP 108359, K. Masunaga et al., "Process for the preparation of a diester of oxalic acid", assigned to Ube Industries, EP 425197, K. Nishihira & K. Mizutare, "Process for preparing diester of carbonic acid", published 1991-05-2, assigned to Ube Industries, US 4451666, J.A. Sofranko, A.M. Gaffney, "Synthesis of oxalate esters by the oxidative carbonylation of alcohols", published 1984-05-29, assigned to Atlantic Richfield Co.
- E. Amadio: Oxidative Carbonylation of Alkanols Catalyzed by Pd(II)-Phosphine Complexes, PhD Thesis, Ca’Foscari University Venice, 2009.
- X.-Z. Jiang, Palladium Supported Catalysts in CO + RONO Reactions, Platinum Metals Rev., 1990, 34, (4), 178–180
- Alkylation with Oxalic Esters. Scope and Mechanism
- (de) Marina Bährle-Rapp, Springer Lexikon Kosmetik und Körperpflege, , 483 p. (ISBN 978-3-540-20416-9), p. 130.
- Nexant/Chemsystems, « Coal to MEG, Changing the Rules of the Game » [archive du ] (consulté le ) (PDF; 5,4 MB), 2011 Prospectus
- 983 EP 046 983, S. Tahara et al., "Process for continuously preparing ethylene glycol", assigned to Ube Industries et H. T. Teunissen and C. J. Elsevier, Ruthenium catalyzed hydrogenation of dimethyl oxalate to ethylene glycol, J. Chem. Soc., Chem. Commun., 1997, 667-668), DOI:10.1039/A700862G.
- S. Zhang et al., Highly-Dispersed Copper-Based Catalysts from Cu–Zn–Al Layered Double Hydroxide Precursor for Gas-Phase Hydrogenation of Dimethyl Oxalate to Ethylene Glycol, Catalysis Letters, Sept. 2012, 142 (9), 1121–1127, DOI:10.1007/s10562-012-0871-8.
- (en) « China's coal-based chemicals are a trade-off », sur Icis (consulté le ).
- Can China’s CTO and MTO industries survive the threat of massive steam cracker investment?/
- US 4544507, P. Foley, "Production of carbonate diesters from oxalate diesters", assigned to Celanese Corp
- US 5834614, K. Nishihira et al., "Process for producing diaryl carbonate", assigned to Ube Industries, Ltd. et X.B. Ma et al., Preparation of Diphenyl Oxalate from Transesterification of Dimethyl Oxalate with Phenol over TS-1 Catalyst, Chinese Chem. Lett., 14 (5), 461–464 (2003), DOI:10.1016/s0378-3820(03)00075-4.
- JP 2011236146, "Method for Producing Diaryl Carbonate and Method for Producing Polycarbonate", assigned to Mitsubishi Chemical Corp.