Chlorure de palladium(II)
Le chlorure de palladium(II), aussi appelé dichlorure de palladium ou chlorure palladieux, est le composé chimique de formule brute PdCl2. Il s'agit du sel de palladium de l'acide chlorhydrique. PdCl2 est couramment utilisé comme composé de départ pour la chimie du palladium et en particulier des catalyseurs à base de palladium pour la chimie organique.
| Chlorure de palladium(II) | |||
_chloride.jpg.webp)
| |||
| échantillon de dichlorure de palladium | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | dichloropalladium | ||
| Synonymes |
dichlorure de palladium, chlorure palladieux |
||
| No CAS | |||
| No ECHA | 100.028.724 | ||
| No CE | 231-596-2 | ||
| No RTECS | RT3500000 | ||
| PubChem | 24290 | ||
| ChEBI | 53434 | ||
| SMILES | |||
| InChI | |||
| Apparence | cristaux ou poudre rouge profond hydroscopique (anhydre) à marron foncé (dihydrate)[1] | ||
| Propriétés chimiques | |||
| Formule | PdCl2 | ||
| Masse molaire[2] | 177,33 ± 0,01 g/mol Cl 39,98 %, Pd 60,01 %, |
||
| Propriétés physiques | |||
| T° fusion | 590 °C (sublimation)[1] 678-680 °C[3],[4] |
||
| Solubilité | eau: anhydre quasiment insol., dihydrate sol[1]. ainsi que dans éthanol, acétone[3],... | ||
| Masse volumique | 4 g·cm-3[3] à 20 °C[1] et à 25 °C[4] | ||
| Cristallographie | |||
| Système cristallin | rhomboédrique | ||
| Précautions | |||
| SGH[1],[3],[4] | |||
    |
|||
| Transport[4] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 2704 mg/kg (rat, oral)[3] 575 mg/kg (rat (mâle Sprague Dawley), oral, dihydrate)[3] 3 mg/kg (rat, i.v.)[3] 5 mg/kg (lapin, i.v.)[3] 174 mg/kg (souris, i.p.)[3] 70 mg/kg (rat, i.p.)[3] 85-128 mg/kg (rat (mâle Sprague Dawley), i.p., dihydrate)[3] 6 mg/kg (rat, i.t.)[3] 20 mg/œuf (œuf de poule)[3] |
||
| CL50 | 0,237 mg/L/24 h (Tubifex tubifex (vers tubificide), 95% intervalle de confiance: 0,183-0,316 mg/L); 0,142 mg/L/48 h (95% intervalle de confiance: 0,107-0,184 mg/L); 0,092 mg PdCl2+/L/96 h (95% intervalle de confiance: 0,033-0,052 mg/L); renouvellment (tous les 24 h) | ||
| Composés apparentés | |||
| Autres anions | iodure de palladium(II) | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Synthèse
Le dichlorure de palladium peut être obtenu par dissolution de palladium métallique dans l'eau régale ou dans de l'acide chlorhydrique en présence de chlore[5]. Alternativement, il peut être synthétisé directement par chauffage d'une éponge de palladium dans du chlore à 500 °C.
Le chlorure de palladium(II) anhydre qui forme des cristaux rhombiques rouge profond, peut former un dihydrate marron foncé[3],[6].
Structure
Deux formes de PdCl2 sont connues. Dans ces deux structures, les centres palladium ont une géométrie de coordination plan-carré qui est caractéristique du Pd(II). Ces centres palladium sont reliés par des ponts μ2-chlorure également dans les deux formes. La forme α-PdCl2 consiste en des chaînes polymériques tandis que le β-PdCl2 est moléculaire et consiste en des clusters octaédriques de 6 atomes de palladium pontés par 12 μ2-ions chlorure qui forment les 12 arêtes de l'octaèdre dont les atomes de palladium occupent les sommets. Le PtCl2 adopte la même structure tandis que le NiCl2 adopte les mêmes motifs que le CdCl2, c'est-à-dire avec des centres métalliques hexacoordinés[6].
-chloride-xtal-3D-balls.png.webp) | 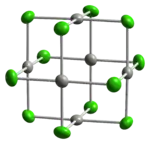 |
| __ Pd2+ __ Cl− | |
| Modèle boules et bâtons de la structure cristalline de l' α-PdCl2 | Modèle avec ellipsoïde thermique (en) de la molécule Pd6Cl12 trouvée dans la structure cristalline du β-PdCl2 |
Réaction
Le chlorure de palladium(II) se décompose en palladium et chlore à 600 °C[3]. Il se dissout dans l'acide chlorhydrique en formant des complexes ioniques tétrachloropalladates [PdCl4]2−[5] :
- PdCl2 + 2 Cl− → [PdCl4]2−
De la même façon, le chlorure de palladium(II) peut être solubilisé sous la forme de l'anion tétrachloropalladate en réagissant avec un chlorure métallique approprié dans l'eau[7] :
- PdCl2 + 2 MCl → M2PdCl4
Ce type de composés peut également réagir avec des phosphines pour donner des complexes phosphine de palladium[7].

L'introduction de sulfure d'hydrogène dans une solution de tétrachloropalladate précipite du monosulfure de palladium brun-noir, PdS. PdCl2 chauffé avec du soufre à 450 à 500 °C forme le disulfure de palladium, PdS2.
L'ajout d'ammoniac à une solution aqueuse de tétrachloropalladate forme du chlorure de palladium(II) tétraamine [Pd(NH3)4]Cl2 ce qui se produit également avec du PdCl2 sec[5].
Le chlorure de palladium(II) n'est pas particulièrement soluble dans l'eau ou les solvants non coordinants, de sorte que la première étape de son utilisation est souvent la préparation d'adduits de base de Lewis labiles mais solubles, tels que ceux dérivés de l'acétonitrile ou du benzonitrile[8]. Le complexe acétonitrile est préparé en traitant PdCl2 dans l'acétonitrile au reflux :
- PdCl2 + 2 MeCN → PdCl2(MeCN) 2
Bien que parfois recommandées, les techniques de protection avec des gaz inertes ne sont pas nécessaires si le complexe doit être utilisé in situ. Par exemple, le dichlorure de bis (triphénylphosphine) palladium(II) peut être préparé à partir de chlorure de palladium(II) en le faisant réagir avec de la triphénylphosphine dans du benzonitrile[9] :
- PdCl2 + 2 PPh3 → PdCl2(PPh3)2
Une réduction supplémentaire en présence de plus de triphénylphosphine donne le tétrakis(triphénylphosphine) palladium(0). Cette seconde réaction peut être effectuée sans purifier le dichlorure, diphosphine intermédiaire[10] :
Le chlorure de palladium(II) peut également être utilisé pour donner des catalyseurs de palladium hétérogènes: du palladium sur sulfate de baryum, du palladium sur carbone et du chlorure de palladium sur le carbone[11].
Utilisation
Même lorsqu'il est sec, le chlorure de palladium (II) peut rapidement tacher l'acier inoxydable. Ainsi, les solutions de chlorure de palladium(II) sont parfois utilisées pour tester la résistance à la corrosion de l'acier inoxydable[12].
Le chlorure de palladium(II) est parfois utilisé dans les détecteurs de monoxyde de carbone. Le monoxyde de carbone réduit le chlorure de palladium (II) en palladium :
- PdCl2 + CO + H2O → Pd + CO2 + 2HCl
Le PdCl2 résiduel est converti en PdI2 rouge, dont la concentration peut être déterminée par colorimétrie[13] :
Le chlorure de palladium(II) est utilisé dans le procédé Wacker pour la production d'aldéhydes et de cétones à partir d'alcènes.
Le chlorure de palladium (II) peut également être utilisé pour le tatouage cosmétique des leucomes dans la cornée.

Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Palladium(II) chloride » (voir la liste des auteurs) et en allemand « Palladium(II)-chlorid » (voir la liste des auteurs)..
- Entrée du numéro CAS « 7647-10-1 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 juillet 2016 (JavaScript nécessaire).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem CID 24290
- Fiche Sigma-Aldrich du composé Palladium(II) chloride 99.999%, consultée le 25 juin 2017. + (pdf) Fiche MSDS
- Simon Cotton, The Chemistry of Precious Metals, Springer, 1997.
- (de) A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie, 101e éd., de Gruyter, Berlin 1995. (ISBN 3-11-012641-9), (page sur googlebook). ou (en) A. F. Holleman, E. Wiberg, Inorganic Chemistry, Academic Press, San Diego, 2001. (ISBN 0-12-352651-5).
- Daniele Choueiry, Ei-ichi Negishi, Chap. II.2.3 Pd(0) and Pd(II) Complexes Containing Phosphorus and Other Group 15 Atom Ligands, Handbook of Organopalladium Chemistry for Organic Synthesis, John Wiley & Sons Inc., 2002, p. 47. (ISBN 0-471-31506-0), page sur googlebook.
- Gordon K. Anderson, Minren Lin, Bis(Benzonitrile)Dichloro Complexes of Palladium and Platinum, Inorg. Synth., 1990, vol. 28, p. 60–63. DOI:10.1002/9780470132593.ch13
- Norio Miyaura, Akira Suzuki, Palladium-catalyzed reaction of 1-alkenylboronates with vinylic halides: (1Z,3E)-1-Phenyl-1,3-octadiene, Org. Synth., Coll. Vol. 8, p. 532.
- D. R. Coulson, L. C. Satek, S. O. Grim, 23. Tetrakis(triphenylphosphine)palladium(0), Inorg. Synth., 1972, vol. 13, p. 121. DOI:10.1002/9780470132449.ch23
- Ralph Mozingo, Palladium Catalysts, Org. Synth., 1955, Coll. vol. 3, p. 685.
- par exemple, http://www.marinecare.nl/assets/Uploads/Downloads/Leaflet-Passivation-Test-Kit.pdf.
- T. H. Allen, W. S. Root, Colorimetric Determination of Carbon Monoxide in Air by an improved Palladium Chloride Method, J. Biol. Chem.,1955, vol. 216(1), p. 309–317. .
- Portail de la chimie
