Fixation du carbone en C4
La fixation du carbone en C4 est l'un des trois modes de fixation du carbone des êtres vivants, parallèlement à la fixation du carbone en C3 et au métabolisme acide crassulacéen (CAM). On l'appelle ainsi en référence à l'oxaloacétate, molécule comportant quatre atomes de carbone formée dès la première étape du processus chez un petit groupe de plantes souvent désignées collectivement comme « plantes en C4 ».
On pense que le processus en C4 est une évolution de la fixation du carbone en C3. Les processus de type C4 et CAM permettent en effet de limiter la photorespiration, qui résulte de la fixation d'une molécule d'oxygène O2 par l'activité oxygénase de la Rubisco parallèlement à l'activité carboxylase de cette enzyme qui, seule, permet la fixation du dioxyde de carbone CO2.
Processus biochimique
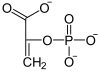
Chez les plantes en C4, le CO2 est d'abord fixé sur du phosphoénolpyruvate par la phosphoénolpyruvate carboxylase, une enzyme à l'activité carboxylase plus efficace que celle de la Rubisco :
Le phosphoénolpyruvate est lui-même préalablement formé à partir du pyruvate sous l'action de la pyruvate phosphate dikinase. La fixation du CO2 sur le phosphoénolpyruvate se déroule au niveau des cellules du mésophylle, représentées en jaune sur les schémas ci-dessous. Elle est favorisée par la faible constante de Michaelis Km de la phosphoénolpyruvate carboxylase — c'est-à-dire la concentration molaire de substrat à laquelle l'enzyme atteint la moitié de sa vitesse de réaction maximale — qui est inférieure à celle de la Rubisco, ce qui signifie que cette dernière est moins rapide à taux de CO2 égal.
L'oxaloacétate est converti dans le mésophylle en malate par la malate déshydrogénase à NADP+ (NADP-MDH) ou en aspartate par l'aspartate aminotransférase, et c'est sous cette forme qu'il circule vers les cellules des gaines périvasculaires, représentés en vert pâle sur les schémas ci-dessous, où le CO2 est libéré pour être mis à disposition de la Rubisco. Dans ces cellules, la Rubisco est isolée de l'oxygène atmosphérique et est donc saturée en dioxyde de carbone issu de la décarboxylation du malate ou de l'aspartate, ce qui l'oriente presque exclusivement vers son activité carboxylase.
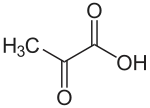
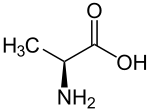
La libération du CO2 autour de la Rubisco est catalysée par l'enzyme malique à NADP (NADP-ME) chez le maïs et la canne à sucre, par l'enzyme malique à NAD (NAD-ME) chez le millet, et par la phosphoénolpyruvate carboxykinase (PEPCK) chez l'herbe de Guinée. L'acide carboxylique à trois atomes de carbone qui retourne au mésophylle est généralement le pyruvate mais peut également être l'alanine chez certaines espèces.
La navette permettant de concentrer le CO2 autour de la Rubisco requiert cependant de l'énergie sous forme d'ATP : 18 molécules d'ATP sont nécessaires pour produire une molécule de glucose par la fixation du carbone en C3 tandis que 30 molécules d'ATP sont nécessaires pour produire ce même glucose par la fixation du carbone en C4. Cette consommation supplémentaire d'énergie permet aux plantes en C4 de fixer le carbone plus efficacement dans des conditions particulières, les plantes en C3 restant plus efficaces dans les conditions les plus répandues.
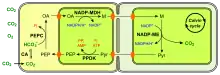 (en) Fixation du carbone en C4 à NADP-ME.
(en) Fixation du carbone en C4 à NADP-ME.
- CA : anhydrase carbonique ;
- PEP : phosphoénolpyruvate ;
- PEPC : phosphoénolpyruvate carboxylase ;
- OA : oxaloacétate ;
- NADP-MDH : malate déshydrogénase à NADP+ ;
- M : malate ;
- NADP-ME : enzyme malique à NADP ;
- Pyr : pyruvate.
Les chloroplastes sont représentés de couleur vert vif.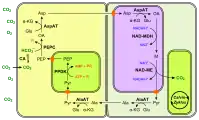 (en) Fixation du carbone en C4 à NAD-ME.
(en) Fixation du carbone en C4 à NAD-ME.
- CA : anhydrase carbonique ;
- PEP : phosphoénolpyruvate ;
- PEPC : phosphoénolpyruvate carboxylase ;
- OA : oxaloacétate ;
- Glu : Glu ;
- AspAT : aspartate aminotransférase ;
- α-KG : α-cétoglutarate ;
- Asp : aspartte ;
- NAD-MDH : malate déshydrogénase ;
- M : malate ;
- NAD-ME : enzyme malique à NAD ;
- Pyr : pyruvate ;
- AlaAT : alanine aminotransférase ;
- Ala : alanine ;
- PPDK : pyruvate phosphate dikinase.
Les enzymes à NAD — ici la MDH et la NAD-ME — se trouvent dans les mitochondries, représentées de couleur violacée.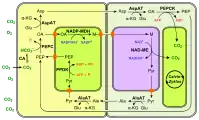 (en) Fixation du carbone en C4 à PEPCK.
(en) Fixation du carbone en C4 à PEPCK.
- CA : anhydrase carbonique ;
- PEP : phosphoénolpyruvate ;
- PEPC : phosphoénolpyruvate carboxylase ;
- OA : oxaloacétate ;
- Glu : Glu ;
- AspAT : aspartate aminotransférase ;
- PEPCK : phosphoénolpyruvate carboxykinase
- α-KG : α-cétoglutarate ;
- Asp : aspartte ;
- NADP-MDH : malate déshydrogénase à NADP+ ;
- M : malate ;
- NAD-ME : enzyme malique à NAD ;
- Pyr : pyruvate ;
- AlaAT : alanine aminotransférase ;
- Ala : alanine ;
- PPDK : pyruvate phosphate dikinase.
Les enzymes à NAD — ici la NAD-ME — se trouvent dans les mitochondries, représentées de couleur violacée.
Avantage compétitif des plantes en C4
Les plantes dites « en C4 » ont un avantage compétitif par rapport aux plantes qui réalisent la fixation du carbone « en C3 » lorsqu'elles sont soumises à la sécheresse, à la chaleur et à un faible taux d'azote N2 ou de dioxyde de carbone CO2. Lorsqu'elles sont cultivées dans le même environnement à 30 °C, les graminées en C3 perdent environ 833 molécules d'eau par molécule de CO2 fixée, tandis que celles en C4 en perdent seulement 277, ce qui leur offre un avantage dans les environnements arides[1].
La fixation du carbone en C4 est apparue une quarantaine de fois dans différentes familles de plantes, ce qui en fait une parfaite illustration d'évolution convergente[2]. Cette convergence a pu être facilitée par le fait que plusieurs évolutions possibles vers un phénotype en C4 existent, dont de nombreuses impliquent des étapes initiales qui ne sont pas directement liées à la photosynthèse[3]. Les plantes en C4 seraient apparues il y a entre 25 et 32 millions d'années à l'Oligocène et leur présence ne serait devenue significative qu'il y a 6 à 7 millions d'années, au Miocène[2]. Ce métabolisme aurait pris de l'ampleur lorsque les graminées se seraient répandues depuis les sous-bois ombragés pour se répandre dans des environnements plus exposés[4], où le fort rayonnement solaire lui donnait l'avantage par rapport à la voie métabolique en C3[5]. Cette innovation n'a pas été rendue nécessaire par la sécheresse, la résistance accrue au stress hydrique apparaissant comme une conséquence heureuse de cette évolution, permettant aux plantes qui en étaient pourvues de coloniser les environnements arides[5].
Les plantes en C4 représentent aujourd'hui environ 5 % de la biomasse végétale et 3 % des espèces de plantes connues[1],[6], parmi lesquelles le sorgho, la canne à sucre, le mil ou le maïs[7]. En dépit de leur relative rareté, elles sont cependant responsables d'environ 30 % de la fixation du carbone sur Terre[2]. Accroître la proportion de plantes en C4 à la surface de notre planète pourrait favoriser la séquestration naturelle du CO2 et constitue une stratégie possible de prévention du réchauffement climatique[8]. Les plantes en C4 sont aujourd'hui concentrées dans les zones tropicales et subtropicales, c'est-à-dire aux latitudes inférieures à 45°, là où les températures élevées tendent à favoriser l'activité oxygénase de la Rubisco, et donc la photorespiration des plantes en C3.
Bibliographie
- (en) Malti Goel, Carbon Capture, Storage and, Utilization : A possible climate change solution for energy industry, The Energy and Resources Institute (TERI), , 290 p. (présentation en ligne)
Notes et références
- (en) Rowan Sage, C4 Plant Biology, San Diego/London/Boston etc., Academic press, , 596 p. (ISBN 0-12-614440-0, lire en ligne)
- (en) Colin P Osborne et David J Beerling, « Nature's green revolution: the remarkable evolutionary rise of C4 plants », Philosophical Transactions of the Royal Society B, Biological Sciences, vol. 361, no 1465, , p. 173-194 (PMCID 1626541, lire en ligne) DOI:10.1098/rstb.2005.1737
- (en) Ben P Williams, Iain G Johnston, Sarah Covshoff et Julian M Hibberd, « Phenotypic landscape inference reveals multiple evolutionary paths to C4 photosynthesis », eLife, vol. 2, , e00961 (lire en ligne) DOI:10.7554/eLife.00961
- (en) Erika J. Edwards et Stephen A. Smith, « Phylogenetic analyses reveal the shady history of C4 grasses », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 6, , p. 2532-2537 (PMCID 2823882, Bibcode 2010PNAS..107.2532E, lire en ligne) DOI:10.1073/pnas.0909672107
- (en) Colin P. Osborne et Robert P. Freckleton, « Ecological selection pressures for C4 photosynthesis in the grasses », Proceedings of the Royal Society B, Biological Sciences, vol. 276, no 1663, , p. 1753-1760 (PMCID 2674487, lire en ligne) DOI:10.1098/rspb.2008.1762
- (en) W. J. Bond, F. I. Woodward et G. F. Midgley, « The global distribution of ecosystems in a world without fire », New Phytologist, vol. 165, no 2, , p. 525-538 (lire en ligne) DOI:10.1111/j.1469-8137.2004.01252.x
- Étienne Roth (dir.), Bernard Poty (dir.), Georgette Délibrias et al. (préf. Jean Coulomb), Méthodes de datation par les phénomènes nucléaires naturels, Paris, Éditions Masson, coll. « Collection CEA », , 631 p. (ISBN 2-225-80674-8), chap. 15 (« Le carbone 14 »).
- Goel 2014, p. 168.
- Portail de la biochimie
- Portail du climat
_Formula_V.1.png.webp)
_Structure_V.1.png.webp)