Poaceae
Les Poaceae, ou Graminées, sont une famille de plantes monocotylédones de l'ordre des Poales, qui comprend environ 12 000 espèces groupées en 780 genres, à répartition cosmopolite. C'est, par le nombre d'espèces, la cinquième famille de plantes à fleurs, après les Asteraceae, Orchidaceae, Fabaceae et Rubiaceae. On y trouve la plupart des espèces appelées communément herbes et les céréales.
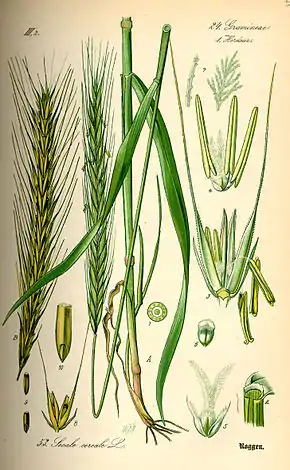
(illustration botanique planche extraite de Flora von Deutschland, Österreich und der Schweiz d'Otto Wilhelm Thomé, 1885, Gera).
| Règne | Plantae |
|---|---|
| Clade | Angiospermes |
| Clade | Monocotylédones |
| Clade | Commelinidées |
| Ordre | Poales |
Taxons de rang inférieur
(selon Soreng et al., 2015)[2]
- Anomochlooideae Pilg. ex Potztal,
- Aristidoideae Caro
- Arundinoideae Dumortier
- Bambusoideae Luerss.
- Chloridoideae Kunth ex Beilschm.
- Danthonioideae H.P. Linder & N.P. Barker
- Micrairoideae Pilg.
- Oryzoideae Kunth ex Beilschm.
- Panicoideae Link
- Pharoideae L.G.Clark & Judz.
- Pooideae Benth.
- Puelioideae L.G.Clark, M.Kobay., S.Mathews, Spangler & E.A.Kellogg
- Gramineae Juss.
Ce sont généralement des plantes herbacées, plus rarement ligneuses (bambous), qui partagent des caractéristiques morphologiques qui les distinguent nettement des autres familles végétales : tiges (chaumes) cylindriques aux entrenœuds creux, feuilles alternes à disposition distique, au limbe linéaire à nervation parallèle, et dont la gaine enveloppe la tige, inflorescence élémentaire en épillets, fleurs réduites aux organes sexuels (étamines et ovaire), fruits dont le péricarpe est soudé à la graine (caryopses).
Les formations graminéennes, telles que les savanes et les prairies, dans lesquelles les Poaceae sont l'élément dominant, couvrent plus de 40 % de la surface terrestre (Groenland et Antarctique exclus)[3]. Les graminées forment également une part importante d'autres habitats, notamment des zones humides, des forêts et de la toundra.
C'est la famille de plantes la plus importante sur le plan économique, qui fournit une part essentielle de l'alimentation de base directement grâce aux espèces domestiquées comme les céréales (blé, riz, maïs, orge et millet), la canne à sucre, et indirectement grâce aux plantes fourragères, sans compter les matières utiles à l'industrie ou l'artisanat comme les bambous, la paille, le chaume et la biomasse (éthanol). Les graminées sont aussi cultivées pour l'agrément, notamment pour constituer des pelouses et des terrains de sport (golf), et pour lutter contre l'érosion des sols (oyat, vétiver). La famille compte aussi de nombreuses espèces adventices qui affectent les cultures, cinq espèces de Poaceae (Cynodon dactylon, Echinochloa colona, Eleusine indica, Sorghum halepense, Imperata cylindrica) figurant parmi les dix « pires » mauvaises herbes sur le plan mondial[4].
L'étude des phytolithes a montré que les Poaceae sont probablement apparues au cours du Crétacé, il y a plus de 85 millions d'années, faisant déjà partie de l'alimentation des dinosaures[5].
Étymologie
Le nom de « Poaceae » a été donné à cette famille par John Hendley Barnhart en 1895[6], en référence au nom de la tribu des Poeae (taxon décrit en 1814 par Robert Brown), et au nom du genre-type, Poa (décrit en 1753 par Linné). Ce terme dérive du grec ancien, πόα (poa), désignant l'herbe.
« Poaceae » est un nomen alternativum (nom de famille alternatif), correctement formé à partir du nom d'un genre, mais dont l'usage est autorisé en application de l'article 18.6 du Code international de nomenclature pour les plantes (CIN), aux côtés de « Gramineae », considéré comme un nom valide en raison d'un « long usage » (art. 18.5 du CIN)[7].
Morphologie
Les graminées sont en général des plantes herbacées, annuelles ou vivaces à tige cylindrique creuse portant des nœuds, le chaume, généralement non ramifiée sauf au niveau du sol où se produit souvent le phénomène du tallage, qui conduit à la formation de touffes caractéristiques. Certaines espèces produisent des rhizomes et des stolons qui permettent l'occupation du terrain en surface et la formation de pelouses.

Racines

À maturité, le système racinaire des graminées est fibreux et fasciculé, constitué exclusivement de nombreuses racines adventives qui forment un chevelu important. Ces racines adventives remplacent les racines séminales et les racines nodales primaires qui ont une durée de vie éphémère. Elles prennent naissance au niveau des nœuds de la base des tiges, des rhizomes et des stolons, en fait de tous les nœuds en contact avec le sol. Dans certains cas, chez le maïs et le sorgho par exemple, on peut voir apparaître, nettement au-dessus du niveau du sol, des verticilles de racines, appelées racines coronaires ou racines d'ancrage[8].
Tiges
La tige des graminées, ou chaume, a une structure caractéristique. C'est une tige cylindrique, à section circulaire à elliptique, articulée par une succession de nœuds pleins, séparés par des entrenœuds généralement creux par résorption de la moelle. Quelques espèces ont toutefois une tige pleine, par exemple la canne à sucre dont la moelle est exploitée pour la production de sucre.
Les nœuds sont un peu plus épais que les entrenœuds et c'est à leur niveau que naissent les feuilles et les bourgeons. Les entrenœuds sont parfois quelque peu aplatis dans la zone où se développent des ramifications. Juste au-dessus du nœud, on trouve un méristème intercalaire en forme d'anneau qui détermine l'allongement de la tige.
Au niveau des nœuds, se trouvent des éléments de renfort fibreux qui donnent à la tige plus de stabilité et de résistance à la traction. Ces tiges restent ainsi souples et flexibles, et sont capables de se redresser à nouveau après une exposition au vent ou à la pluie.
Chez certains genres, il existe deux à six nœuds plus rapprochés les uns des autres (qui sont appelés « nœuds composés »), chacun d'entre eux portant la feuille correspondante. Chez Cynodon dactylon, par exemple, les nœuds sont groupés deux à deux de sorte que les feuilles paraissent opposées. En général les entrenœuds sont plus courts à la base des tiges que ceux de la partie supérieure ; lorsque de nombreux nœuds à la base de la plante sont très rapprochés, les feuilles sont disposées de telle manière qu'elles simulent une rosette.

On peut distinguer différents types de tiges chez les graminées :
- les tiges aériennes, dressées ou ascendantes, ont généralement des entrenœuds courts à la base et progressivement plus longs jusqu'à l'apex ; elles peuvent être simples ou ramifiées ;
- les tiges rampantes croissent horizontalement sur le sol et s'enracinent au niveau des nœuds ; elles présentent souvent des nœuds composés, par exemple chez les genres Stenotaphrum et Cynodon ; lorsqu'elles donnent naissance à une nouvelle plante à chaque nœud, on les appelle « stolons » ;
- les tiges flottantes : elles flottent dans l'eau grâce à leurs entrenœuds creux ou à la présence d'aérenchyme ;
- les rhizomes sont des tiges souterraines, dont il existe deux types chez les graminées ; un premier type de rhizomes courts et incurvés, à croissance définie, générant de nouvelles plantes à côté de la touffe originelle, contribuant à augmenter son diamètre, comme chez Arundo donax et Spartina densiflora ; et un deuxième type de rhizome long, à croissance indéfinie, qui contribue à propager la plante à une certaine distance de la touffe originelle, par exemple chez Sorghum halepense et Panicum racemosum ;
- les pseudobulbes formés par un épaississement des entrenœuds de la base, enveloppés par leurs gaines foliaires, sont rares chez les graminées, on en trouve par exemple chez Amphibromus scabrivalvis et l'alpiste tubéreux Phalaris aquatica[9],[10].
Feuilles
-fr.jpg.webp)
Les feuilles des graminées, à disposition alterne distique, se caractérisent par un limbe allongé, étroit, généralement linéaire à nervation parallèle. Elles sont généralement sessiles, s'attachent à la tige par une gaine. Le limbe est simple et peut être parfois aplati ou roulé en tube. La gaine, généralement fendue, entoure étroitement la tige, ses marges se chevauchant mais sans se souder (il y a des exceptions dans lesquelles la gaine forme un tube). À la jonction du limbe avec la gaine, se trouve un petit appendice membraneux situé dans la partie adaxiale, la ligule, plus rarement réduite à un groupe de poils (trichomes).
Ces différents éléments présentent une certaine variabilité :
- la gaine naît au niveau d'un nœud et entoure la tige ; elle peut être plus courte ou plus longue que l'entrenœud. Souvent, la gaine est divisée à la base, tandis que les bords s'enroulent en se superposant autour de la tige, mais chez de nombreuses espèces, les bords sont partiellement ou totalement soudés (par exemple chez les bromes) et même la ligule peut former un anneau continu autour de la tige, comme chez le genre Melica et certaines espèces de Poa. Les nervures de la gaine sont nombreuses et uniforme, bien que chez des espèces aux tiges comprimées, les gaines peuvent présenter une carène remarquable ;
- la ligule est généralement membraneuse, mais chez certaines tribus, comme les Eragrostideae, les Arundinoideae et les Panicoideae, elle est formée par une bande de poils ou cils, ou est absente. Chez certains genres de Triticeae et de Poeae aux côtés de la ligule se trouvent deux oreillettes embrassant la tige ;
- chez de nombreuses espèces de bambous, il existe une contraction entre le limbe et la gaine qui ressemble à un pétiole ; souvent ce « pseudopétiole » est articulé sur le limbe et est persistant. On trouve des pseudopétioles également chez les Pharus et chez Setaria palmifolia ;
- le limbe est généralement linéaire ou lancéolé, entier et à nervation parallèle. Chez les genres tropicaux, on trouve des limbes oblongs à largement elliptiques, comme chez les genres Pharus et Olyra. Le limbe des Neurolepis (Bambusoideae) peut avoir jusqu'à quatre mètres de long. Lorsque les feuilles sont larges et planes, comme c'est le cas des genres Zea et Sorghum, il y a une nervure centrale remarquable. En revanche, chez les feuilles linéaire étroites, les nervures sont plus ou moins égales. Dans ce cas, on a des feuilles pliées longitudinalement ou enroulées. Cette caractéristique se voit parfaitement dans la première préfoliaison (préfoliaison pliée ou enroulée) et constitue un critère d'identification des espèces. Par exemple, les feuilles pliées sont typiques de Stenotaphrum secundatum, Bromus brevis, Dactylis glomerata, Axonopus compressus, Poa lanuginosa, entre autres. Les feuilles enroulées peut être vues notamment chez Lolium multiflorum, Bromus unioloides, Paspalum dilatatum. Dans certains cas, le limbe est modifié, devenant épais et subulé, comme chez Sporobolus rigens.
Appareil reproducteur




Fleur
Les graminées sont des plantes anémophiles qui possèdent des caractéristiques communes que les botanistes regroupent sous le terme du « syndrome de l'anémophilie » : fleurs discrètes souvent vert-pâle au périanthe réduit (à des écailles appelées lodicules[11], turgescentes à la floraison, ce qui permet la sortie des organes reproducteurs par écartement des glumelles) ou absent (pas d'investissement dans ces pièces florales, dans le parfum ou le nectar qui font partie des stratégies d'attraction des pollinisateurs par les fleurs entomophiles). La fleur est enveloppée par deux bractées appelées glumelles. La glumelle inférieure, appelée lemme, est une bractée insérée sur le rachillet, la glumelle supérieure, ou paléole, est une préfeuille insérée sur l'axe floral. La fleur entourée de ses glumelles constitue le fleuron[12]. L'appareil reproducteur fleur comprend en général un verticille de trois étamines (mais six chez les Bambusoideae), parfois seulement deux (ex. : Imperata sp.), très rarement une seule (Vulpia ciliata). Ces étamines sont composées d'anthères médifixes (d'où la forme typique d'X) insérées sur de longs filets grêles qui pendent hors de l'épillet (anthères dites versatiles ou oscillantes car pouvant s'incliner sous différents angles selon la direction du vent). L'ovaire uniloculaire (résultant de la fusion des trois carpelles des monocotylédones) est généralement surmonté de deux longs stigmates ramifiés (aspect « plumeux » typique des Poacées) dont la surface d'échange augmente la probabilité de capturer les grains de pollen des Poaceae. Le caractère aléatoire de l'anémogamie est le risque d'autofécondation. L'autopollinisation existe chez les espèces dont les organes reproducteurs arrivent à maturité en même temps, mais ne conduit pas forcément à l'autofécondation et la majorité des espèces pratiquent la séparation des sexes dans l'espace (diécie) ou dans le temps (protandrie), ce qui favorise la pollinisation croisée[13].
Inflorescence
L'inflorescence élémentaire est l'épillet, qui comprend un nombre variable de fleurons, disposés de façon distique le long d'une axe, le rachillet. L'épillet est sous-tendu par deux bractées stériles, les glumes, en général au nombre de deux. La glume inférieure, toujours plus petite que la glumelle supérieure, est parfois absente. Le nombre de fleurs se réduit souvent à un, comme chez le riz (oryza sativa), mais de tels exemples se trouvent dans presque toutes les tribus[12].
Dans certains cas, par exemple chez Poa bulbosa, les épillets se transforment en bulbilles, permettant une reproduction végétative[14].
On distingue, selon le mode de regroupement des épillets, trois types principaux d'inflorescences secondaires chez les graminées : panicule (avoine, agrostis, phragmites), racème et épi (blé, chiendent). Il existe cependant de nombreux types intermédiaires[8].
Fruit
À maturité, l'ovaire se transforme en un fruit particulier, le caryopse, fruit caractéristique des Poaceae, souvent appelé « grain ». Il s'agit d'un type particulier d'akène, fruit sec indéhiscent renfermant une seule graine, qui se différencie par le fait que le péricarpe est fusionné avec le tégument de la graine[15]. Toutefois, on rencontre chez certains genres des caryopses particuliers, par exemple à péricarpe épais et charnu en forme de baies globuleuses (caryopses baccoïdes) chez certains genres de Bambuseae tels que Dinochloa, Melocanna, Melocalamus et Ochlandra[16],[17]. Chez Coix lacryma-jobi, le caryopse est inclus dans un involucre en forme d'utricule présentant un trou à son sommet. Ce « pseudo-fruit » particulier, dont la forme évoque une perle ou une larme, est gris bleuté, dur et d'apparence vernissée dans les formes sauvages[18],[19].
Dans le caryopse, l'embryon est en position latérale, séparé de l'albumen par le scutellum, considéré comme un cotylédon modifié. Il présente un axe embryonnaire hautement différencié, avec vers le haut le méristème de la tige (gemmule ou plumule), enveloppée par le coléoptile, et vers le bas celui de la racine (radicule), enveloppée par la coléorrhize. Chez certaines espèces, on trouve à l'opposé du scutellum, l'épiblaste, considéré parfois comme le rudiment d'un second cotylédon. L'épiblaste est absent dans les sous-familles des Arundinoideae et des Panicoideae. Chez les Arundinoideae, Chloridoideae, Centothecoideae et Panicoideae, l'embryon présente un premier entrenœud, le mésocotyle, situé entre l'insertion du scutellum et le coléoptile[20].
Pollen
.jpg.webp)
Le grain de pollen présente une remarquable uniformité au niveau de la famille : de forme sphéroïdale, il est protégé par une paroi externe, l'exine, mince, lisse et à ornementation réduite ou nulle (absence de plages visqueuses qui permettent aux pollens entomophiles d'adhérer entre eux). Il est monoporé ou monoaperturé (une seule aperture ou pore germinatif, entourée par un anneau épaissi). Il est parfois muni de ballonnets aérifères (sacs résultant d'une expansion de l'exine) qui diminuent leur densité et facilite la pollinisation anémophile). Pulvérulents, secs et de petite taille, généralement entre 10 et 40 μm de diamètre (un diamètre supérieur suggère une domestication de ces plantes)[21], ils sont libérés par les anthères par temps sec, ces propriétés lui confèrent une légèreté favorisant aussi l'anémophilie. La pollinisation entomophile existe cependant : dans les forêts ombrophiles tropicales caractérisées par une canopée agitée par le vent mais un étage inférieur où la vitesse du vent, considérablement freinée, est pratiquement nulle, de nombreux coléoptères consomment divers pollens de Graminées[22].
Conséquence du caractère aléatoire de la pollinisation anémophile, les grains de pollen des Poacées sont produits en grande quantité : le hasard qui préside à leur pollinisation est responsable d'un « gaspillage » phénoménal : « un épillet de seigle libère en un jour 50 000 grains de pollen[23] », et « d'une manière générale, la fécondation d'un seul ovule exige, si la surface stigmatique est de 1 mm2, l'émission d'un million de grains de pollen[24] ».
S'il existe quelques curiosités végétales avec des distance de transport de pollen sur des centaines de kilomètres, la distance efficace moyenne est généralement de quelques mètres, la probabilité qu'un pollen atterrisse sur un stigmate au-delà de cette distance devenant très aléatoire[25].
Pour identifier des taxons à un niveau infra-familial (notamment en paléopalynologie), les chercheurs doivent recourir à des caractères tels que l'ornementation et la texture de l'exine en surface, observables en microscopie électronique à balayage (MEB)[26].
Génétique
Le génome de graminées se caractérise par la variation importante du nombre chromosomique de base selon les espèces, ce nombre pouvant prendre les valeurs x = 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 et 18, l'incidence élevée de la polyploïdie, estimée à 80 %, l'hybridation fréquente et l'ampleur de la variation de la taille du génome, la valeur de l'ADN 2C variant par exemple de 0,7 chez Chloris gayana à 27,6 pg chez Lygeum spartum[27]. Le nombre total de chromosomes varie de 2n = 4 chez Zingeria biebersteiniana à 2n = 266 chez Poa litorosa (espèce polyploïde)[28].
Caryologie
La taille et le nombre des chromosomes ont une grande importance dans la systématique des graminées. Il existe deux types chromosomiques extrêmes : le type « festucoïde » caractérisé par des chromosomes grands et un nombre chromosomique de base principalement égal à x = 7, et le type « panicoïde » avec des chromosomes petits et les nombres de base prédominants x = 9 et x = 10. Le type festucoïde se rencontre chez presque toutes les tribus de la sous-famille des Pooideae, à quelques exceptions près. Par exemple, la tribu des Stipeae a des chromosomes petits et les nombres de base x = 9, 10, 11, 12, 14, 16 et 17. Les autres sous-familles de graminées présentent le type chromosomique panicoïde avec de chromosomes petits et la prédominance des nombres de base x = 9 et 10. Chez les Bambusoideae, Ehrhartoideae et Arundinoideae, les chromosomes sont petits et le nombre de base est x = 12. Chez la sous-famille des Danthonioideae, les chromosomes sont de taille intermédiaire et le nombre de base est x = 6 et 7. La sous-famille des Chloridoideae a des chromosomes petits et plusieurs nombres de base : x = 7, 8, 9, 10, 11, 12 et 14. Les Panicoideae ont toujours des chromosomes petits avec les nombres de base x = 9 et x = 10, bien que certaines espèces présentent d'autres nombres de base, variant de x = 4 à x = 19[10].
Séquençage du génome
Liste des espèces de Poaceae dont le génome a été séquencé :
- Brachypodium distachyon, plante modèle pour les monocotylédones (2010[29])
- Hordeum vulgare, céréale (2012[30])
- Eragrostis tef, céréale secondaire (2014)[31]
- Oryza sativa subsp. indica, céréale, plante-modèle (2002[32])
- Oryza sativa subsp. japonica, céréale, plante-modèle (2002[33])
- Oryza glaberrima var. CG14, céréale (riz africain) (2010[34])
- Phyllostachys heterocycla, bambou moso (2013)[35]
- Setaria italica (2012)[36]
- Sorghum bicolor génotype BTx623, plante cultivée (2009[37])
- Triticum aestivum cv. 'Chinese Spring', céréale (2010[38])
- Triticum urartu engrain (2013)[39]
- Zea mays subsp. mays cv. 'B73', céréale (2009[40])
Biologie
Système reproductif
La plupart des espèces de la famille des Poaceae sont des plantes hermaphrodites qui présentent une fertilisation croisée (plantes allogames) et qui sont pollinisées par le vent (pollinisation anémophile). Ce schéma de reproduction présente cependant de nombreuses exceptions : autogamie, apomixie, cléistogamie, monoécie, diécie...
Apomixie
L'apomixie se définit comme la reproduction asexuelle par l'intermédiaire de graines. Dans ce système reproductif, les embryons se développent par mitose à partir d'une oosphère non réduite, sans qu'ait lieu la fécondation. En d'autres termes, chaque embryon est génétiquement identique à la plante-mère. L'apomixie a été décrite pour la première fois chez les graminées en 1933 chez une espèce de Poa. On a depuis identifié ce mécanisme chez des centaines d'espèces de Poaceae, en particulier chez les Paniceae et chez les Andropogoneae. Parmi les genres comprenant des espèces apomictiques figurent Apluda, Capillipedium, Heteropogon, Themeda, Sorghum, Bothriochloa, Dichanthium, Cenchrus, Setaria et Paspalum[41],[42],[43].
Autocompatibilité
L'autopollinisation et l'autofécondation sont très répandues chez les graminées. En général, c'est un mécanisme plus commun chez les espèces annuelles que chez les espèces vivaces, et beaucoup plus fréquent chez les espèces colonisatrices. Ce mécanisme a été déterminé chez environ 45 genres de graminées, et notamment chez des genres très importants sur le plan économique, tels que Triticum, Oryza, Secale, Avena, Agropyron et Lolium. Un type d'autogamie extrême est la « cléistogamie », dans laquelle la pollinisation et la fécondation se réalisent à l'intérieur même du fleuron, sans que se produise l'anthèse. La cléistogamie est présente chez plus de 70 genres appartenant à 20 tribus de graminées[41],[44].
Bien que majoritairement hermaphrodites de nombreuses espèces de graminées sont incapables de produire des graines quand le pollen d'une plant pollinise ses propres stigmates. Cela est dû au fait qu'un grand nombre de ces espèces présentent une auto-incompatibilité, de type gamétophytique, due à l'action de deux gènes indépendants (appelés S et Z), ayant chacun divers allèles. Ce système d'autoincompatibilité a été observé chez différents genres de la famille (Festuca, Secale, Lolium, Hordeum, Dactylis entre autres) et n'est pas parfaitement efficace. En effet, chez la majorité des espèces auto-incompatibles, on peut obtenir une certaine proportion de graines (même si elle est réduite) par autofécondation d'une plante[41],[45].
Monoécie et diécie
La monoécie est un système reproductif dans lequel les sexes sont séparés (sur des fleurs différentes) mais chaque individu présente des inflorescences mâles et femelles séparées ou parfois des fleurs mâles et femelles distinctes dans des inflorescences mixtes. Zea, Humbertochloa, Luziola, Ekmanochloa et Mniochloa sont des exemples de genres comprenant des espèces monoïques.
Beaucoup plus communes chez les graminées sont les espèces « andromonoïques », en particulier chez les Andropogoneae et les Paniceae. Chez les premières, les deux sexes se présentent sur des épillets différents en paires hétérogames. Une paire hétérogame d'épillets consiste généralement en un épillet sessile, avec une fleur neutre et une fleur hermaphrodite, et un épillet pédicellé, avec une fleur neutre et une fleur mâle. Chez les épillets biflores des Paniceae, en revanche, la fleur inférieure est généralement mâle ou neutre, et la fleur supérieure est hermaphrodite. Parmi les genres qui comprennent des espèces andromonoïques figurent notamment : Alloteropsis, Brachiaria, Cenchrus, Echinochloa, Melinis, Oplismenus, Panicum, Setaria, Whiteochloa et Xyochlaena. Certaines espèces de ces genres peuvent avoir seulement des fleurs hermaphrodites puisque la fleur inférieure est toujours neutre. Il est rare que les deux fleurs soient hermaphrodites. Outre les Paníceae et les Andropogoneae, les Arundinelleae sont une autre tribu comprenant des espèces andromonoïques. Dans le reste de la famille, les espèces andromonoïques se rencontrent de façon très sporadique, comme chez les genres Arrhenatherum, Hierochloe et Holcus[41].
La diécie est un type de système reproductif, dans lequel des fleurs mâles et femelles sont portées par des individus différents est assez rare chez les graminées. Seuls 18 genres sont dioïques (ou comprennent des espèces dioïques), parmi lesquels le genre Poa est le plus connu. En fait, les espèces dioïques de Poa ont été classées dans un sous-genre particulier, Dioicopoa[41].
La gynodiécie est un système reproductif dans lequel coexistent des individus femelles et des individus hermaphrodites. Ce système est rare chez les graminées. Bouteloua chondrosioides et quelques espèces du sous-genre Poa subgen. Andinae sont gynodioïques, même si Cortaderia est l'exemple le plus remarquable[41].
Composition chimique

Glucides
Les graines (caryopses) sont riches en amidon, qui peut se présenter sous forme de grains d'amidon individuels (seigle, blé, orge) ou de plusieurs grains d'amidon composites (avoine).
Les graminées accumulent aussi dans les rhizomes et autres organes végétatifs de l'amidon, du saccharose ou des fructanes. Les fructanes se présentent, outre le type inuline non ramifié, sous la forme de type phléine ramifié. Le type de fructane qui dépend du degré de polymérisation est souvent caractéristique de l'espèce[46].
Protéines
Les grains de céréales (caryopses) contiennent de 10 à 15 % de protéines (en pourcentage de matière sèche), dont la moitié environ sont des protéines de réserve, présentes principalement dans la couche externe de l'albumen (couche d'aleurone) et dans l'embryon. Ces parties de la graine sont souvent ôtées lors de la mouture du blé ou du polissage du riz. Les protéines de réserve sont principalement de l'albumine, des globulines, des glutélines (solubles uniquement dans des acides et bases dilués) et des prolamines (solubles dans l'éthanol à 70-80 %). Les prolamines, qui forment la principale fraction des protéines de réserves des principales céréales (à l'exception de l'avoine et du riz), sont déficientes en certains acides aminés essentiels : lysine, thréonine et tryptophane (en particulier chez le maïs)[47].
Silice
De la silice (sous forme de particules opalines de dioxyde de silicium), ou phytolithes, est souvent stockée dans l'épiderme foliaire chez de nombreuses espèces de graminées, notamment le riz. Cet élément peut représenter de 2 à 5 % de la matière sèche totale chez certaines espèces, soit 10 à 20 fois plus que chez les dicotylédones. La présence de silice dans les feuilles serait un mécanisme de défense contre les herbivores, vertébrés ou invertébrés, d'une part en augmentant leur caractère abrasif et d'autre part en réduisant leur digestibilité[48].
Glycosides cyanogènes
Certaines espèces de graminées produisent des glycosides cyanogènes, notamment la dhurrine chez le sorgho, qui sont susceptibles d'être hydrolysés dans certaines conditions et de produire de l'acide cyanhydrique. La synthèse de ces métabolites secondaires est vraisemblablement liée à une stratégie de défense de ces plantes contre les herbivores[49].
Accumulation de nitrates
Des espèces de graminées, telles que la fétuque, le brome, le dactyle pelotonné, le raygrass, le maïs, les sorghos fourragers et le mil à chandelle (Pennisetum glaucum) sont susceptibles dans certaines conditions d'accumuler des nitrates, ce qui peut les rendre toxiques pour les animaux herbivores. Ce phénomène peut se produire lorsque les plantes poussent sur des sols riches en nitrates, mais que les conditions ne sont pas réunies pour une métabolisation normale et la transformation de ces nitrates en protéines, par exemple en cas de sécheresse, de temps trop froid, ou quand les plantes sont flétries, comme après l'application d'herbicides[50],[51].
Écologie
Distribution et habitat
Les Poacées sont une des familles les plus cosmopolites. On les trouve sur tous les continents, y compris en Antarctique[52], depuis les zones équatoriales jusqu'aux cercles polaires et depuis les bords de mer jusqu'au sommet des montagnes.


Cette famille de plantes très « sociables » représente environ 24 % de la couverture végétale du globe terrestre. Elles sont l'élément dominant de plusieurs formations végétales très étendues comme les steppes eurasiennes, la savane et le veld en Afrique, la pampa en Amérique du Sud, la Prairie américaine et les pelouses alpines. Elles ont permis le développement de toute une faune herbivore. En dehors des prairies herbacées, les bambous ligneux jouent un rôle central dans les forêts en Asie tropicale et tempérée.
On rencontre les graminées aussi bien dans les déserts que dans des habitats aquatiques d'eau douce ou marine, et à pratiquement toutes les altitudes, sauf les plus élevées de la planète.
De vastes biomes naturels dominés par les graminées se sont développés dans le monde, caractérisés aussi bien par des sècheresses périodiques, que par des reliefs plane ou accidentés, par l'occurrence d'incendies fréquente, par certaines conditions particulières de sols ou par la pression du broutage et du pâturage.
Insectes
De nombreuses chenilles, comme celles des papillons de nuit suivants, se nourrissent de graminées :
- le Bombyx buveur (Euthrix potatoria, Lasiocampidae),
- le Cisseps à col orangé (Cisseps fulvicollis, Erebidae),
- la Soyeuse (Rivula sericealis, Erebidae).
- la Méticuleuse (Phlogophora meticulosa, Noctuidae),
- la Monoglyphe (Apamea monoglypha, Noctuidae),
Champignons phytopathogènes

Les graminées sont parasitées par diverses espèces de champignons pathogènes provoquant d'importantes maladies telles que les rouilles, les charbons et les ergots, bien connues chez le céréales, les graminées fourragères et les graminées à gazon[53]. Parmi les genres de champignons pathogènes les plus importants figurent les suivants : Alternaria, Aspergillus, Botrytis, Claviceps, Fusarium, Helminthosporium, Penicillium, Puccinia, Rhizopus, Septoria, Stachybotrys, Ustilago.
Champignons endophytes
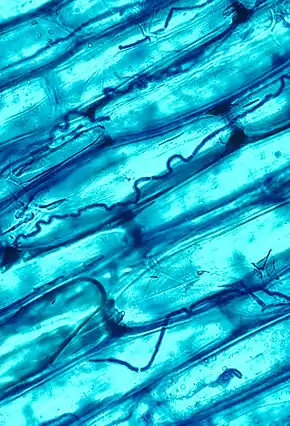
Les champignons endophytes des graminées appartiennent à la famille des Clavicipitaceae (Ascomycètes) et se développent dans les tissus végétaux dans l'espace intercellulaire. Ils se rencontrent dans toutes les sous-familles des Poaceae et sont parfois pathogènes, mais les plus fréquents, appartenant en particulier au genre anamorphe Neotyphodium, forment des symbioses mutualistes avec les plantes, principalement chez les Pooideae à photosynthèse en C3. La plupart des champignons endophytes synthétisent des alcaloïdes qui jouent un rôle dans la défense des plantes-hôtes contre les prédateurs phytophages et herbivores[53].
Mycorhizes
Les mycorhizes, qui sont des associations symbiotiques au niveau des racines, sont très répandues chez les graminées, et sont pour la plupart des « endomycorhizes »[53].
Bactéries
Diverses espèces de bactéries fixatrices de l'azote (ou diazotrophes) sont associées à des graminées, notamment des céréales, la canne à sucre et diverses espèces fourragères. Pratiquement toutes ces bactéries sont des organismes microaérophiles, fixant le diazote (N2) uniquement en présence de faibles pressions partielles d'oxygène. Ces bactéries, appartenant notamment aux genres Azospirillum, Acetobacter, et Herbaspirillum, sont associées (endophytes) aux graminées au niveau des racines principalement, mais aussi des tiges ou des feuilles, et peuvent apporter une contribution agronomique significative pour la fixation de l'azote atmosphérique[54].
D'autres bactéries sont des organismes phytopathogènes. Différents pathovars de Xanthomonas translucens provoquent des flétrissements bactériens.
Évolution et classification
Évolution
Les graminées comprennent certaines des formes de vie végétale parmi les plus polyvalentes. Elles se sont répandues vers la fin du Crétacé, et on a retrouvé des déjections fossilisées (coprolithes) de dinosaures contenant des phytolithes provenant notamment de plantes apparentées aux espèces modernes de riz et de bambous[55]. Les graminées se sont adaptées à des conditions de milieu très variées, des forêts humides luxuriantes comme des déserts arides, des montagnes au climat froid et même à l'écologie particulière de l'estran, et sont actuellement le type de plantes le plus répandu dans le monde. Elles sont une source précieuse de nourriture et d'énergie pour toutes sortes d'organismes de la faune et la flore sauvage. Les fossiles découverts jusqu'en 2005 indiquaient que l'évolution des graminées avait commencé il y a environ 55 millions d'années. La découverte récente de phytolithes graminoïdes dans des coprolithes de dinosaures du Crétacé a permis de repousser cette date jusqu'à 66 millions d'années[56],[57]. En 2011, une révision de la datation des origines de la tribu des Oryzeae (les riz) a reporté celle-ci entre 107 et 129 millions d'années[58]. La découverte, en 2014, du squelette fossilisé d'un mammifère herbivore multituberculé, présentant des adaptations à la consommation des graminées, semble suggérer que ces plantes existaient déjà il y a environ 120 millions d'années[59].
Les relations entre les trois sous-familles, Bambusoideae, Oryzoideae et Pooideae du clade BEP ont été résolues : les Bambusoideae et les Pooideae sont plus étroitement liées entre elles qu'avec les Oryzoideae[60]. Cette séparation est intervenue dans un laps de temps relativement court d'environ 4 millions d'années.
Phylogénie
Les analyses phylogéniques à l'aide de séquences exprimées de l'ADN et la structure générale des génomes suggèrent que les graminées diffèrent beaucoup plus des autres monocotylédones que ces dernières des dicotylédones[61]. De telles conclusions sur les relations des Poaceae avec les autres familles de monocotylédones et avec les dicotylédones ne sont pas surprenantes. En fait, les graminées sont facilement à reconnaitre et à distinguer de toute autre famille, et leur monophylie est soutenue tant par la morphologie que par les analyses moléculaires de l'ADN. Les caractères phénotypiques qui soutiennent la monophylie de la famille sont l'inflorescence avec des bractées, le périanthe réduit, le type de fruit et les caractères de l'embryon et de la paroi du grain de pollen. Les similitudes avec les carex (Cyperaceae) dans le port général des plantes et dans le type d'épillets résultent d'une évolution convergente, et pas d'une synapomorphie. En fait, les Cypéracées sont plus apparentées aux joncs (Juncaceae) qu'aux graminées, qui appartiennent au noyau des Poales.
L'importance économique et écologique de la famille a conduit à la réalisation d'un nombre important d'études de systématique. Au début du XIXe siècle, les différences entre les épillets des Pooideae et des Panicoideae ont conduit le botaniste anglais Robert Brown à subdiviser la famille dans ces deux groupes de base. Au début du XXe siècle, les caractères de l'épiderme des feuilles et le nombre de chromosomes ont conduit à séparer les Chloridoideae des Pooideae. Au milieu du XXe siècle, l'anatomie interne de la feuille (en particulier la présence ou l'absence de l'anatomie de type kranz et les caractères de l'embryon (présence ou absence de l'épiblaste et certains caractéristiques du nœud cotylédonaire), ont conduit à la reconnaissance de cinq à huit sous-familles. Depuis la fin du XXe siècle, les études phylogénétiques à partir de plusieurs séquences de gènes ont conduit à des résultats compatibles avec la plupart des relations phylogénétiques précédemment inférées à partir de caractères structurels et physiologiques. Les études moléculaires les plus avancées soutiennent la reconnaissance de 12 ou 13 sous-familles[62],[63],[64],[65],[66].
| Cladogramme des Poaceae | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| selon le Grass Phylogeny Working Group II (entre parenthèses, nombre approximatif d'espèces). |
Les trois premières lignées qui ont divergé sont les Anomochlooideae (originaire du Brésil), les Pharoideae (originaire des régions tropicales de l'Ancien et du Nouveau Monde) et les Puelioideae (originaires d'Afrique de l'Ouest). Les membres de ces trois groupes ne représentent qu'environ 30 des quelque 12 000 espèces de la famille. Le reste des espèces est réparti en deux grands groupes ou clades : le clade BEP (ou BOP) regroupe les Bambusoideae, Oryzoideae et Pooideae ; le second, appelé clade PACMAD (ou PACCMAD), regroupe les Panicoideae, Arundinoideae, Chloridoideae, Micrairoideae, Centothecoideae, Aristidoideae et Danthonioideae[67]. Le clade PACMAD est soutenu par un caractère de l'embryon : un entre-nœud long dans le mésocotyle. L'anatomie C3 est l'état plésiomorphe ou ancestral de la famille. Toutes les espèces à photosynthèse en C4 se trouvent dans le clade PACMAD.
Toutes les sous-familles mentionnées sont monophylétiques, bien que seules quelques-unes aient des synapomorphies morphologiques qui caractérisent tous leurs membres. De plus, leur monophylie est soutenue par des groupes de caractères morphologiques qui doivent être observés dans leur ensemble. Les relations au sein des grands clades PACMAD et BEP sont pour la plupart encore peu claires, en effet la position des Pooideae n'est pas claire dans certaines analyses[68],[69]. Le cladogramme ci-contre montre les relations entre les 12 clades mentionnés[66] :
 Bambou géant (Dendrocalamus giganteus, Bambusoideae).
Bambou géant (Dendrocalamus giganteus, Bambusoideae). Folle-avoine (Avena fatua, Pooideae).
Folle-avoine (Avena fatua, Pooideae). Canne à sucre (Saccharum officinarum, Panicoideae).
Canne à sucre (Saccharum officinarum, Panicoideae). Canne de provence (Arundo donax, Arundinoideae).
Canne de provence (Arundo donax, Arundinoideae). Herbe de la pampa (Cortaderia selloana, Danthonoideae).
Herbe de la pampa (Cortaderia selloana, Danthonoideae).
Systématique
La famille des Poaceae, ou Graminae, est classée parmi les plantes monocotylédones, dans l'ordre des Poales. Les graminées sont des Angiospermes (Magnoliopsida). À la différence des Gymnospermes, chez les Angiospermes, l'ovule est enfermé dans l'ovaire. Elle comprend environ 12 000 espèces regroupées en 780 genres[70]. C'est la cinquième famille botanique, par le nombre d'espèces, après les Asteraceae, Orchidaceae, Fabaceae et Rubiaceae[71].
Les Poaceae sont subdivisées en douze sous-familles de tailles très inégales, elles-mêmes subdivisées en 51 tribus. Le genre type de la famille des Poaceae est Poa (les pâturins). Les genres les plus représentatifs, en nombre d'espèces, sont les suivants : Panicum (500 espèces), Poa (500), Festuca (450), Eragrostis (350), Paspalum (330) et Aristida (300)[72].
Vue d'ensemble de la classification avec les principaux genres
Lignées basales
.jpg.webp) Pharus latifolius, sous-famille des Pharoideae.
Clade BEP
 Riz (Oryza sativa), sous-famille des Ehrhartoideae.  Aristida acuta, sous-famille des Aristidoideae.  Blé tendre (Triticum aestivum), sous-famille des Pooideae.
Clade PACMAD
 Port, feuilles et inflorescences de Cortaderia jubata, sous-famille des Danthonioideae.
 Canne de Provence (Arundo donax), sous-famille des Arundinoideae.  Eragrostis cilianensis, sous-famille des Chloridoideae.  Sorgho commun (Sorghum bicolor, sous-famille des Panicoideae.
|
Importance économique



.jpg.webp)
La famille des graminées occupe une place essentielle dans l'économie mondiale et certaines espèces sont vitales pour l'alimentation de l'homme et de son bétail. Au niveau mondial, environ 70 % de la superficie cultivée est emblavée avec des graminées et 50 % des calories consommées par l'humanité proviennent des nombreuses espèces de graminées utilisées directement dans notre alimentation ou bien, indirectement dans l'alimentation des animaux d'élevage, en fourrage ou en grains. Les quatre espèces de plantes cultivées les plus importantes en volume de production sont des graminées : canne à sucre (Saccharum officinarum), maïs, blé, riz. l'orge et le sorgho figurent parmi les douze premières. D'autre part, diverses espèces de graminées sont utilisées dans l'industrie et pour la production d'énergie.
Alimentation humaine
.jpg.webp)

Ce sont principalement les céréales dont on consomme les grains (caryopses) soit entiers, soit moulus sous forme de farine, de semoule ou de gruau. Ces plantes sont cultivées depuis au moins 10 000 ans. Depuis le début de leur domestication, le blé tendre (Triticum aestivum), l'orge (Hordeum vulgare) et l'avoine (Avena sativa) dans le croissant fertile au Proche-Orient, le sorgho (Sorghum bicolor) et le mil ([Pennisetum glaucum) en Afrique, le riz (Oryza sativa) dans le sud-est de l'Asie et le maïs (Zea mays) en Méso-Amérique, ont rendu possible l'établissement de communautés humaines et le développement de civilisations. Les céréales cultivées occupent la moitié du total des terres arables et ont produit près de 3 milliards de tonnes en 2017[75]. Le blé (sous-famille des Pooideae, en particulier le blé tendre Triticum aestivum), qui a commencé à être domestiqué il y a plus de 11 000 ans, fournit le cinquième des calories consommées par l'homme. La plupart des formes domestiquées sont polyploïdes, et la plasticité du génome en connexion avec la polyploïdie explique le succès de la culture de cette céréale[76]. Il est énormément utilisé en boulangerie, viennoiserie, pâtisserie et en cuisine (sauces, desserts). Le blé dur (Triticum durum) est utilisé pour produire la semoule, le boulghour et les pâtes alimentaires. Le maïs (Zea mays, sous-famille des Panicoideae) est une céréale aux multiples applications, de la consommation directe comme « maïs doux », à la production de farine pour la préparation de nombreux plats et même de boissons alcoolisées. Le riz (Oryza sativa, Oryzoideae) est l'espèce la plus importante en alimentation humaine. L'avoine (Avena sativa, Pooideae), l'orge (Hordeum vulgare) et le seigle (Secale cereale) sont trois autres céréales couramment utilisées comme aliments.
Des céréales anciennement cultivées comme l'engrain et l'épeautre reprennent une place en alimentation diététique et biologique.
Outre les céréales, les graminées alimentaires comptent certaines espèces de bambous, comme Phyllostachys edulis et Sinocalamus beecheyanus dont on consomme les jeunes pousses comme légumes en Asie[9].
La canne à sucre, première culture mondiale par l'importance des tonnages récoltés (1,3 milliard de tonnes en 2008[77]), est la première source de sucre.
Alimentation animale

De nombreuses espèces de graminées permettent de produire du fourrage pour le bétail, tant dans les prairies naturelles que dans les prairies cultivées permanentes ou temporaires, pâturées, fanées ou ensilées. On cultive à cet effet de nombreuses espèces de graminées vivaces, aussi bien dans les climats tempérés que dans les climats tropicaux ou subtropicaux. Les espèces fourragères des régions tempérées produisent de l'herbe principalement au printemps et en automne. Les espèces les plus courantes[78] sont le ray-grass anglais (Lolium perenne), le ray-grass d'Italie (Lolium multiflorum), le ray-grass hybride (Lolium ×hybridum), le dactyle (Dactylis glomerata), la fétuque élevée (Festuca arundinacea), la fétuque des prés (Festuca pratensis), la fléole des prés (Phleum pratense), plusieurs espèces de bromes dont Bromus unioloides (espèce endémique d'Amérique du Sud), Thinopyrum ponticum, et l'alpiste tubéreux (Phalaris aquatica). Les graminées cultivées comme plantes fourragères vivaces provenant des climats tropicaux ou subtropicaux ont une production d'été et parmi elles figurent Paspalum dilatatum, Panicum elephantypes, l'Herbe de Rhodes (Chloris gayana), le mil à chandelle (Pennisetum glaucum), l'herbe de Bahia (Paspalum notatum) et Eragrostis curvula.
Certaines espèces annuelles sont utilisées pour produire de grandes quantités de fourrage en une seule récolte. Parmi les espèces d'hiver figurent les avoines (Avena fatua, Avena sativa), le seigle (Secale cereale), le triticale et certaines variétés de ray-grass d'Italie. Pour les espèces d'été, on utilise le maïs, le sorgho fourrager (Sorghum sudanense) et le moha (setaria italica).
En outre, les céréales sont utilisées en grains pour nourrir les animaux : chevaux, ruminants, porcs, volailles; c'est le cas du millet commun (Panicum miliaceum) et de l'alpiste (Phalaris arundinacea) pour nourrir des oiseaux[9],[79]. Le maïs grain est largement utilisé pour l'alimentation des porcs. Le maïs et le sorgho sont aussi cultivés comme plantes fourragères, récoltées en plantes entières, elles sont souvent conservées en ensilage.
Graminées à usage industriel

Les utilisations industrielles des graminées sont aussi variées que la famille en elle-même.
Parfums
Les espèces à parfum, dont des extraits sont utilisés dans la préparation de nombreux parfums, tels que la citronnelle (Cymbopogon citratus), dont on extrait une essence appelé huile de citronnelle et le vétiver (Chrysopogon zizanioides).
Malts et boissons alcoolisées
D'autres graminées, principalement l'orge brassicole (Hordeum vulgare), sont utilisées pour la préparation de malt utilisés par les industries alimentaires, surtout dans la fabrication de boissons alcoolisées par fermentation, telles que la bière, le whisky, le gin, la vodka, le genièvre, etc[80], les succédanés de café (malt torréfié) et des préparations diverses (extraits de malt). Le saké (ou nihonshu) est élaboré à partir du riz au Japon. Le Bourbon est élaboré à partir d'un malt à 51 % de maïs au moins, selon la règlementation fédérale américaine[81], généralement 70 %.
Selon les pays, on fabrique bières, et alcools après distillation d'un moût fermenté analogue à la bière, à partir des grains disponibles localement. Le malt d'orge constitue généralement la base de ces préparations mais l'orge peut être remplacée ou mélangée à n'importe quelle autre céréale. On rajoute parfois des grains non maltés cuits ou crus avant brassage pour des goûts particuliers.
Huilerie
L'industrie huilière utilise également des grains pour produire des huiles alimentaires ou non, comme l'huile de maïs, l'huile de germe de blé.

Amidons, mélasses et sucres
Voir Amidon#Utilisations industrielles
Les industries (alimentaires ou non) utilisent les amidons, les sucres et sirops issus des céréales comme matières premières ou adjuvants.
Carburants et alcools industriels
Le biogazole peut être produit à partir de céréales comme le maïs. Le bioéthanol peut être fabriqué à partir de canne à sucre.
Fibres et matériaux de construction
Diverses espèces de graminées sont exploitées pour leurs fibres. L'alfa et certaines espèces de bambous permettent de produire de la pâte à papier. On extrait de certains bambous une matière première textile, la fibre de bambou. Certains genres ont un grand intérêt en sparterie, vannerie et pour la fabrication de chaussures traditionnelles, comme les espadrilles. Tel est le cas du sparte (Lygeum spartum), et surtout de l'alfa (Stipa tenacissima), qui sont tous deux utilisés en Espagne et dans le nord de l'Afrique pour produire le spart, matière première pour la fabrication de tous ces éléments, et de la canne flèche (Gynerium) en Amérique du Sud.
En outre, on utilise des espèces telles que Sorghum bicolor pour faire des balais, Epicampes microura et Aristida pallens pour faire des brosses et Stipa tenacissima pour produire des éponges[9].

Les bambous fournissent avec leur tiges épaisses un matériau apprécié dans le secteur de la construction (échafaudages, lamellé-collé) et une matière première pour la production de meubles et de divers objets artisanaux.
Pailles
Les graminées utilisées pour leur grain (céréales mais aussi les cultures destinées à la production de semences) sont battues pour récupérer le grain, il reste alors la paille. Celle-ci est traditionnellement utilisée pour la confection des litières et comme fourrage pour les ruminants en cas de pénurie. Cependant, ses usages sont très variés : composts, toîtures en chaumes, combustible, vannerie, etc.
Graminées à gazon
De nombreuses espèces des genres Poa, Lolium, Festuca, Axonopus, Stenotaphrum et Paspalum, sont utilisées pour créer des pelouses dans les parcs et jardins, terrains de sport, espaces verts, et pour la végétalisation des talus de routes et voies ferrées. Agrostis capillaris et Agrostis stolonifera, en particulier, sont utilisés pour les « greens » des parcours de golf[9].
Autres
Outre les graminées à gazon, de nombreuses graminées vivaces de grande taille sont devenues de plus en plus populaires pour constituer des éléments centraux dans la conception des parcs et jardins. Cela s'explique non seulement par leurs caractéristiques de longévité, d'adaptation, de rusticité et de facilité d'entretien, mais aussi par leur valeur ornementale ou par des qualités esthétiques particulières liées aux mouvements, à la transparence, à l'éclairage et aux changements saisonniers spectaculaires. Parmi les espèces utilisées comme plantes ornementales figurent notamment Alopecurus pratensis, Cortaderia selloana (Herbe de la pampa), Festuca glauca, Imperata cylindrica, Leymus condensatus, Miscanthus sinensis, Pennisetum setaceum et Phyllostachys aurea[82].
Production de biomasse

Différentes espèces de Poaceae sont exploitées pour la production d'énergie. On cultive certaines graminées vivaces, telles que Panicum virgatum, Spartina pectinata, Phalaris arundinacea[83], Miscanthus ×giganteus[84], spécifiquement pour la production de biomasse. On utilise comme combustible des sous-produits de céréales comme la paille et la balle, de la canne à sucre (bagasse) ou de l'industrie de transformation des bambous. On cultive aussi des céréales (maïs, sorgho notamment) et la canne à sucre pour la production de bio-éthanol, notamment aux États-Unis et au Brésil. Certaines espèces de bambou sont aussi cultivées pour la production d'énergie principalement en Asie, soit par combustion directe comme c'est le cas traditionnellement, soit par conversion en d'autres formes d'énergie (cogénération d'électricité, gaséification, pyrolyse, etc)[85].
Autres utilisations
Différentes espèces de graminées sont utilisées pour lutter contre l'érosion et comme fixatrices des dunes. Les espèces suivantes, par exemple, sont utilisées à cet effet : Sporobolus arundinaceus, Panicum urvilleanum, Spartine ciliata, Poa lanuginosa, Ammophila arenaria, Elymus arenarius et Arundo donax (canne de Provence).
D'autres espèces comme le ray-grass d'Italie (Lolium italicum), le moha (Setaria italica), le seigle (Secale cereale) sont utilisées comme engrais verts ou comme cultures intermédiaires destinées à piéger les nitrates.
Certains instruments de musique sont fabriqués avec des cannes de graminées, notamment des bambous, c'est le cas de certaines flûtes en utilisant Rhipidocladum harmonicum[86].
La majorité des Poaceae a des feuilles et tiges comestibles. Les enfants aiment à mâchonner la partie inférieure, tendre et juteuse, à la base de leur tige[87].
D'autres espèces, telles le chiendent officinal (Elymus repens) et le chiendent pied-de-poule (Cynodon dactylon), ont été utilisées pendant des siècles comme plantes médicinales en particulier comme diurétiques.
Les Poacées peuvent être utilisées pour pratiquer de la musique verte[88] : sifflet d'herbe en tirant des sons stridents des feuilles[89], hautbois à une anche avec la tige[90].
Ils sont également utilisés pour des jeux buissonniers entre des garçons et des filles : des espèces comme l'orge des rats ont les arêtes des épillets qui empêchent l'épi de glisser en arrière. En plaçant cet épi entre leurs bras ou dans leur manche, à chaque mouvement du bras, il remonte seul, jusqu'à venir piquer l'aisselle[91].
Graminées adventices
De nombreuses espèces de graminées sont des mauvaises herbes des cultures. Certaines d'entre elles sont très difficiles à éradiquer ou à maîtriser, et causent d'importantes pertes de rendement en concurrençant les espèces végétales cultivées. C'est le cas par exemple du sorgho d'Alep (Sorghum halepense), du chiendent pied-de-poule (Cynodon dactylon) , du panic pied-de-coq (Echinochloa crus-galli), de la digitaire sanguine (Digitaria sanguinalis) et de Brachiaria extensa[92]. Cinq espèces de graminées adventices (Cynodon dactylon, Echinochloa colona, Eleusine indica, Sorghum halepense, Imperata cylindrica) figurent parmi les dix « pires » mauvaises herbes sur le plan mondial[4].
Un cas particulier est celui des riz nuisibles qui sont des espèces voisines du riz cultivé, appartenant au même genre Oryza, voire des variétés de la même espèce, Oryza sativa, retournées à l'état sauvage et difficiles à extirper des rizières du fait de leur proximité biologique avec la plante cultivée. Ces riz adventices sont connus sous le nom de « riz crodo » en Camargue[93].
Diverses populations de graminées adventices ont été signalées comme résistantes à des herbicides. C'est le cas des espèces suivantes : Agrostis stolonifera, Alopecurus aequalis, Alopecurus japonicus, Alopecurus myosuroides, Apera spica-venti, Alopecurus aequalis, Avena fatua, Avena sterilis, Brachiaria eruciformis, Brachypodium distachyon, Bromus diandrus, Bromus japonicus, Bromus rubens, Bromus secalinus, Bromus sterilis, Bromus tectorum, Chloris barbata, Chloris elata, Chloris truncata, Chloris virgata, Cynodon hirsutus, Cynosurus echinatus, Digitaria ciliaris, Digitaria ciliaris, Digitaria insularis, Digitaria ischaemum, Digitaria sanguinalis, Echinochloa colona, Echinochloa colona, Echinochloa crus-galli, Echinochloa crus-pavonis, Echinochloa erecta, Echinochloa oryzoides, Echinochloa phyllopogon, Ehrarta longiflora, Eleusine indica, Hordeum murinum, Ischaemum rugosum, Ixophorus unisetus, Leptochloa chinensis, Leptochloa panicoides, Leptochloa scabra, Leptochloa virgata, Lolium perenne, Lolium persicum, Lolium rigidum, Oryza sativa var. sylvatica, Panicum capillare, Panicum dichotomiflorum, Paspalum paniculatum, Phalaris brachystachys, Phalaris minor, Phalaris paradoxa, Polypogon fugax, Polypogon monspeliensis, Rostraria smyrnacea, Polypogon fugax, Rottboellia cocinchinensis, Sclerochloa dura, Sclerochloa kengiana, Setaria faberi, Setaria pumila, Setaria verticillata, Setaria viridis, Sorghum bicolor, Sorghum halepense, Sporobolus fertilis, Urochloa panicoides, Urochloa plantaginea, Vulpia bromoides[94].
L'ivraie enivrante (Lolium temulentum), adventice des champs de blé, est citée dans le Nouveau Testament (Matthieu 13, 24-30 et 36-38) dans la « parabole de l'ivraie et du bon grain ». Elle est à l'origine de l'expression « semer la zizanie » (de zizania, nom latin de la plante ou Zizanion en grec ancien langue originale des évangiles)[95],[96].
Graminées toxiques
Les graminées peuvent se révéler toxiques surtout pour les animaux herbivores dont elles constituent l'essentiel de l'alimentation. Cette toxicité peut être d'origine intrinsèque du fait de substances toxiques synthétisées ou accumulées par les plantes, soit extrinsèque par suite d'infections fongiques essentiellement.
Les substances toxiques accumulées par la plante peuvent être par exemple des oxalates, des alcaloïdes, des glycosides cyanogènes, des saponosides, etc[97].
L'infection par des champignons endophytes ou parasites peut provoquer chez différentes espèces de graminées des toxicités dangereuses pour l'alimentation humaine ou animale. C'est le cas par exemple de mycotoxines telles que celle produites par l'ergot du seigle ou certaines fusarioses.
Graminées allergisantes
Les graminées, du fait qu'elles sont très répandues sur toute la planète et qu'elles sont pollinisées par le vent, sont la famille de plantes qui produit le plus de pollen allergisant, provoquant chez l'homme diverses affections (pollinose, rhinite allergique). Les espèces les plus allergisantes appartiennent principalement à cinq sous-familles : Pooideae (Festucoideae), Chloridoideae (Eragrostoideae), Panicoideae, Arundinoideae et Oryzoideae. La morphologie très uniforme des grains de pollen de graminées ne permet pas de les distinguer facilement à un niveau infra-familial, sauf pour les variétés cultivées qui ont des grains de pollen plus gros que les types sauvages[98].
Notes et références
- Tropicos.org. Missouri Botanical Garden., consulté le 28 novembre 2017
- (en) Robert J. Soreng, Paul M. Peterson, Konstantin Romaschenko, Gerrit Davidse, Fernando O. Zuloaga, Emmet J. Judziewicz et Tarciso S. Filgueiras, « A worldwide phylogenetic classification of the Poaceae (Gramineae) », Journal of Systematics and Evolution, vol. 53, no 2, , p. 117–137 (ISSN 1674-4918, DOI 10.1111/jse.12150).
- (en) S.G. Reynolds, « Grassland of the world », sur www.fao.org (consulté le ).
- (en) Holm, L. R. G., Plucknett, D. L., Pancho, J. V., Herberger, J. P, « The world's worst weeds. Distribution and biology », sur www.cabi.org, University Press of Hawaii Honolulu, (consulté le ).
- Cyril Langlois, « Les Poacées (Graminées), nourriture des dinosaures au Crétacé », sur Planet-Terre (ENS de Lyon), (consulté le ).
- (en) J.H. Barnhart, « Poaceae », Bulletin of the Torrey Botanical Club, vol. 22, , p. 7.
- (en) « International Code of Nomenclature for algae, fungi, and plants (Melbourne Code)Section 2. Names of families and subfamilies, tribes and subtribes - Article 18 », International Association for Plant Taxonomy (IAPT), (consulté le ).
- (en) David J. Gibson, Grasses and grassland ecology, Oxford University Press, coll. « Oxford biology », , 305 p. (ISBN 978-0-19-852918-7, lire en ligne), p. 36-64.
- (es) « Gramíneas », dans Parodi, L.R., Enciclopedia Argentina de Agricultura y Jardinería - Descripción de plantas cultivadas, vol. 1, Buenos Aires, Editorial ACME S.A.C.I., , p. 108-182.
- (es) Cabrera, A. L., Cámara Hernández, J., Caro, J.; Covas, G.; Fabris, H., Hunziker, J., Nicora, E., Rugolo, Z., Sánchez, E., Torres, M., Gramineae, parte general : Flora de la Provincia de Buenos Aires, vol. 4, INTA, coll. « Colección Científica del INTA. », , p. 1-18.
- Lodicules au nombre de deux le plus souvent, parfois une ou trois chez les bambous.
- Philippe Jauzein et Jacques Montégut, Graminées (Poaceae) nuisibles en agriculture, SECN (société d'éditions champignons et nature), , 538 p. (ISBN 978-2-904355-02-8, ASIN B00MRYFBQU), p. 26-36.
- Pierre Crété, Précis de botanique. Systématique des angiospermes, Masson & Cie, , p. 33
- (en) « Anatomy and Morphology of the Poaceae [Gramineae] –Grass Familly », sur nebula.wsimg.com (consulté le ).
- (en) Nirmal Sinha, Jiwan Sidhu, Jozsef Barta, James Wu, M.Pilar Cano, Handbook of Fruits and Fruit Processing, John Wiley & Sons, , 694 p. (ISBN 978-1-118-35263-2, lire en ligne).
- (en) Elizabeth A. Kellogg, Flowering Plants. Monocots : Poaceae, vol. 13, Cham, Springer, coll. « The Families and Genera of Vascular Plants », , 416 p. (ISBN 978-3-319-15332-2, lire en ligne), p. 69-72.
- (en) Paula Rudall, Soejatmi Dransfield, « Fruit Structure and Development in Dinochloa and Ochlandra (Gramineae-Bambusoideae) », Annals of Botany, vol. 63, no 1, , p. 29–38 (lire en ligne).
- Servane Chauchix et Hector Pouillet, Graines des Antilles, PLB Editions, , 128 p. (ISBN 978-2-35365-008-8)
- (en) Zhenghao Xu et Guoning Zhou, Identification and Control of Common Weeds, t. 1, Springer, , 459 p. (ISBN 978-94-024-0954-3, lire en ligne), p. 353-356.
- (en) Víctor L. Finot, Juan A. Barrera, Clodomiro Marticorena et Gloria Rojas, « Systematic diversity of the family Poaceae (Gramineae) in Chile », dans Oscar Grillo et Gianfranco Venora, Environmental Sciences "The Dynamical Processes of Biodiversity - Case Studies of Evolution and Spatial Distribution", (ISBN 978-953-307-772-7, DOI 10.5772/23346, lire en ligne).
- (en) Junwu Shu, Weiming Wang, Leping Jiang, Hikaru Takahara, « Early Neolithic vegetation history, fire regime and human activity at Kuahuqiao, Lower Yangtze River, East China: New and improved », Quaternary International, vol. 227, no 1, , p. 10-21 (DOI 10.1016/j.quaint.2010.04.010)
- Pierre-Paul Grassé, Traité de zoologie : anatomie, systématique, biologie, Masson, , p. 928
- Paul Pesson et Jean Louveaux, Pollinisation et productions végétales, éditions Quæ, , p. 92
- Paul Pesson et Jean Louveaux, Pollinisation et productions végétales, éditions Quæ, , p. 91
- Paul Pesson et Jean Louveaux, Pollinisation et productions végétales, éditions Quæ, , p. 92-93
- (en) Luke Mander, Mao Li, Washington Mio, Charless C. Fowlkes, Surangi W. Punyasena, « Classification of grass pollen through the quantitative analysis of surface ornamentation and texture », Proceedings of the Royal Society B, vol. 280, no 1770, (DOI 10.1098/rspb.2013.1905, lire en ligne, consulté le ).
- (en) Khidir W. Hilu, « Phylogenetics and chromosomal evolution in the Poaceae (grasses) », Australian Journal of Botany, CSIRO Publishing, vol. 52, , p. 13–22 (lire en ligne).
- Daron Josquin, Caractérisation de gènes de blé non synténiques avec les génomes des espèces apparentées (Master II Biologie et Environnement), Université Blaise-Pascal, (lire en ligne [PDF]).
- The International Brachypodium Initiative, « Genome sequencing and analysis of the model grass Brachypodium distachyon », Nature, vol. 463, no 7282, , p. 763–8 (PMID 20148030, DOI 10.1038/nature08747, Bibcode 2010Natur.463..763T)
- The International Barley Genome Sequencing Consortium, « A physical, genetic and functional sequence assembly of the barley genome », Nature, (DOI 10.1038/nature11543)
- (en) Zerihun Tadele, « Genome and transcriptome sequencing identifies breeding targets in the orphan crop tef (Eragrostis tef) », sur BMC Genomics (DOI 10.1186/1471-2164-15-581, consulté le ).
- J. =Yu, Hu, J. Wang, GK Wong, S Li, B. Liu, Y. Deng, L Dai et Y Zhou, « A draft sequence of the rice genome (Oryza sativa L. ssp. indica) », Science, vol. 296, no 5565, , p. 79–92 (PMID 11935017, DOI 10.1126/science.1068037, Bibcode 2002Sci...296...79Y)
- Goff SA, D. Ricke, Th. Lan, G. Presting, R. Wang, M. Dunn, J. Glazebrook, A. Sessions et P. Oeller, « A draft sequence of the rice genome (Oryza sativa L. ssp. japonica) », Science, vol. 296, no 5565, , p. 92–100 (PMID 11935018, DOI 10.1126/science.1068275, Bibcode 2002Sci...296...92G)
- BL Hurwitz, D Kudrna, Y Yu, A Sebastian, A Zuccolo, SA Jackson, D Ware, RA Wing et L Stein, « Rice structural variation: A comparative analysis of structural variation between rice and three of its closest relatives in the genus Oryza », The Plant journal : for cell and molecular biology, vol. 63, no 6, , p. 990–1003 (PMID 20626650, DOI 10.1111/j.1365-313X.2010.04293.x)
- (en) National Center For Gene Research, « bamboo genome » (consulté le ).
- (en) Jian Wang, « Genome sequence of foxtail millet (Setaria italica) provides insights into grass evolution and biofuel potential », sur Nature Biotechnology (DOI 10.1038/nbt.2195, consulté le ).
- A.H. Paterson, J.E. Bowers, R. Bruggmann et al., « The Sorghum bicolor genome and the diversification of grasses », Nature, vol. 457, (DOI 10.1038/nature07723, lire en ligne [PDF])
- Keith Edwards, « Bristol University | News from the University | Wheat genome », Bristol.ac.uk, (consulté le )
- (en) Jun Wang, « Draft genome of the wheat A-genome progenitor Triticum urartu », sur Nature (DOI 10.1038/nature11997, consulté le ).
- P. Schnable, D. Ware, Fulton RS, J. C. Stein, F. Wei, S. Pasternak, C. Liang, J. Zhang et L. Fulton, « The B73 Maize Genome: Complexity, Diversity, and Dynamics », Science, vol. 326, no 5956, , p. 1112–1115 (PMID 19965430, DOI 10.1126/science.1178534, Bibcode 2009Sci...326.1112S)
- (en) H.E. Connor, « Breeding systems in the grasses: a survey », New Zealand Journal of Botany, vol. 17, , p. 547-574 (résumé).
- (en) Y. Savidan, Jules Janick (ed), « Apomixis: Genetics and Breeding », Plant Breeding Reviews, John Wiley & Sons, vol. 18, (ISBN 0-471-35567-4, lire en ligne [archive du ]).
- (en) E. Kellogg, « Variation and Species Limits in Agamospermous Grasses », Systematic Botany, vol. 15, , p. 112-123 (lire en ligne).
- (en) C. Campbell, J. Quinn, G. Cheplick & T J Bell, « Cleistogamy in Grasses », Annual Review of Ecology and Systematics, vol. 14, , p. 411-441.
- (en) U. Baumann, J. Juttner, X. Bian, & P. Langridge, « Self-incompatibility in the Grasses », Annals of Botany, vol. 85 (Supplement A), , p. 203-209 (lire en ligne [PDF]).
- (en) Smouter H. & Simpson R., « Occurrence of Fructans in the Gramineae (Poaceae) », The New Phytologist, vol. 111, no 3, , p. 359-368 (lire en ligne).
- (en) Peter R. Shewry et Nigel G. Halford, « Cereal seed storage proteins: structures, properties and role in grain utilization », Journal of Experimental Botany, vol. 53, no 370, , p. 947–958 (lire en ligne).
- (en) Massey FP, Ennos AR, Hartley SE, « Silica in grasses as a defence against insect herbivores: contrasting effects on folivores and a phloem feeder », Journal of animal ecology, vol. 75, no 2, , p. 595–603 (DOI 10.1111/j.1365-2656.2006.01082.x, lire en ligne).
- (en) Nanna Bjarnholt, Lene Dalsten, Kirsten Jørgensen, Mohammed Saddik Motawie, Birger Lindberg Møller, « Sorghum - Metabolism of dhurrin », sur université de Copenhague -Department of Plant and Environmental Sciences.
- (en) « Information on nitrate poisoning », sur Poisonings of livestock, Department of Agriculture and Fisheries - Gouvernement du Queensland, (consulté le ).
- (en) Shane Gadberry, John Jennings, « Nitrate Poisoning in Cattle », sur www.uaex.edu, University of Arkansas - Cooperative Extension Service (consulté le ).
- Deschampsia antarctica, (en) British Antarctic Survey : Plants of Antarctica
- (en) David J. Gibson, Grasses and grassland ecology, Oxford University Press, coll. « Oxford biology », , 305 p. (ISBN 978-0-19-852918-7, lire en ligne), p. 94-102.
- (en) Robert M. Boddey & Johanna Dobereiner, « Nitrogen fixation associated with grasses and cereals: Recent progress and perspectives for the future », Fertilizer research, vol. 42, nos 1–3, , p. 241–250 (ISSN 0167-1731, DOI https://doi.org/10.1007/BF00750518, résumé).
- (en) Dolores R. Piperno et Hans-Dieter Sues, « Dinosaurs Dined on Grass », Science (magazine), vol. 310, no 5751, , p. 1126–1128 (DOI 10.1126/science.1121020).
- (en) Dolores R. Piperno et Hans-Dieter Sues, « Dinosaurs Dined on Grass », Science, vol. 310, no 5751, , p. 1126–8 (DOI 10.1126/science.1121020).
- (en) V. Prasad, C.A.E. Stroemberg, H. Alimohammadian et A. Sahni, « Dinosaur coprolites and the early evolution of grasses and grazers », Science, vol. 310, no 5751, , p. 1177–1180 (DOI 10.1126/science.1118806).
- (en) V. Prasad, C.A. Strömberg, A.D. Leaché, B. Samant, R. Patnaik, L. Tang et D.M. Mohabey, « Late Cretaceous origin of the rice tribe provides evidence for early diversification in Poaceae », Nature Communications, vol. 2, , p. 480 (DOI 10.1038/ncomms1482).
- « Fossilized mammal skeleton from the dinosaur era found in central Japan », sur The Japan Times, (consulté le )
- (en) Z.Q. Wu et S. Ge, « The phylogeny of the BEP clade in grasses revisited: Evidence from the whole-genome sequences of chloroplasts », Molecular and Phylogenetic Evolution, vol. 62, no 1, , p. 573–578 (DOI 10.1016/j.ympev.2011.10.019).
- (en) Kuhl, J. C., Cheung, C., Yuan, Q., Martin, W., Zewdie, Y., McCallum, J., Catanach, A., Rutherford, P., Sink, K. C., Jenderek, M., Prince, J. P., Town, C. D. & Harvey, M. J., « A unique set of 11,008 onion Expressed Sequence Tags reveals expressed sequence and genomic differences between the monocot orders Asparagales and Poales », Plant Cell, .
- Clark, L. G., Zhang, W., Wendel, J. F., « A phylogeny of the grass family (Poaceae) based on ndhF sequence data », Syst. Bot.,
- Soreng, R. J., Davis, J. I., « Phylogenetics and character evolution in the grass family (Poaceae) : simultaneous analysis of morphological and chloroplast DNA restriction site character sets », Bot. Rev.,
- Hilu, K. W., Alice, L. A. & Liang, H., « Phylogeny of Poaceae inferred from matK sequences », Ann. Missouri Bot. Gard.,
- Grass Phylogeny Working Group, « Phylogeny and subfamilial classification of the grasses (Poaceae) », Ann. Missouri Bot. Gard.,
- Sandra Aliscioni, Hester L. Bell, Guillaume Besnard, Pascal-Antoine Christin, J. Travis Columbus, Melvin R. Duvall, Erika J. Edwards, Liliana Giussani, Kristen Hasenstab-Lehman, Khidir W. Hilu, Trevor R. Hodkinson, Amanda L. Ingram, Elizabeth A. Kellogg, Saeideh Mashayekhi, Osvaldo Morrone, Colin P. Osborne, Nicolas Salamin, Hanno Schaefer, Elizabeth Spriggs, Stephen A. Smith and Fernando Zuloaga. 2012. New grass phylogeny resolves deep evolutionary relationships and discovers C4 origins. New Phytologist (2012) 193: 304–312 doi: 10.1111/j.1469-8137.2011.03972.x.
- (en) Sánchen-Ken, J. Gabriel; Clark, Lynn G.; Kellogg, Elizabeth A.; Kay, Elma E., « Reinstatement and Emendation of Subfamily Micrairoideae (Poaceae) », Systematic Botany, vol. 32, no 1, , p. 71-80 (résumé).
- (en) Hodkinson T. R., Savolainen, V., Jacobs, S. W. L., Bouchenak-Khelladi, Y., Kinney, M. S. & Salamin, N., Reconstructing the Tree of Life: Taxonomy and Systematics of Species Rich Taxa [Systematics Association Special Volume Series 72.], Boca Raton, FLA, CRC Press, , « Supersizing: Progress in documenting and understanding grass species richness. », p. 275-295
- (en) Duvall M. R., Leseberg, C. H., y Grennan, C. P., Plant Biology and Botany 2007. Program and Abstract Book, Chicago, , « Comparison of whole chloroplast genomes in grasses (Poaceae); evolutionary insights related to Coix lacryma-jobi, Microcalamus convallarioides, Puelia olyriformis and Joinvillea plicata. », p. 284
- (en) Maarten Joost Maria Christenhusz et James William Byng, « The number of known plants species in the world and its annual increase », Phytotaxa, vol. 261, no 3, , p. 201–217 (ISSN 1179-3155, DOI 10.11646/phytotaxa.261.3.1, lire en ligne).
- (en) « Angiosperm Phylogeny Website » (consulté le ).
- (en) David J. Gibson, Grasses and Grassland Ecology, Oxford University Press, coll. « Oxford biology », , 305 p. (ISBN 978-0-19-852918-7, lire en ligne), p. 21-22.
- (en) « Poaceae », sur Germplasm Resources Information Network (GRIN), USDA, ARS, National Genetic Resources Program. National Germplasm Resources Laboratory, Beltsville, Maryland (consulté le ).
- (en) Rafaël Govaerts, « Poaceae - Données de la World Checklist of Selected Plant Families », Board of Trustees of the Royal Botanic Gardens, Kew (consulté le ).
- « Faostat », sur FAO (consulté le )
- (en) Jorge Dubcovsky et Jan Dvorak, « Genome plasticity a key factor in the success of polyploid wheat under domestication », Science, vol. 316, no 5833, , p. 1862–1866 (DOI 10.1126/science.1143986, lire en ligne).
- FAO, 2008.
- Choix des espèces prairiales sur le site Prairies-gnis.org
- (es) Langer, R.H.M. 1984. Especies y variedades de gramíneas forrajeras. in: Las pasturas y sus plantas, Capítulo 3, pag.: 75-96. Editorial Hemisferio Sur, Montevideo, Uruguay.
- (en) Norman Leslie Kent, A. D. Evers, Technology of Cereals : An Introduction for Students of Food Science and Agriculture, Woodhead Publishing, , 334 en (ISBN 978-0-08-040834-7, lire en ligne).
- « Standards of Identity for Distilled Spirits », sur Home gpo.gov govinfo.gov, (consulté le )
- (es) Puglia, M.L., « Gramíneas ornamentales », Jardín, no Edición especial no 7, , p. 1-130.
- (en) « Grass Energy: Basics of Production, Processing, and Combustion of Grasses for Energy », Biomass Energy Resource Center (BERC) (consulté le ).
- (en) « Miscanthus », Crops for Energy (consulté le ).
- (en) An Ha Truong, Thi My Anh Le, « Overview of bamboo biomass for energy production », University of Sciences and Technologies of Hanoi, (consulté le ).
- (en) Nadia Bystriakova, Valerie Kapos et Igor Lysenko, Bamboo Biodiversity : Africa, Madagascar and the Americas : numéro 19 de UNEP-WCMC biodiversity series, World Conservation Monitoring Centre, UNEP/Earthprint, , 88 p. (ISBN 978-92-807-2383-0, lire en ligne), p. 18.
- (en) François Couplan, James Duke, The Encyclopedia of Edible Plants of North America, McGraw Hill Professional, , p. 464.
- François Couplan, Le guide de la survie douce en pleine nature, Larousse, , p. 210.
- « L’herbe verticale entre les pouces », sur reveeveille.net, .
- « Folle avoine – Grandes graminées », sur reveeveille.net, .
- Michel Scrive, Jouer Nature, éd. Michel Scrive, , 95 p..
- Listado de malezas pertenecientes a las gramíneas
- (en) « Gestion de l'enherbement », Centre Français du Riz (consulté le ).
- (en) Ian Heap, « The International Survey of Herbicide Resistant Weeds » (consulté le ).
- « L’ivraie enivrante (Lolium temulentum) », sur [Books of] Dante (consulté le ).
- « ZIZANIE, subst. fém. », sur CNRTL (consulté le ).
- Jean Bruneton, Plantes toxiques : végétaux dangereux pour l'homme et les animaux, Tec & Doc Lavoisier, , 3e éd., 618 p. (ISBN 978-2-7430-0806-2), p. 449-450.
- (en) Paolo Falagiani, Pollinosis, CRC Press, , 280 p. (ISBN 978-0-8493-6482-2, lire en ligne), p. 25-27.
Voir aussi
Articles connexes
- Bambous, les plus grandes des graminées
- Graminées ornementales
- Maladie des graminées
- Graminées fossiles
- Glossaire des Poaceae
- Toxicité des graminées
- Agrostologie
Bibliographie
- (en) Agnes Chase, First book of grasses; the structure of grasses explained for beginners, New York, The Macmillan Company, , 146 p. (lire en ligne).
- Philippe Jauzein et Jacques Montégut, Graminées (Poaceae) nuisibles en agriculture, SECN (société d'éditions champignons et nature), , 538 p. (ISBN 978-2-904355-02-8, ASIN B00MRYFBQU).
- (en) Geoffrey Peter Chapman, Grass Evolution and Domestication, Cambridge University Press, , 390 p. (ISBN 978-0-521-41654-2, lire en ligne).
- Pierre Poilecot, Les Poaceae du Niger : description, illustration, écologie, utilisations, vol. 56, Conservatoire et Jardin botaniques, coll. « Boissiera : mémoires de botanique systématique », , 766 p. (ISBN 978-2-8277-0072-1, ISSN 0373-2975).
- (en) SWL Jacobs, J Everett, Grasses : Systematics and Evolution, Csiro Publishing, , 392 p. (ISBN 978-0-643-09900-5, lire en ligne).
- (en) Elizabeth A. Kellogg, « Evolutionary History of the Grasses », Plant Physiology, vol. 125, no 3, , p. 1198-1205 (DOI https://dx.doi.org/10.1104/pp.125.3.1198, lire en ligne).
- (en) Hervé Lapierre et Pierre- A. Signoret, Viruses and Virus Diseases of Poaceae (Gramineae), Paris, Éditions Quae, coll. « Mieux comprendre », , 857 p. (ISBN 978-2-7380-1088-9, ISSN 1144-7605, lire en ligne).
- (en) Mary E. Barkworth, Laurel K. Anderton, Kathleen M. Capels, Sandy Long, Michael B. Piep, Manual of Grasses for North America, Utah State University Press, , 640 p. (ISBN 978-1-4571-8098-9).
- (en) David J. Gibson, Grasses and Grassland Ecology, Oxford University Press, coll. « Oxford biology », , 305 p. (ISBN 978-0-19-852918-7, lire en ligne).
- (en) Agnes Arber, The Gramineae : A Study of Cereal, Bamboo and Grass, Cambridge University Press, coll. « Cambridge Library Collection - Botany and Horticulture », , 506 p. (ISBN 978-1-108-01731-2, lire en ligne).
- (en) Elizabeth A. Kellogg, Flowering Plants. Monocots : Poaceae, vol. 13, Cham, Springer, coll. « The Families and Genera of Vascular Plants », , 416 p. (ISBN 978-3-319-15332-2, lire en ligne).
- Pierre Idiart, Herbes folles : Beauté des graminées sauvages, Flammarion, , 136 p. (ISBN 978-2-08-200864-8).
Références externes
- (en) Référence Angiosperm Phylogeny Website : Poaceae () (consulté le )
- (fr) Référence Belles fleurs de France : Poaceae (consulté le )
- (fr) Référence Belles fleurs de France 2 : Poaceae (consulté le )
- (en) Référence Catalogue of Life : Poaceae (consulté le )
- (en) Référence Flora of China : Poaceae (consulté le )
- (en) Référence Madagascar Catalogue : Poaceae (consulté le )
- (en) Référence Flora of Pakistan : Poaceae (consulté le )
- (en) Référence FloraBase (Australie-Occidentale) : classification Poaceae (+ photos + répartition + description) (consulté le )
- (en) Référence GRIN : famille Poaceae Barnhart (+liste des genres contenant des synonymes) (consulté le )
- (fr+en) Référence ITIS : Poaceae (consulté le )
- (en) Référence Kew Garden World Checklist : Poaceae (consulté le )
- (en) Référence NCBI : Poaceae (taxons inclus) (consulté le )
- (fr) Référence Tela Botanica (France métro) : Poaceae (consulté le )
- (en) Référence Paleobiology Database : Poaceae Barnhart 1895 (éteint) (consulté le )
- (en) Référence Tropicos : Poaceae Barnhart (+ liste sous-taxons) (consulté le )
- (en) Référence uBio : Poaceae Caruel, 1881 (consulté le )
- (en) Référence World Register of Marine Species : taxon Poaceae (+ liste genres + liste espèces) (consulté le )
- (en) Référence DELTA Angio : Gramineae (consulté le )
- GrassWorld http://grassworld.myspecies.info/
Autres liens externes
- [PDF] Jean Leurquin, « Clés de détermination des graminées de Belgique et régions limitrophes », .
- Jack Kyle, « Identification des Graminées de pâturage », Ministère de l'Agriculture, de l'Alimentation et des Affaires rurales de l'Ontario, .
- (en) « GrassBase - The Online World Grass Flora », sur Kew Gardens.
- (en) « GrassWorld ».
- (en) « eMonocot - An online resource for monocot plants ».
- (en) R. J. Soreng et al., « A World-wide Phylogenetic Classification of Poaceae (Gramineae) », sur Tropicos, .
- (en) L. Watson & M. J. Dallwitz, « The grass genera of the world ».
- (fr) Botarela, site dédié aux Poacées (Graminées).
- (en) « AusGrass2 - Grasses of Australia ».
- Portail de l’agriculture et l’agronomie
- Portail des Poaceae








