Ose
Un ose[1] (ou monosaccharide) est un monomère de glucide. Les oses possèdent au moins 3 atomes de carbone : ce sont des polyhydroxyaldéhydes ou des polyhydroxycétones[2]. Les monosaccharides ne sont pas hydrolysables, mais les polysaccharides sont très solubles dans l'eau et possèdent généralement un pouvoir sucrant. On les distingue par la longueur de leur chaîne carbonée, comme suit :
- les trioses : oses à 3 carbones, C3H6O3 (glycéraldéhyde, dihydroxyacétone) ;
- les tétroses : oses à 4 carbones, C4H8O4 (érythrose, thréose, érythrulose) ;
- les pentoses : oses à 5 carbones, C5H10O5 (désoxyribose (C5H10O4), ribose, arabinose, xylose, lyxose, ribulose, xylulose) ;
- les hexoses : oses à 6 carbones, C6H12O6 (allose, altrose, galactose, glucose, gulose, idose, mannose, talose, fructose, psicose, sorbose, tagatose) ;
- les désoxyhexoses : oses à 6 carbones, C6H12O5 (fucose, rhamnose) ;
- les heptoses : oses à 7 carbones, C7H14O7 (sédoheptulose, mannoheptulose)
- les octoses : oses à 8 carbones, C8H16O8 (heptahydroxyoctanal) ;
- les nonoses : oses à 9 carbones, C9H17N1O8 (acide neuraminique ou acide sialique).
Pour les articles homonymes, voir Ose (homonymie).
Les oses peuvent être libres ou liés entre eux (oligosides et polyosides) ou liés à des protéines (glycoprotéines), ou encore à des lipides (glycolipides). Ils sont à la base du glycome (le patrimoine de sucres d'un organisme) et jouent un grand rôle au niveau cellulaire, tout particulièrement chez certaines bactéries (gram négative notamment) dont les capsules protectrices sont constituées de polymères d'oses, plus souvent que de protéines.
Propriétés physiques et organoleptiques
Les oses ont une couleur blanchâtre.
Solubilité
L'abondance des groupes hydroxyles (OH) dans leur molécule confère aux oses une très grande solubilité dans l'eau.
Cristallisation
Les solutions aqueuses concentrés d'oses sont visqueuses, ce sont des sirops (la cristallisation est difficile). Celle-ci peut être facilitée par addition de solvants organiques (méthanol, éthanol, etc.) et à chaud (présence de chaleur) où les oses sont peu solubles.
Pouvoir rotatoire
Tous les oses ont un pouvoir rotatoire bien défini (à l'exception de celles possédant le groupe cétone comme le dihydroxyacétone), ce qui constitue un moyen d'identification par polarimétrie.
Propriétés organoleptiques
Quelques-uns ont une saveur agréable sucrée, mais il est faux de généraliser cette propriété car d'autres composés qui ne sont pas des oses, tels la glycine ou l'acide aspartique (duquel dérive l'édulcorant aspartame) par exemple, possèdent une saveur sucrée.
Structure
Formule brute
Cn(H2O)n où n est un nombre entier représentant le nombre de carbones (de 3 à 7 pour les oses naturels) pour de nombreux oses, cependant il ne faut pas généraliser cette propriété. Par exemple, l'acide acétique, qui n'est en aucun cas un ose possède la formule brute CH3COOH soit C2(H2O)2. D'autre part, des dérivés d'ose, comme la glucosamine (qui possède d'autres atomes que le carbone, l'hydrogène et l'oxygène ; en l'occurrence, l'azote) ne présentent pas la propriété énoncée ci-dessus valable pour de nombreux oses.
Il est possible de synthétiser à partir d'un ose de n carbones un autre ose de n+1 carbones (par ajout d'un groupement CH-OH en dessous de la fonction aldéhyde ou cétone, à carbone asymétrique) : on effectue des réactions chimiques successives de Kiliani-Fischer (ou synthèse de l'acide cyanhydrique), réaction non stéréospécifique qui peut donc donner, à partir d'un même ose, deux oses différents.
Structure acyclique
Un ose à n carbones est composé d'une chaîne carbonée non ramifiée, de 3 à 7 carbones, ne comportant que des liaisons simples. Tous les carbones portent une fonction alcool (OH) sauf un qui porte une fonction carbonyle.
Cela détermine donc deux catégories d'oses :
- aldose, si la fonction carbonyle est une fonction aldéhyde, elle se trouve sur le premier carbone (par exemple le glucose) ;
- cétose, si la fonction carbonyle est une fonction cétone, elle se trouve sur le second carbone (par exemple le fructose).
Hormis la dihydroxyacétone, tous les oses possèdent un pouvoir rotatoire du fait de la présence d'au moins un carbone asymétrique : les oses sont dits chiraux. De fait, s'il y a n atomes de carbone asymétriques, il existe 2n paires d'énantiomères, diastéréoisomères entre elles. Chaque paire a un nom différent et les descripteurs D et L sont traditionnellement utilisés pour différencier chaque énantiomère.
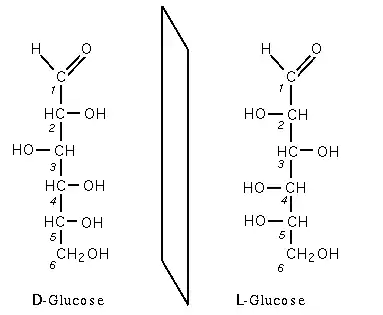
Deux énantiomères (antipodes optiques) ont les mêmes propriétés à l'exception d'une seule : leur pouvoir rotatoire opposé. La figure 1 représente les deux énantiomères du glucose, la forme D-glucose est la forme naturelle.
- Dans la forme D, le groupement alcool (-OH) porté par le carbone n-1 est à droite (en représentation de Fischer).
- Dans la forme L, le groupement alcool (-OH) porté par le carbone n-1 est à gauche (en représentation de Fischer).
La forme D ou L n'implique en rien le caractère dextrogyre ou lévogyre de la molécule. Ainsi le D-(+)-glucose est bien dextrogyre (+52°) mais le D-(-)-fructose est fortement lévogyre (-92,4°).
La majorité des oses naturels sont de la forme D, mais il existe également des oses de la série L.
Structure cyclique
La projection de Haworth est souvent utilisée pour représenter la forme cyclique des oses.
Il y a hémiacétalisation entre la fonction carbonyle et un OH, dès lors qu'ils sont distants d'au moins 3 carbones, (ex. : entre le carbone 1 et 5 du glucose ou entre le carbone 2 et 5 du fructose, ou encore entre le carbone 1 et 4 du ribose). Le OH né de la cyclisation est appelé OH anomérique ou anomère. Il donne lieu à un nouveau carbone asymétrique (le carbone porteur de la fonction carbonyle : no 1 dans le cas d’un aldose ou no 2 dans le cas d’un cétose) et selon qu'il est placé sous ou sur le plan du cycle il donne naissance à deux isomères alpha (α) ou bêta (β) (alpha signifiant en dessous, et bêta au-dessus pour la série D ; c'est l'inverse pour la série L), la forme bêta étant plus stable que la forme alpha.
Une fois la chaîne carbonée repliée, la proximité de la double liaison de la fonction aldéhyde (ou cétone s’il s'agissait d’un cétose) permet, du fait de sa fragilité, la rupture de la liaison P et de la liaison OH de la fonction alcool (ici du C no 5), permettant l’établissement d’une nouvelle liaison C no 1 et O de l’ancienne fonction alcool du C no 5, fermant ainsi un cycle.
Cycle sous forme furanique
Les oses se cyclisant généralement sous forme furanique (furane) sont :
- le ribose donnant du ribofuranose ;
- le 2-désoxyribose donnant du 2-désoxyribofuranose.

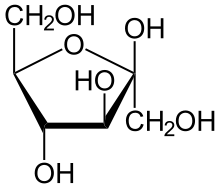
Cycle sous forme pyranique
Les oses se cyclisant généralement sous forme pyranique (pyrane) sont :
Le mécanisme le plus commun de cyclisation est un mécanisme d'hémiacétalisation pour les aldoses et hémicétalisation pour les cétoses. L'oxygène qui va se positionner à l'intérieur du cycle est celui de la fonction hydroxyle qui détermine la série L ou D (donc porté par C5 pour les pyranoses ou C4 pour les furanoses). L'oxygène de la fonction carbonyle donnera le OH porté par C1.
Mécanisme[3] :
- La fonction carbonyle capte un proton du solvant ;
- Attaque nucléophile sur C1 par le OH qui détermine la série L ou D ;
- Le O intracyclique perd son proton.
En série D, les formes bêta ont toujours leur fonction hémiacétalique (OH en 1, qui n'est pas un alcool) vers le haut sous la représentation de Haworth ; de même les formes alpha portent le OH vers le bas.
Nomenclature
Ils peuvent se présenter sous forme cristalline. Les oses sont de deux types :
- si la fonction carbonyle de l'ose est un aldéhyde c'est un aldose ;
- si cette fonction est une cétone, c'est un cétose (ou cétulose).

* Triose : (1) D-(+)-glycéraldéhyde ;
* Tétroses : (2a) D-(−)-érythrose ; (2b) D-(−)-thréose ;
* Pentoses : (3a) D-(−)-ribose ; (3b) D-(−)-arabinose ; (3c) D-(+)-xylose ; (3d) D-(−)-lyxose ;
* Hexoses : (4a) D-(+)-allose ; (4b) D-(+)-altrose ; (4c) D-(+)-glucose ; (4d) D-(+)-mannose ; (4e) D-(−)-gulose ; (4f) D-(−)-idose ; (4g) D-(+)-galactose ; (4h) D-(+)-talose.
Exemples d'oses remarquables :
Trioses
- Aldotriose
- D- et L-glycéraldéhyde
- (Cétotriose)
Hexoses
- Dérivés ayant un rôle physiologique
- D-glucuronate (6-carboxy-D-glucose)
- D-galacturonate (6-carboxy-D-galactose)
- N-acétyl-D-glucosamine
- D-glucosamine
- N-acétyl-D-galactosamine
- D- et parfois L-fucose (6-désoxy-D- et -L-galactose)
- L-rhamnose (6-désoxy-L-mannose)
- D-quinovose (6-désoxy-D-glucose)
- Cétohexose
- D-fructose
Les dérivés d'oses
Les polyalcools
Les polyalcools (ou polyols), sont obtenus par réduction de la fonction aldéhyde en alcool, c'est le cas par exemple du glycérol.
Les osamines
Dans les osamines la fonction alcool (–OH) en C2 est remplacée par –NH2. On peut également lui rajouter un groupement acétyl.
Les désoxyoses ou désoses
Les désoxyoses sont créés par substitution d'hydrogène en remplacement du groupement hydroxyle, on peut noter l'exemple du désoxyribose.
Les acides aldoniques
Ils sont formés par une oxydation dite « douce ». (Exemples d'oxydants doux : Le réactif de Tollens ou la liqueur de Fehling) des aldoses et sont caractérisés par l'oxydation de la fonction aldéhyde en fonction carboxyle. Exemple : acide gluconique.
Les acides uroniques
Les acides uroniques sont des aldohexoses dont une fonction acide carboxylique (-COOH) remplace l'alcool primaire (-CH2OH, OH du C6) par oxydation. Exemple : acide glucuronique.
Les oses complexes
On distingue l'acide neuraminique et l'acide muramique. L'acide neuraminique est un dérivé de cétose à 9 atomes de carbone résultant d'une crotonisation d'acide pyruvique et de la D-mannosamine. L'acide muramique est formé de la N-acétyl-glucosamine, de l'acide lactique et de la D-alanine.
Les acides aldariques
Les acides aldariques sont formés par oxydation de la fonction aldéhyde en fonction carboxylique et l'oxydation de l'alcool primaire en fin de chaîne en fonction carboxylique. Pour réaliser cette réaction, il faut un oxydant puissant car l'alcool primaire est plus difficile à oxyder que la fonction aldéhyde.
Notes et références
- « 08.01.Q03 : Les sucres, saccharides, glucides, hydrate de carbone, oses… De quoi parle-t-on ? | Académie d'Agriculture de France », sur www.academie-agriculture.fr (consulté le )
- Nomenclature of carbohydrates : https://www.qmul.ac.uk/sbcs/iupac/2carb/00n01.html#01
- « animation mécanisme cyclisation du glucose »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
Voir aussi
Articles connexes
Liens externes
- Portail de la biochimie
- Portail de la chimie
