Spectroscopie infrarouge
La spectroscopie infrarouge (parfois désignée comme spectroscopie IR) est une classe de spectroscopie qui traite de la région infrarouge du spectre électromagnétique. Elle recouvre une large gamme de techniques, la plus commune étant un type de spectroscopie d'absorption. Comme pour toutes les techniques de spectroscopie, elle peut être employée pour l'identification de composés ou pour déterminer la composition d'un échantillon. Les tables de corrélation de spectroscopie infrarouge sont largement présentes dans la littérature scientifique.

Base et théorie
La partie infrarouge du spectre électromagnétique est divisée arbitrairement en trois régions : le proche, le moyen et le lointain infrarouges, nommés en relation avec le spectre visible. L'infrarouge lointain, allant approximativement de 400 à 10 cm−1 (1000–25 μm, en pratique gamme 1000–30 μm), mitoyen de la région micro-onde, a une énergie faible et peut être utilisé pour la spectroscopie rotationnelle. Le rayonnement infrarouge moyen, allant approximativement de 4000 à 400 cm-1 (25–2,5 μm, en pratique gamme 30–1,4 μm) peut être utilisé pour étudier les vibrations fondamentales et la structure rovibrationnelle associée. Le proche infrarouge, plus énergétique, allant approximativement de 14000 à 4 000 cm-1 (2,5–0,7 μm, en pratique gamme 1,4–0,8 μm) peut exciter les vibrations harmoniques. Les dénominations et classifications de ces sous-régions sont essentiellement des conventions. Elles ne sont pas basées sur des divisions strictes ou sur des propriétés moléculaires ou électromagnétiques exactes.
La spectroscopie infrarouge exploite le fait que les molécules possèdent des fréquences spécifiques pour lesquelles elles tournent ou vibrent en correspondance avec des niveaux d'énergie discrets (modes vibratoires). Ces fréquences de résonance sont déterminées par la forme des surfaces d'énergie potentielle, les masses atomiques et par le couplage vibronique associé. Afin qu'un mode vibrationnel dans une molécule soit actif dans l'infrarouge, il doit être associé à des modifications du dipôle permanent. En particulier, dans les approximations de Born-Oppenheimer et harmonique, lorsque le hamiltonien moléculaire correspondant à l'état fondamental électronique peut être approximé par un oscillateur harmonique au voisinage de la géométrie moléculaire d'équilibre, les fréquences de résonance sont déterminées par les modes normaux correspondant à la surface d'énergie potentielle de l'état fondamental électronique moléculaire. Néanmoins, les fréquences de résonance peuvent être dans une première approche liées à la force de la liaison, et aux masses atomiques de terminaison. Donc, la fréquence des vibrations peut être associée à une liaison particulière.
Les molécules diatomiques n'ont qu'une seule liaison, qui peut être étirée. Les molécules les plus complexes ont beaucoup de liaisons, et les vibrations peuvent être conjuguées, ce qui conduit à des absorptions infrarouges à des fréquences caractéristiques qui peuvent être liées à des groupes chimiques. Ainsi par exemple, les atomes d'un groupe CH2, que l'on trouve communément dans les composés organiques peut vibrer de six manières différentes : étirements (stretching) symétriques et antisymétriques, cisaillement (scissoring), bascule (rocking), agitation hors du plan(wagging) et torsion (twisting) :
Symétrie Direction |
Symétrique | Antisymétrique |
|---|---|---|
| Radiale | 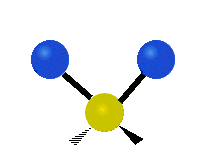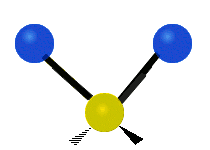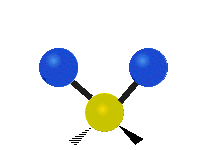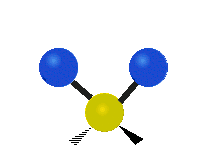 Étirement symétrique |
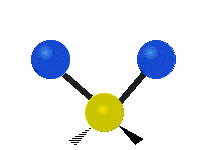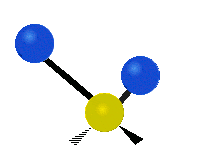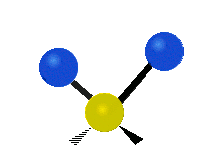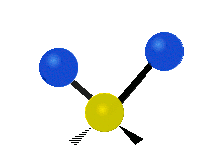 Étirement antisymétrique |
| Transversale | 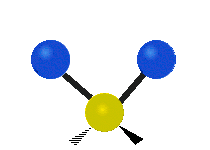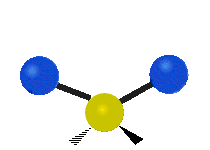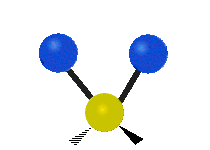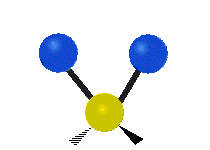 Cisaillement |
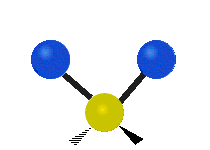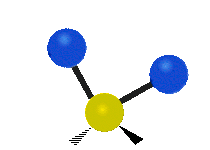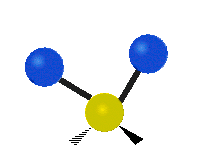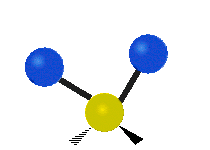 Bascule |
| Longitudinale | 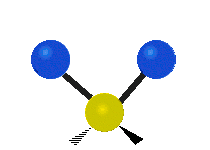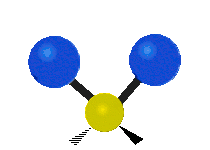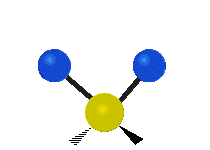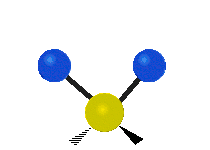 Agitation |
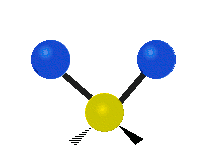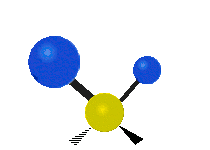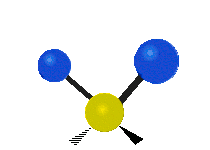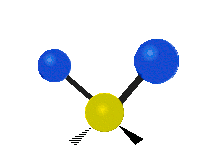 Torsion |
Ces figures ne représentent pas les vibrations des atomes de carbone, qui, bien que présentes, sont beaucoup moins amples que celles des atomes d'hydrogène qui sont douze fois plus légers.
Le spectre infrarouge d'un échantillon est établi en faisant passer un faisceau de lumière infrarouge au travers de cet échantillon. L'examen de la lumière transmise indique la quantité d'énergie absorbée à chaque longueur d'onde. On peut le faire avec un faisceau monochromatique, avec une modification de la longueur d'onde dans le temps, ou en utilisant un instrument à transformée de Fourier afin de mesurer toutes les mesures d'onde simultanément. On peut alors produire les spectres en absorbance ou en transmittance, et indiquer les longueurs d'onde d'absorption. L'analyse de ces caractéristiques indique des détails de la structure moléculaire de l'échantillon.
Cette technique fonctionne quasiment exclusivement sur les échantillons présentant des liaisons covalentes. Des spectres simples sont obtenus à partir d'échantillons avec peu de liaisons actives dans l'infrarouge et avec de hauts degrés de pureté. Les structures moléculaires plus complexes conduisent à plus de bandes d'absorption et donc à des spectres plus complexes. Cette technique a cependant été utilisée pour la caractérisation de mélanges très complexes.
Préparation de l'échantillon
Les échantillons gazeux ne nécessitent que peu de préparation avant purification, mais par contre requièrent normalement une cellule de mesure avec une longueur de parcours importante (typiquement entre 5 et 10 cm), les gaz n'absorbant que peu dans l'infrarouge.
Les échantillons liquides peuvent être placés entre deux plaques d'un sel très pur (habituellement le chlorure de sodium, ou sel de table, bien qu'un nombre important d'autres sels comme le bromure de potassium ou le fluorure de calcium soient aussi utilisés). Les plaques sont transparentes à la lumière infrarouge et n'introduisent donc pas de bandes supplémentaires dans le spectre. Cependant, comme de nombreux sels sont très solubles dans l'eau, les échantillons et agents de lavage doivent être anhydres.
Les échantillons solides peuvent être préparés de quatre manières majeures. La première d'entre elles est de broyer l'échantillon avec un agent liant (souvent du nujol) dans un mortier avec un pilon. Un film mince de ce broyat est appliqué sur les plaques et mesuré.
La deuxième méthode consiste à moudre finement une quantité de l'échantillon avec un sel purifié spécialement (comme le bromure de potassium) afin de supprimer les effets de diffusion des gros cristaux. Ce mélange poudreux est ensuite comprimé dans une presse afin de fournir une pastille translucide au travers de laquelle un faisceau de spectromètre peut passer.
La troisième technique est dite de déposition de film, et est principalement utilisée pour les matériaux polymères. L'échantillon est tout d'abord dissous dans un solvant non hygroscopique et adéquat. Une goutte de cette solution est déposée à la surface d'une cellule de KBr ou de NaCl. La solution est ensuite évaporée jusqu'à séchage complet et le film ainsi formé sur la cellule est analysé directement. Il faut faire attention à ce que le film ne soit pas trop épais, empêchant la lumière de le traverser. Cette technique permet des analyses qualitatives.
La quatrième méthode est l'utilisation de la microtomie afin de découper un film mince (de 20 à 100 μm) dans un échantillon solide. C'est l'un des plus importants moyens d'analyse des produits plastiques rejetés, par exemple, car cette technique préserve l'intégrité physique globale de l'échantillon.
Il est important de savoir que les spectres obtenus à partir de différentes méthodes peuvent présenter de légères différences entre eux en raison des états physiques des échantillons.
Méthode classique
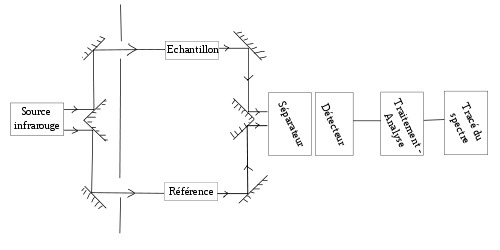
Dans un spectromètre infrarouge « classique » (il existe des montages spéciaux dépendants des activités poursuivies), un rayon de lumière infrarouge est produit et séparé en deux faisceaux. L'un passe au travers de l'échantillon, l'autre au travers d'une référence qui est parfois le composé dans lequel l'échantillon a été dissous. Les faisceaux sont ensuite réfléchis jusqu'à un détecteur, après être passés par un séparateur qui alterne rapidement les faisceaux entrant dans le détecteur. Les deux signaux sont comparés et le spectre ainsi obtenu tracé.
L'utilisation d'une référence permet :
- d'éviter les fluctuations de sortie de source qui peuvent affecter les données. Ces fluctuations ont des origines diverses, comme le vieillissement.
- d'éviter la prise en compte des effets de solvant (la référence est habituellement le solvant pur correspondant à celui dans lequel l'échantillon est dissous).
Aperçu des nombres d'onde d'absorption pour les molécules organiques

Usages et applications
La spectroscopie infrarouge est très répandue dans la recherche académique et l'industrie en tant que technique simple et sûre de mesure, de contrôle de qualité et de mesure dynamique. Elle est, par exemple, utilisée en médecine légale pour les cas criminels ou civils pour la caractérisation de la dégradation polymérique. Elle est sans doute la technique de spectroscopie appliquée la plus utilisée[réf. nécessaire].
Les instruments d'acquisition sont maintenant miniaturisés et donc transportables, même pour des usages en extérieur. Avec l'accroissement des technologies de filtrage informatique et de traitement des résultats, les échantillons en solution peuvent maintenant être mesurés précisément (l'eau présente une large absorbance sur les longueurs d'onde intéressantes, ce qui rend un spectre non traité ininterprétable). Certains instruments possédant leurs propres bases de données, l'identification peut ainsi également être automatisée.
En se calant sur une fréquence spécifique dans le temps, les modifications dans les propriétés ou la quantité d'une liaison particulière peuvent être mesurées. Cette méthode est particulièrement utile pour mesurer le degré de polymérisation en production. Les instruments de recherche modernes peuvent acquérir des mesures sur une largeur de spectre voulue, aussi souvent que 32 fois par seconde. Cela peut se faire dans le même temps que d'autres mesures par d'autres techniques, ce qui permet l'observation de réactions et processus chimiques de manière plus rapide et plus précise.
La spectroscopie infrarouge est une technique probante à la fois en chimie organique et en chimie inorganique. Ainsi on peut l'utiliser en analyse de surface dans l'industrie de la micro-électronique[1] pour des semi-conducteurs comme le silicium, l'arséniure de gallium, le séléniure de zinc, le silicium amorphe, le nitrure de silicium, etc.
Effets isotopiques
Les différents isotopes d'espèces particulières peuvent donner des détails fins en spectroscopie infrarouge. Ainsi, la fréquence d'étirement O-O de l'oxyhémocyanine est expérimentalement déterminées à 832 et 788 cm-1 pour ν(16O-16O) et ν(18O-18O) respectivement.
Si l'on considère la liaison O-O comme un ressort, la fréquence d'absorption ν peut être calculée :
où c est la vitesse de la lumière (3*108 m/s), k est la constante de ressort pour la liaison, et μ est la masse réduite du système A-B :
( est la masse de l'atome ).
Les masses réduites de 16O-16O et 18O-18O peuvent être approchées par 8 et 9 unités atomiques, respectivement. Donc :
Spectroscopie infrarouge à transformée de Fourier
La spectroscopie infrarouge à transformée de Fourier (IRTF, en anglais Fourier transform infrared spectroscopy - FTIR) est une technique de mesure pour l'acquisition de spectres infrarouges. Au lieu d'enregistrer la quantité d'énergie absorbée lorsque la fréquence de lumière infrarouge varie (monochromateur), la lumière infrarouge passe au travers d'un interféromètre. Après avoir traversé l'échantillon, le signal mesuré est un interférogramme. Après que le signal a subi une transformée de Fourier, on obtient un spectre identique à celui obtenu par une spectroscopie infrarouge conventionnelle (dispersive).
Les spectromètres IRTF sont moins chers que les spectromètres conventionnels, la construction d'interféromètres étant plus facile que celle de monochromateurs. De plus, la mesure d'un spectre est plus rapide en IRTF car l'information à toutes les fréquences est collectée simultanément (une mesure au moyen d'un appareil dispersif dure par exemple une demi-heure ; elle dure deux minutes avec un appareil IRTF). Cela permet à de nombreux échantillons d'être analysés et moyennés ensemble, ce qui améliore la sensibilité. En raison de ces nombreux avantages, la très grande majorité des spectromètres infrarouges modernes sont des instruments IRTF.
Un exemple d'application hors laboratoire de ces appareils est l'analyse des gaz de combustion des moteurs thermiques des véhicules. La sonde est introduite dans le pot d'échappement et seules deux fréquences sont exploitées : 2 350 cm−1 pour le dioxyde de carbone et 2 170 cm−1 pour le monoxyde de carbone. Dans cet exemple, le spectromètre à transformée de Fourier a remplacé le spectromètre dispersif qui nécessitait des ampoules contenant des concentrations bien définies des deux gaz analysés.
Spectroscopie infrarouge en deux dimensions
Plusieurs techniques de spectroscopie infrarouge sont dites en deux dimensions car elles permettent d'extraire de l'information supplémentaire par rapport à une technique plus classique (monodimensionnelle) en analysant les phénomènes de couplage en utilisant un paramètre supplémentaire à la fréquence.
Analyse de corrélation par spectroscopie infrarouge bidimensionnelle
Cette technique est l'application à la spectroscopie infrarouge de l'analyse de corrélation bidimensionnelle. En étendant l'information spectrale obtenue sur un échantillon perturbé, l'analyse spectrale est simplifiée et sa résolution améliorée. Les spectres bidimensionnels synchrone et asynchrone représentent un survol graphique des modifications spectrales induites par une perturbation (comme un changement de concentration ou de température) ainsi qu'une relation entre modifications spectrales pour deux nombres d'onde (fréquences) différents.
Spectroscopie infrarouge bidimensionnelle non linéaire

La spectroscopie infrarouge bidimensionnelle non linéaire[2],[3] est, en quelque sorte, la « version infrarouge » de la spectroscopie de corrélation. Cette technique a été rendue possible avec le développement de lasers infrarouges à pulsations femtosecondes. Dans ces expériences, un ensemble de pulsations de « pompage » sont appliquées à l'échantillon. Ce train de pulsations est suivi d'un temps d'attente pour permettre au système de se relaxer. Ce temps dure typiquement de 0 à quelques picosecondes et sa durée peut être contrôlée avec une résolution d'une dizaine de femtosecondes. Une pulsation sonde est ensuite envoyée, déclenchant un signal d'émission de l'échantillon. Le spectre infrarouge bidimensionnel non linéaire est un graphique bidimensionnel de corrélation de la fréquence excitée par les pulsations pompes et de la fréquence excitée par la pulsation sonde après le temps d'attente. Cela permet l'observation des couplages entre différents modes vibratoires. En raison de sa très haute résolution temporelle, cette technique peut être utilisée pour observer la dynamique moléculaire à l'échelle de la picoseconde. Cette technique est cependant très largement encore non répandue mais devient de plus en plus populaire en recherche fondamentale.
Comme pour la résonance magnétique nucléaire bidimensionnelle (RMN 2D), cette technique permet d'obtenir un spectre en deux dimensions avec des pics corrélés contenant les informations de couplage entre les différents modes. Cependant, contrairement à la RMN 2D, cette technique prend aussi en compte les excitations vers les harmoniques. Ces excitations sont perceptibles dans des pics d'absorption d'états excités en dessous de la diagonale et des pics de corrélation. En RMN 2D deux techniques distinctes, la COSY et la NOESY sont fréquemment utilisées. Les pics de corrélation dans la première sont reliés à du couplage scalaire, tandis que dans la seconde ils sont liés au transfert de spin entre les différents noyaux. En spectroscopie infrarouge bidimensionnelle non linéaire, un temps d'attente nul correspond à la technique COSY, et un temps d'attente non nul permettant des transferts de populations vibrationnelles à la technique NOESY. La "variante COSY" a été utilisée pour la détermination de structures secondaires de protéines[4].
Voir aussi
Autour de la spectroscopie infrarouge :
- Spectroscopie proche infrarouge
- Spectroscopie moyen infrarouge
- Spectroscopie lointain infrarouge
- Astronomie infrarouge
- Astronomie lointain infrarouge
Pour la spectroscopie :
- Vibration moléculaire
- Spectroscopie résolue en temps
- Vibration quantique
- Microspectroscopie photothermique
Références
- W.S. Lau, Infrared characterization for microelectronics, World Scientific,
- P. Hamm, M. H. Lim, R. M. Hochstrasser, « Structure of the amide I band of peptides measured by femtosecond nonlinear-infrared spectroscopy », J. Phys. Chem. B, vol. 102, , p. 6123 (DOI 10.1021/jp9813286)
- S. Mukamel, « Multidimensional Fentosecond Correlation Spectroscopies of Electronic and Vibrational Excitations », Annual Review of Physics and Chemistry, vol. 51, , p. 691 (DOI 10.1146/annurev.physchem.51.1.691)
- N. Demirdöven, C. M. Cheatum, H. S. Chung, M. Khalil, J. Knoester, A. Tokmakoff, « Two-dimensional infrared spectroscopy of antiparallel beta-sheet secondary structure », Journal of the American Chemical Society, vol. 126, , p. 7981 (DOI 10.1021/ja049811j)
Liens externes
- (en) Spectroscopie infrarouge pour chimistes organiciens
- (en) Organic compounds spectrum database
- (en) Calcul de spectre
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Infrared spectroscopy » (voir la liste des auteurs).
- Portail de la chimie
- Portail de la physique
- Portail de l’optique