Staphylococcus
Staphylococcus (les staphylocoques) est un genre de bactéries coques à Gram positif et catalase positive, et coagulase positive pour Staphylococcus aureus, Staphylococcus intermedius, Staphylococcus pseudintermedius, Staphylococcus delphini et certains Staphylococcus schleiferi, négative pour les autres.
| Règne | Bacteria |
|---|---|
| Division | Firmicutes |
| Classe | Bacilli |
| Ordre | Bacillales |
| Famille | Staphylococcaceae |
Une vingtaine d'espèces de staphylocoques sont actuellement identifiées, dont l'espèce principale : Staphylococcus aureus, responsable de nombreuses infections humaines et animales.
Écologie et habitat
Ubiquitaires, les staphylocoques sont présents sur de nombreux sites. Ils sont capables de vivre :
- en saprophytes (dans l'environnement extérieur) ;
- en commensaux sur les épithéliums de l'Homme et des animaux.
L'Homme est le réservoir de plusieurs espèces de staphylocoques :
- Staphylococcus aureus (ou staphylocoque doré) est retrouvé chez 15 à 30 % des individus sains (50 % si l'on compte les porteurs occasionnels) au niveau des fosses nasales et de la gorge, il est également présent (en plus faibles quantités) dans le tube digestif et au niveau du périnée. À partir du rhinopharynx, la bactérie est disséminée sur la peau (mains et visage) par aérosols et est souvent présente sur les vêtements et dans les squames (qui font partie de la poussière de tout local habité). Comme les staphylocoques résistent bien à la dessiccation, la transmission peut être non seulement directe (surtout mains du personnel soignant dans les hôpitaux), mais aussi indirecte par les objets et poussières ;
- Staphylococcus capitis est présent au niveau du cuir chevelu ;
- Staphylococcus epidermidis (ou staphylococcus albus = staphylocoque blanc) est présent sur la peau (en beaucoup plus grande quantité que Staphylococcus aureus). Le Staphylococcus epidermidis est un commensal de la peau chez pratiquement 100 % des humains ; ses propriétés lipolytiques lui permettent de prospérer dans le sébum. Il est normalement inoffensif, mais il provoque d'authentiques infections comme des infections dermatologiques et des infections nasales comme des sinusites ou encore des infections urinaires chez la femme et plus rarement chez l'homme. Il se rencontre parfois dans des septicémies chez des individus débilités (surtout porteurs de prothèses cardiaques : comme pour tous les germes, la présence d'un corps étranger en facilite l'implantation) ;
- Staphylococcus auricularis est retrouvé autour et dans le conduit auditif externe ;
- Staphylococcus lugdunensis (en) (ou staphylocoque de Lyon[1]) dans les cavités nasales et qui produit la lugdunine, antibiotique naturel qui serait efficace contre des bactéries multirésistantes.
Les animaux hébergent des espèces de staphylocoques qui ne sont pas tout le temps retrouvées chez l'Homme :
Pouvoir pathogène
L'espèce la plus pathogène de la famille des staphylocoques est Staphylococcus aureus. En effet, il peut être responsable de plusieurs infections.
La plupart des autres espèces de staphylocoques ne sont pas pathogènes.
Cependant certaines espèces commensales sont dites pathogènes opportunistes, elles peuvent entraîner des infections dans des conditions particulières :
- S. epidermidis peut être responsable d'infections de la peau, nasales et aussi d'endocardites et d'infections localisées chez les patients immunodéprimés ;
- Staphylococcus saprophyticus peut être responsable d'infections urinaires ;
- Staphylococcus hyicus et staphylococcus pseudintermedius peuvent être responsables d'infections diverses chez l'animal : dermite exsudative du porcelet (S. hyicus), furonculose du chien (S. pseudintermedius)...
Du point de vue épidémiologie, le caractère ubiquitaire des staphylocoques, leur relativement bonne résistance aux mécanismes d'épuration naturels (oxydation, dessiccation), leur grande capacité à donner des mutants résistants aux antibiotiques, expliquent le maintien — voire l'augmentation — de la fréquence des infections staphylococciques. Ceci est particulièrement net en milieu hospitalier, où ces germes trouvent en outre un rassemblement de patients leur assurant un excellent terrain de développement. Ils partagent avec les bacilles pyocyaniques le premier rôle dans les infections nosocomiales.
Propriétés bactériologiques
Morphologie
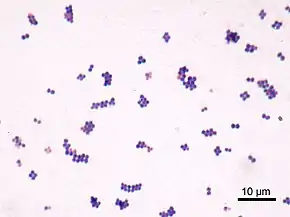
Les staphylocoques sont des coques gram positifs arrondis, en amas réguliers ou par deux, de 0,7 à 1 µm de diamètre (les S. blancs sont souvent un peu plus volumineux que les S. dorés), immobiles, dépourvus de spores, présentent une capsules. Ils apparaissent le plus souvent en amas dits en grappes de raisin. Les amas sont particulièrement nets dans des préparations faites à partir de cultures sur milieux solides. Dans des cultures liquides et produits pathologiques, les amas sont beaucoup plus petits (3 à 4 éléments — ou même formes isolées ou en paires = diplocoques).
Culture
Les staphylocoques poussent aisément sur les milieux usuels, donnant un trouble uniforme en milieux liquides et, sur gélose, des colonies rondes, lisses, blanches (S. blancs ou S. albus) ou dorées (S. dorés ou S. aureus), opaques, atteignant 2 à 3 mm de diamètre (ou un enduit confluent si l'ensemencement est massif). Ils sont catalase positifs et oxydase négatifs, aérobies - anaérobies facultatifs, fermentant le glucose sans gaz. Outre la couleur des colonies, qui n'est souvent pas assez tranchée, les staphylocoques potentiellement pathogènes se distinguent des commensaux par les caractères suivants :
- Coagulase : S. aureus + S. albus -
- Désoxyribonucléase : S. aureus + S. albus -
- Phosphatase : S. aureus + S. albus -
- Fermentation du mannitol : S. aureus + S. albus -
- Tolérance au NaCl (7,5 %) : S. aureus ++ S. albus -
- Noircissement du tellurite : S. aureus + S. albus -
Certaines de ces propriétés sont mises à profit dans les préparations de milieux sélectifs permettant l'isolement à partir de produits polycontaminés. Le milieu de Chapman, par exemple, inhibe le développement de nombreux contaminants par sa teneur en NaCl (7,5 %) et permet de reconnaître les colonies de staphylocoques dorés par la fermentation du mannitol. Le milieu de Baird et Parker contient notamment du tellurite (la réduction de ce sel par le S. doré donne aux colonies une coloration noire).
Milieux d'isolement utilisés
- Milieu non sélectif :
- gélose nutritive (ou gélose ordinaire) ;
- gélose Trypticase soja ;
- gélose BCP (Bromocrésolpourpre + lactose).
- Milieu sélectif :
- gélose Chapman (milieu hypersalin à 75 g/l de NaCl, mannitol comme substrat pour caractère différentiel) ;
- gélose Baird Parker (Identification facultative de staphylococcus aureus).
Caractéristiques de culture
Les cultures se développent dès 24 heures et résistent au vieillissement et à la diminution de l'activité de l'eau (ou activity of water aw) pendant plusieurs mois.
- Aspect en bouillon : trouble homogène le long du tube.
- Aspect sur gélose ordinaire : en aérobiose, colonies assez grandes de environ 1 mm de diamètre, rondes, régulières, bombées, lisses et brillantes : de type Smooth. Elles sont aussi crème ou pigmentées en jaune (suspicions de staphylococcus aureus si jaune-or).
Remarque : l'aspect des colonies peut varier et devenir de type Rugh si les colonies sont trop anciennes : colonies mates, peu bombées, légèrement irrégulières et d'aspect sèches.
- Aspect sur gélose Baird Parker : en aérobiose, colonies noires de 1 mm environ, (avec une zone claire de 2 mm de diamètre et un précipité dans la zone claire pour les staphylococcus aureus)
- Milieu sélectif de Chapman : mélange contenant du NaCl, du mannitol et du rouge de phénol (pour staphylococus aureus)
Caractéristiques biochimiques
L'activité métabolique des staphylocoques est relativement bien marquée. Ils possèdent de nombreuses enzymes capables de catalyser de nombreux substrats. Ces enzymes varient d'une espèce à une autre.
- Cependant, tous les staphylocoques ont les caractéristiques suivantes :
- présence d'une catalase qui décompose l'eau oxygénée, contrairement aux streptocoques qui ne possèdent pas de catalase ;
- absence d'une oxydase ;
- fermentation du glucose sans production de gaz.
- Les caractéristiques étudiées sur les staphylocoques sont :
- l'utilisation de nombreux oses et osides (voir glucides) dont le lactose et le glucose ;
- l'utilisation des nitrates (présence de nitrate-réductase) ;
- les acides de fermentation (test VP et Test du rouge de méthyle) ;
- et la présence de nombreuses enzymes : phosphatase alcaline (PAL), arginine dihydrolase (ADH), uréase… ;
- recherche de la staphylocoagulase ou coagulase libre (mise en culture dans du plasma de lapin) ;
- recherche de la coagulase liée (soit par un test d'agglutination sur lame direct, c'est la reconnaissance entre un récepteur spécifique à une molécule, le fibrinogène) ;
- recherche de la thermonucléase (le bouillon est chauffé au bain-marie à 70 °C pendant 5 minutes puis on ensemence à l'aide d'une strie unique un milieu à base d'ADN et de bleu de toluidine).
Enzymes et toxines
1) Coagulase.
C'est généralement la principale (souvent la seule) substance recherchée pour établir la nature « aureus » d'un staphylocoque. Il existe, en réalité, deux coagulases généralement associées : la coagulase liée ou clumping factor qui provoque la formation de grumeaux lorsqu'on émulsionne une culture de staphylocoques dans une goutte de plasma sanguin sur lame et la coagulase sécrétée qui provoque l'apparition d'un caillot lorsqu'on cultive le staphylocoque dans un milieu additionné de plasma (dilué à 1/4).
Ces coagulases semblent bien jouer un rôle dans la pathogénie des infections in vivo : elles permettent en effet au staphylocoque qui ne possède normalement pas de capsule, de s'en procurer une en coagulant autour de lui le plasma ou les humeurs intercellulaires.
2) Hémolysines.
La plus importante est l'hémolysine alpha qui lyse, in vitro, les hématies de lapin. Elle est caractéristique des S. dorés d'origine humaine.
In vivo, elle détruit les membranes cellulaires, provoquant des nécroses (nécrotoxine) et peut même être létale (danger des solutions injectables contaminées par des staphylocoques !).
Les hémolysines bêta (agissant sur les hématies de mouton) et gamma (agissant sur les hématies humaines) sont inconstantes et se trouvent parfois aussi chez le S. albus.
3) La leucocidine de Panton-Valentine lyse les neutrophiles, les monocytes et les macrophages.
4) L'entérotoxine sécrétée par certaines souches, joue un rôle dans 2 maladies intestinales d'origine staphylococcique. D'abord une intoxication alimentaire due à l'accumulation de cette entérotoxine par le développement d'une souche productrice dans un aliment fait à l'avance, ayant séjourné un certain temps à une température supérieure à 10 °C. Les aliments le plus souvent en cause sont les desserts à base de laitages et crèmes pâtissières ainsi que diverses sauces : mayonnaise, etc. (Le staphylocoque tolère aussi bien d'assez fortes concentrations de sucre que de NaCl). Cette entérotoxine est thermostable, elle peut donc rester active dans un aliment réchauffé dont les staphylocoques ont été tués. Elle provoque après une incubation brève : 3 à 6 heures, un état nauséeux, avec vomissements éventuels et diarrhées violentes. Ces troubles, souvent intenses et angoissants, disparaissent sans trace après quelques heures. C'est la plus fréquente et la plus bénigne des intoxications alimentaires d'origine bactérienne.
Par contre, l'entérite fulminante à staphylocoques présente une extrême gravité et une grosse mortalité. Il s'agit cette fois du développement des staphylocoques producteurs d'entérotoxine dans l'intestin même. Normalement, les staphylocoques de passage dans l'intestin ne peuvent s'y implanter ni s'y multiplier, étant inhibés par la flore commensale normale. Mais si celle-ci est éliminée par des antibiotiques auxquels le staphylocoque résiste, cette implantation devient possible : c'est donc une complication de l'antibiothérapie, survenant principalement en milieu hospitalier, surtout chez des opérés du système digestif dont on a tenté de stériliser le contenu intestinal en vue de l'opération. Il importe dans ces cas d'obtenir un diagnostic rapide et de trouver un produit auquel la souche est encore sensible (par ex. staphylomycine, oxacilline).
La mise en évidence de cette entérotoxine est malaisée. Les Ac. pour mise en évidence immunologique ne sont guère disponibles (il y a d'ailleurs plusieurs types antigéniques). En dehors de l'Homme, seuls certains singes et le petit chat de 2 à 8 semaines sont sensibles.
Antigènes
La paroi des staphylocoques contient 2 antigènes principaux :
- Une protéine A vis-à-vis de laquelle tout le monde a des Ac. ;
- L'acide teichoïque, à base de polyribitol chez S. aureus et de polyglycérol chez S. albus. Cet ac. teichoique est très résistant au lysozyme et aux enzymes des globules blancs.
Il existe de nombreuses variétés antigéniques mais le typage des staphylocoques par l'étude de ces variétés (sérotypie) n'est guère entré dans la pratique.
Par contre, la lysotypie peut rendre de grands services en épidémiologie.
Cette méthode permet aussi de déterminer si plusieurs cas dans un service sont dus à une même souche et de rechercher quels membres du personnel soignant sont porteurs de cette souche.
Méthodes de diagnostic
Examen microscopique
Cet examen donne une première orientation et permet de déterminer si la flore est abondante ou non, pure ou mixte.
Culture
La culture permet de déterminer si c'est un S. aureus ou albus (test de coagulase). L'antibiogramme est généralement nécessaire vu les sensibilités très variables. Addition de pénicillinase au milieu si le produit provient d'un malade en traitement.
Sérologie
La sérologie est peu utilisée. Outre les antigènes de paroi cités plus haut, les diverses toxines pourraient faire l'objet de réactions Ag.-Ac. Mais on ne constate guère de variations notables entre les taux d'Ac. des individus sains, malades ou convalescents. On recherche parfois le taux des antistaphylolysines en fonction du diagnostic d'ostéomyélite.
Prophylaxie, immunité et traitement
En général
- Mesures d'hygiène générale.
- Nettoyage et désinfection des plaies.
- Débarrasser les malades et leur entourage des germes portés dans le nez (pommades à base de néomycine, bacitracine, chlorhexidine, etc.)
- En rapport avec l'entérotoxine : attention particulière aux infections superficielles chez les cuisiniers ; réfrigération des aliments faits à l'avance.
En milieu hospitalier
- Renforcement des mêmes mesures (asepsie, lutte contre les poussières, lampes à UV dans certains locaux, ventilation, etc.)
- S'il y a des cas d'infection dans un service, on procèdera à la détection des porteurs de souches dangereuses (lysotypes 80 - 81 du groupe III), polyrésistantes et leur élimination jusqu'à ce qu'ils en soient débarrassés.
- Ensemencement éventuel avec une souche peu virulente qui, par interférence, entraverait la colonisation par les souches dangereuses.
- Politique d'emploi des antibiotiques tenant compte que, dès qu'un antibiotique est largement utilisé dans une communauté, des souches résistantes apparaissent. On devrait donc n'employer que deux ou trois produits dans tout l'hôpital et en changer tous les quatre à six mois. De toute façon, il faut maintenir en réserve deux ou trois produits sûrs à n'employer que dans les cas graves et urgents.
- Isolement des malades contagieux et de ceux dont la sensibilité est accrue (immunosuppression, diabète, brûlés graves).
- Surveillance de ces mesures et de la fréquence des contaminations par un « épidémiologiste d'hôpital ».
Immunité
Le rôle des anticorps est discuté : si d'une part, on ne constate guère de concordance entre leur taux et la résistance aux infections staphylococciques, celles-ci sont, d'autre part, beaucoup plus fréquentes chez les patients atteints de hypo-gammaglobulinémie. Il est vraisemblable que la résistance résulte de l'interaction de mécanismes sériques et cellulaires.
L'efficacité de la vaccinothérapie est également discutée : mais on constate souvent l'interruption d'une succession de furoncles par l'application de cette vaccination (de préférence avec un autovaccin, vu la multiplicité des souches.
Traitement
- Pénicillines :
- Pénicilline G : environ 50 % des souches « sauvages » sont encore sensibles mais les souches d'hôpitaux sont régulièrement résistantes.
- Pénicillines résistantes à la pénicillinase (méthicilline, oxacilline, etc.) et céphalosporines: les souches « sauvages » sont généralement sensibles, les souches d'hôpitaux présentent des fréquences de résistance variables en fonction de la fréquence de leur emploi.
- Macrolides, tétracyclines : les souches « sauvages » sont généralement sensibles mais les souches d'hôpitaux sont généralement résistantes.
- Antibiotiques dits de réserve, généralement peu de résistance : staphylomycine, pristinamycine, néomycine, kanamycine, vancomycine, ristocétine, acide fusidique, teicoplanine, linézolide.
- Bactériophagiques : traitement à base de virus attaquant les bactéries et découvert par le Français Félix d'Hérelle. La phagothérapie est toujours employée et développée dans les pays de l'ancienne Union soviétique. Dans les pays occidentaux, des patients victimes d'infection par S. aureus multi-résistantes se regroupent pour faciliter l'accès aux traitements bactériophagiques étrangers[2],[3],[4],[5]. Elle fait l'objet de recherches à l'Institut Pasteur[6] mais son utilisation demeure soumise à ATUn par l'ANSM[7].
Espèces appartenant au genre Staphylococcus
Selon la LPSN[8]
En avril 2021 les espèces suivantes sont recensées :
- Staphylococcus aureus Rosenbach 1884 : espèce type de description du genre
- Staphylococcus aureus subsp. aureus (Rosenbach 1884) De La Fuente et al. 1985
- Staphylococcus aureus subsp. anaerobius De La Fuente et al. 1985
- Staphylococcus agnetis Taponen et al. 2012
- Staphylococcus argensis Heß & Gallert 2015
- Staphylococcus argenteus Tong et al. 2015
- Staphylococcus arlettae Schleifer et al. 1985
- Staphylococcus auricularis Kloos & Schleifer 1983
- Staphylococcus borealis Pain et al. 2020
- Staphylococcus caeli McFayden et al. 2019
- Staphylococcus capitis Kloos & Schleifer 1975
- Staphylococcus capitis subsp. capitis (Kloos & Schleifer 1975) Bannerman & Kloos 1991
- Staphylococcus capitis subsp. urealyticus corrig. Bannerman & Kloos 1991
- Staphylococcus caprae Devriese et al. 1983
- Staphylococcus carnosus Schleifer & Fischer 1982
- Staphylococcus carnosus subsp. carnosus (Schleifer & Fischer 1982) Probst et al. 1998
- Staphylococcus carnosus subsp. utilis Probst et al. 1998
- Staphylococcus casei (Place et al. 2003) Madhaiyan et al. 2020 : reclassement de S. succinus subsp. casei
- Staphylococcus chromogenes (Devriese et al. 1978) Hájek et al. 1987 : reclassement de S. hyicus subsp. chromogenes
- Staphylococcus coagulans (Igimi et al 1990) Madhaiyan et al. 2020
- Staphylococcus cohnii Schleifer & Kloos 1975 : reclassement de S. cohnii subsp. cohnii
- Staphylococcus condimenti Probst et al. 1998
- Staphylococcus cornubiensis Murray et al. 2018
- Staphylococcus croceilyticus (Pantůček et al. 2013) Madhaiyan et al. 2020
- Staphylococcus debuckii Naushad et al. 2019
- Staphylococcus delphini Varaldo et al. 1988
- Staphylococcus devriesei Supré et al. 2010
- Staphylococcus durrellii Fountain et al. 2021
- Staphylococcus edaphicus Pantůček et al. 2018
- Staphylococcus epidermidis (Winslow & Winslow 1908) Evans 1916
- Staphylococcus equorum Schleifer et al. 1985
- Staphylococcus equorum subsp. equorum (Schleifer et al. 1985) Place et al. 2003
- Staphylococcus equorum subsp. linens Place et al. 2003
- Staphylococcus felis Igimi et al. 1989
- Staphylococcus gallinarum Devriese et al. 1983
- Staphylococcus haemolyticus Schleifer & Kloos 1975
- Staphylococcus hominis Schleifer & Kloos 1975
- Staphylococcus hominis subsp. hominis (Kloos & Schleifer 1975) Kloos et al. 1998
- Staphylococcus hominis subsp. novobiosepticus Kloos et al. 1998
- Staphylococcus hyicus (Sompolinsky 1953) Devriese et al. 1978 : reclassement de S. hyicus subsp. hyicus
- Staphylococcus intermedius Hájek et al. 1976
- Staphylococcus kloosii Schleifer et al. 1985
- Staphylococcus lentus (Kloos et al. 1976) Schleifer et al. 1983
- Staphylococcus lloydii Fountain et al. 2021
- Staphylococcus lugdunensi Freney et al. 1988
- Staphylococcus lutrae Foster et al. 1997
- Staphylococcus massiliensis Al Masalma et al. 2010
- Staphylococcus microti Nováková et al. 2010
- Staphylococcus muscae Hájek et al. 1992
- Staphylococcus nepalensis Spergser et al. 2003
- Staphylococcus pasteuri Chesneau et al. 1993
- Staphylococcus petrasii Pantůček et al. 2013
- Staphylococcus petrasii subsp. petrasii Pantůček et al. 2013 : reclassement de S. petrasii
- Staphylococcus petrasii subsp. jettensis (De Bel et al. 2013) De Bel et al. 2014 : reclassement de S. jettensis
- Staphylococcus pettenkoferi Trülzsch et al. 2007
- Staphylococcus piscifermentans Tanasupawat et al. 1992
- Staphylococcus pragensis (Švec et al. 2015) Madhaiyan et al. 2020
- Staphylococcus pseudintermedius Devriese et al. 2005
- Staphylococcus pseudoxylosus McFayden et al. 2019
- Staphylococcus rostri Riesen & Perreten 2010
- Staphylococcus saccharolyticus (Foubert & Douglas 1948) Kilpper-Bälz & Schleifer 1984
- Staphylococcus saprophyticus (Fairbrother 1940) Shaw et al. 1951
- Staphylococcus saprophyticus subsp. bovis Hájek et al. 1996
- Staphylococcus saprophyticus subsp. saprophyticus (Fairbrother 1940) Hájek et al. 1996
- Staphylococcus schleiferi Freney et al. 1988
- Staphylococcus schleiferi subsp. schleiferi (Freney et al. 1988) Igimi et al. 1990
- Staphylococcus schleiferi subsp. coagulans Igimi et al. 1990
- Staphylococcus schweitzeri Tong et al. 2015
- Staphylococcus simiae Pantůček et al. 2005
- Staphylococcus simulans Kloos & Schleifer 1975
- Staphylococcus succinus Lambert et al. 1998 : reclassement de S. succinus subsp. succinus
- Staphylococcus urealyticus corrig. (Kloos & Wolfshohl 1991) Madhaiyan et al. 2020 : reclassement de S. cohnii subsp. ureilyticus
- Staphylococcus warneri Kloos & Schleifer 1975
- Staphylococcus xylosus Schleifer & Kloos 1975.
Certaines espèces autrefois comptées parmi les Staphylocoques ont été déplacées vers d'autres genres, notamment le genre Mammalicoccus créé en 2020 :
- Macrococcus caseolyticus (Schleifer et al. 1982) Kloos et al. 1998 : reclassement de S. caseolyticus
- Mammalicoccus fleurettii (Vernozy-Rozand et al. 2000) Madhaiyan et al. 2020 : reclassement de S. fleurettii
- Mammalicoccus lentus (Kloos et al. 1976) Madhaiyan et al. 2020 : reclassement de Staphylococcus lentus
- Mammalicoccus sciuri (Kloos et al. 1976) Madhaiyan et al. 2020 : reclassement de S. sciuri
- Mammalicoccus stepanovicii (Hauschild et al. 2012) Madhaiyan et al. 2020 : reclassement de S. stepanovicii
- Mammalicoccus vitulinus (Webster et al. 1994) Madhaiyan et al. 2020 : reclassement de S. vitulinus
- Mammalicoccus vitulinus (Webster et al. 1994) Madhaiyan et al. 2020 : reclassement de S. pulvereri.
Notes et références
- Espèce décrite et isolée à Lyon en 1988. cf. F. Lecuire, D. Gontier, J. Carrere, M. Basso, I. Benareau, J. Rubini, « Infections à Staphylocoque lugdunensis sur prothèses articulaires: À propos de 7 cas », Revue de chirurgie orthopédique et réparatrice de l'appareil moteur, vol. 93, no 1, , p. 88
- « AVIBEP - Association pour la Phagothérapie », sur AVIBEP - Phagothérapie (consulté le )
- « Phages-Sans-Frontières – Ensemble nous pouvons tenter de changer le destin ! », sur phages-sans-frontieres.com (consulté le )
- « Association PHAG ESPOIRS », sur Association PHAG ESPOIRS (consulté le )
- « EuroPhages - Sauver les vies de milliers de Français grâce aux bactériophagiques », sur EuroPhages (consulté le )
- « Interactions Bactériophages Bactéries chez l’Animal », sur pasteur.fr
- Agence nationale de sécurité du médicament et des produits de santé, « Compte rendu de séance du CSST Phagothérapie en date du 24 mars 2016 » [PDF], sur ansm.sante.fr (consulté le )
- https://lpsn.dsmz.de/genus/staphylococcus, consulté le 11/04/21.
Bibliographie
- Dr Chantal Ruf, Variation de l’activité bactéricide en fonction du pH et de l’anaérobiose : Application à la Gentamicine et à la Sosomicne sur Staphylococcus Aureus, Paris V - Descartes, thèse de médecine, 1976, 37pp.
Voir aussi
- Portail de la microbiologie
- Portail de la médecine