Anguillulose
L'anguillulose ou strongyloïdose est une parasitose humaine provoquée par un nématode (ver rond) minuscule, Strongyloides stercoralis (ou anguillule) dont les femelles parthénogénétiques parasites, profondément fixées dans la muqueuse duodénale, déterminent la maladie. Il existe d’autres vers du groupe Strongyloides notamment Strongyloides fülleborni, qui infecte les chimpanzés et les babouins et peut provoquer des infections limitées chez l'homme.
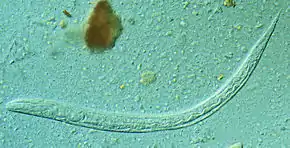
Le parasite
L'anguillule parasite de l'intestin est une minuscule femelle parthénogénétique strongyloïde, très mince et longue de 2 à 3 mm. D'autres formes adultes, mâles et femelles stercoraux (qui concernent les excréments) existent seulement à l'état libre ; elles sont rhabditoïdes et atteignent 1 mm pour la femelle, un peu moins pour le mâle.
La femelle parthénogénétique vit profondément insérée dans la muqueuse duodéno-jéjunale. Non hématophage, elle pond, dans la muqueuse, des œufs ressemblant à ceux de l'ankylostome, mais longs de 50 microns seulement, morulés dès la ponte, et qui évoluent très vite sur place. Au départ des larves (rhabditoïdes) qui en sortent, 3 cycles évolutifs sont possibles :
- un cycle indirect sexué (cycle long) ;
- un cycle direct parthénogénétique (cycle court) ;
- un cycle hyper-infectieux endogène (cycle d'auto-infestation).
La maladie sévit essentiellement dans les régions tropicales et subtropicales, mais des cas surviennent également dans les régions tempérées (y compris le sud des États-Unis), où elle est plus fréquemment rencontrée dans les zones rurales, en institutions et dans des groupes socio-économiques défavorisés. La maladie dans les zones tempérées est due à des porteurs venant des zones d'endémie traditionnelle.
Épidémiologie
L'infection concernerait entre 30 et 100 millions de personnes dans le monde[1]. Elle est maximale en Afrique subsaharienne, en Asie du Sud-Est et en Amérique du Sud[2].
Transmission
Elle se fait le plus souvent par pénétration des larves dans la peau (marche sans protection dans une zone contaminée, souvent sur une plage par le contact de la peau avec le sable). Elle peut se faire également de manière sexuelle (rapports anaux[3]), la dissémination étant fécale. Des cas de transmissions par transplantation d'organe ont été décrits[4].
Clinique
Bien que voisine de l'ankylostomose sur le plan biologique, l'anguillulose s'en différencie nettement dans sa traduction clinique :
- la période d'infestation, qu'elle soit trans-cutanée ou trans-muqueuse, est rarement individualisée. Elle peut se caractériser par une douleur au point d'introduction, un prurit qui peut durer plusieurs jours[2].
- la période d'invasion n'aboutit qu'exceptionnellement à un syndrome de Löffler notable, et, seule, une éosinophilie à pics multiples traduit les migrations larvaires trans-organiques successives. Dans les formes chroniques, la migration de la larve dans la peau est particulièrement rapide (5-15 cm/h) entraînant une trace rougeâtre douloureuse[2]. Il peut exister une toux, un essoufflement.
- la période d'état est dominée par les troubles digestifs. Il n'y a pas de tableau d'anémie : les femelles parthénogénétiques n'étant ni hématophages ni toxigènes.
Les signes intestinaux sont très marqués; ils signent la duodénite et la péri-duodénite : crises douloureuses violentes, durant 3 à 4 jours, évoluant cycliquement toutes les 3 semaines ; crises diarrhéiques prolongées, à type entéritique ou colitique, alternant avec de longues phases de constipation ; crises urticariennes généralisées ou localisées aux régions périnéales et fessiaires.
Dans les infestations massives des cycles hyper-infectieux, signalées habituellement par la constatation de "larva currens" périnéales rayonnant autour de l'anus, il n'est pas rare qu'apparaissent des troubles de l'assimilation, une altération profonde de l'état général, puis un état cachectique ouvrant la porte aux affections intercurrentes rapidement mortelles.
Autrefois l'apanage des sujets débilités et dénutris, cette anguillulose maligne peut compliquer une anguillulose banale chez un sujet immunodéprimé (atteint du SIDA, ou soumis aux corticoïdes ou aux immuno-dépresseurs).
Strongyloïdose non compliquée
Elle est asymptomatique dans deux tiers des cas[5]. certaines formes peuvent se déclarer des décennies après l'infection initiale[6]
Les symptômes gastro-intestinaux que l'on peut rencontrer sont des douleurs abdominales et de la diarrhée.
Les symptômes pulmonaires comprenant notamment le syndrome de Löffler peuvent se produire pendant la migration pulmonaire des larves strongyloïdes.
Les manifestations dermatologiques se présentent sous forme d'éruption d'urticaire dans la région des fesses et de la taille.
Une éosinophilie sanguine est généralement présente.
La strongyloïdose peut devenir chronique et être complètement asymptomatique (mais se « réveiller » en cas d'immunodéficience).
Strongyloïdose diffuse
Cette forme se développe chez des patients immunodéprimés, atteints de strongyloïdose chronique. les larves peuvent alors migrer et se disséminer dans l'ensemble des organes. On a observé des cas chez des malades atteints de la lèpre, de syphilis tertiaire, d'aplasie médullaire, de malnutrition avancée, de tuberculose ou après irradiation. Elle peut survenir même après un traitement par corticoïdes de courte durée[7]. Le SIDA ne semble pas être à risque des formes diffuses mais les formes communes restent toutefois plus fréquentes[2].
La maladie se manifeste par des douleurs abdominales, des complications pulmonaires, neurologiques, abdominales et un état de choc, elle est potentiellement mortelle. L'éosinophilie est souvent présente mais pas toujours.
Il est recommandé de rechercher une strongyloïdose chronique chez des patients qui doivent recevoir un traitement immunosuppresseur en pays d'endémie.
Diagnostic
Un taux élevé de polynucléaires éosinophiles dans le sang est retrouvé.
L'association avec l'ankylostomose rend fréquemment le diagnostic délicat. Il est très difficile de distinguer les larves d'ankylostome des larves strongyloïdes. Toute diarrhée au long cours, évoluant par crises successives, avec éosinophilie commandera la confirmation parasitologique par examens de laboratoire. Le diagnostic repose sur l'identification au microscope des larves (rhabditoïdes et parfois strongyloïdes) dans les selles (examen parasitologique des selles) ou dans le liquide duodénal. L'examen des prélèvements est nécessaire, mais pas toujours suffisant, parce que l'examen direct des selles est relativement peu sensible et nécessite d'être répété sur plusieurs examens. Le délai de positivité de ces examens après contamination peut atteindre un mois[2].
Les selles peuvent être examinées au microscope :
- directement
- après concentration
- après la récupération des larves par la technique de Baermann
- après culture par la technique de papier filtre de Harada-Mori
- après culture sur gélose d'Agar.
Les techniques de culture sont plus sensibles, mais ne sont pas toujours exécutables en pratique courante. L'examen direct doit être fait sur les selles fraîchement recueillies, qui n'ont pas eu le temps de se refroidir, parce que les larves d'ankylostome s'enkystent lorsque la température baisse.
Le fluide duodénal peut être analysé en utilisant des techniques telles que l'aspiration duodénale. Des larves peuvent également être détectées dans les expectorations chez les patients atteints de strongyloïdose diffuse.
La détection des anticorps anti-strongyloïdes (sérologie) dans le sang a une bonne sensibilité et spécificité, même s'il peut exister des réactions croisées avec d'autres parasitoses (filariose par exemple)[8].
Traitement
Le médicament de référence pour le traitement de la strongyloïdose non compliquée est l’ivermectine en une prise unique ou en deux prises séparées de deux semaines. Il existe également d'autres molécules efficaces, l’albendazole et le thiabendazole (à la dose de 25 mg/kg deux fois par jour pendant 5 jours).
Tous les patients qui présentent un risque de strongyloïdose diffuse devraient être traités. Dans cette éventualité, la durée optimale du traitement n’est pas clairement établie.
Prévention
Le port de chaussures montantes, surtout dans les régions boueuses, ainsi que le nettoyage et séchage immédiats et vigoureux de la peau, en cas de contact avec la boue, suffisent à prévenir la transmission. Il en est de même pour l'ankylostomose.
Notes et références
- World Health Organization, Neglected tropical diseases—strongyloidiasis, 2013
- Greaves D, Coggle S, Pollard C, Aliyu SH, Moore EM, Strongyloides stercoralis infection, BMJ 2013;347:f4610
- Sorvillo F, Mori K, Sewake W, Fishman L, Sexual transmission of Strongyloides stercoralis among homosexual men, Br J Vener Dis, 1983;59:342
- Hamilton KW, Abt PL, Rosenbach MA et al. Donor-derived Strongyloides stercoralis infections in renal transplant recipients, Transplantation, 2011;91:1019-24
- Valerio L, Roure S, Fernandez-Rivas G et al. Strongyloides stercoralis, the hidden worm. Epidemiological and clinical characteristics of 70 cases diagnosed in the North Metropolitan Area of Barcelona, Spain, 2003-2012, Trans R Soc Trop Med Hyg, 2013;107:465-70
- Prendki V, Fenaux P, Durand R, Thellier M, Bouchaud O, Strongyloidiasis in man 75 years after initial exposure, Emerg Infect Dis, 2011;17:931-2
- Ghosh K, Strongyloides stercoralis septicaemia following steroid therapy for eosinophilia: report of three cases, Trans R Soc Trop Med Hyg, 2007;101:1163-5.
- Van Doorn HR, Koelewijn R, Hofwegen H et al. Use of enzyme-linked immunosorbent assay and dipstick assay for detection of Strongyloides stercoralis infection in humans, J Clin Microbiol, 2007;45:438-42
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- Orphanet
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
Bibliographie
- (en) Pirisi M, Salvador E, Bisoffi Z et al. « Unsuspected strongyloidiasis in hospitalised elderly patients with and without eosinophilia » Clin Microbiol Infect. 2006;12: 787-92.
- (en) Siddiqui AA, Berk SL. « Diagnosis of Strongyloides stercoralis infection » Clin Infect Dis. 2001;33:1040-7.
- (en) Keiser PB, Nutman TB. « Strongyloides stercoralis in the immunocompromised population » Clin Microbiol Rev. 2004;17:208-17.
- (en) Concha R, Harrington W Jr, Rogers AI. « Intestinal strongyloidiasis : Recognition, management, and determinants of outcome » J Clin Gastroenterol. 2005;39:203-11.
- (en) Viney ME, Brown M, Omoding NE et al. « Why does HIV infection not lead to disseminated strongyloidiasis? » J Infect Dis. 2004;190:2175-80.
- (en) Safdar A, Malathum K, Rodriguez SJ, Husni R, Rolston KV. « Strongyloidiasis in patients at a comprehensive cancer center in the United States » Cancer 2004;100:1531-6.
- Portail de la médecine
- Portail de la parasitologie