Sulbutiamine
La sulbutiamine est une molécule dérivée de la vitamine B1 (thiamine).
| Sulbutiamine | |

| |
| Identification | |
|---|---|
| Nom UICPA | disulfure de bis-(isobutyryloxy-2ethyl)-1(n-((amino-4methyl-2pyrimidynil)-5methyl)formamido) -2propene-1yle |
| No CAS | |
| No ECHA | 100.019.944 |
| No CE | 221-937-3 |
| Code ATC | A11 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C32H46N8O6S2 [Isomères] |
| Masse molaire[1] | 702,888 ± 0,042 g/mol C 54,68 %, H 6,6 %, N 15,94 %, O 13,66 %, S 9,12 %, |
| Données pharmacocinétiques | |
| Demi-vie d’élim. | 5 heures |
| Excrétion | |
| Considérations thérapeutiques | |
| Voie d’administration | orale |
| Unités du SI et CNTP, sauf indication contraire. | |
Elle est utilisée comme psychostimulant non-amphétaminique, notamment en cas de trouble de la mémoire et d'asthénie.[réf. nécessaire] La sulbutiamine est commercialisée par Servier sous la marque Arcalion.
Historique
La sulbutiamine a été découverte lors de la recherche de dérivés de thiamine (la vitamine B1) qui s'est faite après sa synthèse en 1936. Cette recherche avait pour but de trouver des molécules semblables à la thiamine ayant des propriétés pharmacocinétiques plus performantes que celle-ci. En 1951, le premier dérivé découvert fut l'allithiamine, par la suite plusieurs autres dérivés furent découverts dont la sulbutiamine.
Deux pistes principales de synthèse concernant la sulbutiamine ont été élaborées.
La première synthèse de la sulbutiamine a été réalisée en 1965 par Taisho Pharmaceutical Co. LTD[2] selon de nombreux articles scientifiques. Le laboratoire Taisho Parmaceutical Co. avait pour but de soigner les troubles neurologiques causés par le béribéri[3]. Pour cela, il fallait trouver une molécule, hautement lipophile[4], plus apte à diffuser à travers le plasma contenu dans le corps humain que la thiamine et ayant les mêmes propriétés que celle-ci : ce fut la sulbutiamine.
Selon d'autres sources, la synthèse aurait été faite dans les années 1970 mais n'aurait pas de date précise ; cependant, la plus vieille référence de cette synthèse est datée de 1973.
De nos jours, les recherches concernant la sulbutiamine se concentrent essentiellement sur le cerveau, notamment sur la mémoire et l'asthénie. Des tests ont été effectués récemment pour étudier les effets du principe actif sur des patients atteints de la maladie d'Alzheimer (à des stades peu avancés) et les résultats obtenus se montrent concluants.
Synthèse
Il existe différentes méthodes pour obtenir la sulbutiamine :
- synthèse à partir de la thiamine, extraite de produits naturels ;
- biosynthèse par un organisme ;
- synthèse chimique complète via la synthèse de la thiamine.
Extraction
La thiamine (vitamine B1), principal constituant du principe actif, est très présente dans l'alimentation. On la retrouve notamment dans les céréales mais aussi dans la viande. La thiamine a par exemple été découverte en 1926 dans l'enveloppe de son du riz complet, utilisé alors pour soigner le béribéri. Aujourd'hui, il est toujours possible de l'extraire de cette façon bien que les méthodes aient évolué. On utilise notamment la chromatographie en phase liquide à haute performance (HPLC) sur de la farine de riz en solution aqueuse[5].
La thiamine est ensuite récupérée sous la surveillance d'un spectrofluorimètre. Les longueurs d'onde d'excitation et d'émission sont respectivement de 375 et 435 nm. Grâce à cette extraction, on peut obtenir un rendement théorique de thiamine de 94-101 %. On fait ensuite subir à la thiamine une oxydation pour former la sulbutiamine. La molécule de sulbutiamine étant toujours sous brevet, l'oxydant est inconnu.
Biosynthèse
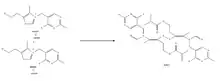
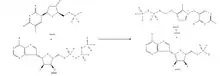
La synthèse biologique se fait à partir de deux molécules de thiamine ; ces dernières subissent une oxydation responsable de l'ouverture du cycle thiazole. Une liaison va se créer entre les deux soufres (pont disulfure). Cette oxydation est menée par des enzymes présentes dans le corps. La thiamine est elle-même synthétisée par les champignons, les plantes et les bactéries. Ses groupements pyrimidiques et thiazole sont synthétisés séparément puis sont combinés sous l'action d'une enzyme, la thiamine phosphate synthase, en une thiamine monophosphate (TMP). Chez la plupart des bactéries, une hydrolyse de TMP avec une diphosphokinase est réalisée donnant la thiamine pyrophosphate (TPP) qui est la forme active de la thiamine.
Cependant, certaines bactéries donnent aussi de la TPP mais avec de l'ADP lors d'une hydrolyse avec une kinase.
Cette biosynthèse est régulée par des systèmes riborégulateurs appelés riboswitches[6]. Ce sont des ARN non traduits qui se lient directement avec un ligand comme la TPP. Par la suite, la thiamine active servira de coenzyme pour d'importantes voies métaboliques comme le cycle de Krebs et la voie pentoses-phosphates[7],[8].
Synthèse chimique
Cette méthode consiste également à synthétiser intégralement de façon chimique la sulbutiamine, et donc la thiamine. De nos jours, il existe de nombreuses synthèses possibles, beaucoup sont rapides mais parfois avec des rendements faibles.
Une première synthèse fut réalisée en 1936[9], en plusieurs étapes relativement simples. Elle consiste à synthétiser la thiamine via deux intermédiaires, un dérivé pyrimidique et un dérivé thiazolé, eux-mêmes synthétisés séparément.
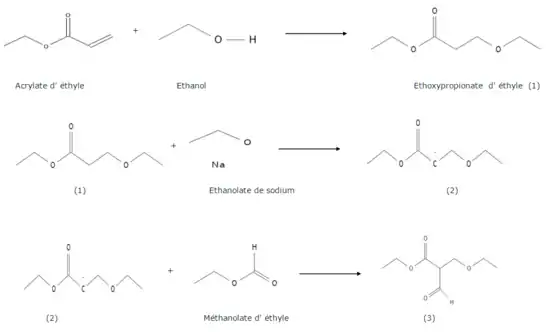
La synthèse du dérivé pyrimidique commence par l'addition nucléophile 1-4 de l'éthanol sur l'acrylate d'éthyle formant l'éthoxypropionate d'éthyle (1). Ce dernier est déprotoné par l'éthanolate de sodium (EtONa), une base forte, sur le carbone alpha pour former un carbanion (2). Ce carbanion (nucléophile) va attaquer le carbone électrophile du méthanoate d'éthyle pour former le composé (3).
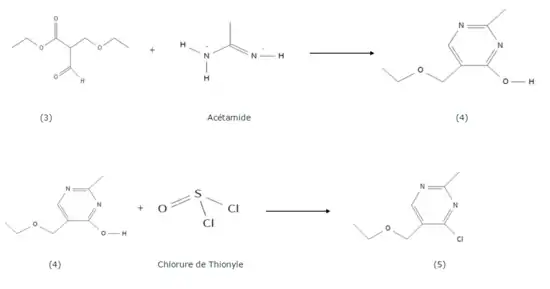
Ce composé (3) va subir une addition nucléophile par l'acétamide pour former un premier dérivé pyrimidique (4). Une chloration par le chlorure de thionyle (SOCl2) donne alors le composé (5).
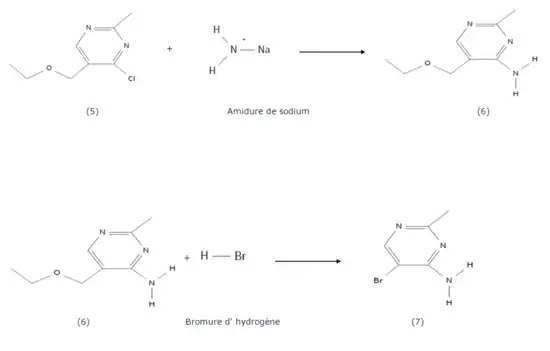
Ce dernier réagit avec l'amidure de sodium (NaNH2 ) par réaction acide-base pour donner le composé (6). Une ultime substitution nucléophile du composé (6) par le bromure d'hydrogène (HBr) donne le composé (7) qui est une fraction pyrimidique de la thiamine.
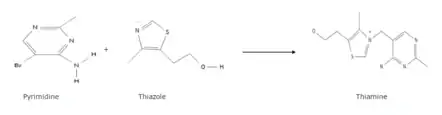
On fait réagir ce dernier avec le sulfurol, un dérivé de thiazole synthétisé à part, pour former finalement la thiamine. Le sulfurol peut notamment être obtenu par la synthèse de Hantzsch qui consiste à condenser un composé carbonylé alpha-halogéné avec un thioamide.
L'obtention de la thiamine permettra in fine la synthèse de la sulbutiamine par oxydation.
Mécanisme d'action
La sulbutiamine traverse la barrière hémato-céphalique et agit donc au niveau du cerveau. Son absorption est rapide et n'est pas influencée par les transporteurs de thiamine et ses possibles inhibiteurs. Cela induit aussi une augmentation de TTP et de thiamine libre dans le cerveau[10].
Son mécanisme d'action se révèle être un processus complexe car la molécule joue un rôle à la fois dans les systèmes dopaminergiques, sérotoninergiques, cholinergiques et noradrénergique, elle augmente également le métabolisme glucidique cérébral[11],[12],[13].
Son action est ciblée au niveau de l'hippocampe, du cortex préfrontal et du gyrus cingulaire.
Les effets de la sulbutiamine sont médiés par la TTP. Cette molécule joue un rôle dans l'activation des canaux anioniques notamment les canaux chlorures[14]. Elle participe également à la phosphorylation des protéines.
Ce composé module l'activité cholinergique en jouant sur la concentration d'acétylcholine dans l'hippocampe et en augmentant le nombre de récepteurs muscariniques, cela permet d'améliorer la formation de la mémoire à long terme et la mémoire épisodique[15]. La molécule améliore la transmission synaptique excitatrice qui est médiée par la dopamine et augmente les interactions avec les récepteurs D1 dopaminergiques[16].
La sulbutiamine facilite également la transmission du glutamate qui est nécessaire à l'activation des récepteurs NMDA et AMPA. Cependant, cela ne change pas la densité de ces récepteurs et cela induit même une diminution des sites de liaisons avec les récepteurs kaïnates. Par la suite, cela favorise la mise en place d'une potentialisation à long terme qui va servir ensuite dans certains types de mémoire[17]. Ce système glutamatergique va aussi améliorer l'encodage de la mémoire, l'apprentissage et la mémoire à court terme notamment pour la reconnaissance d'objets[17],[18],[19].
Lors d'une étude réalisée sur l'ischémie, le rôle de neuroprotection de la sulbutiamine a pu être découvert[20]. Lors de l'injection de sulbutiamine, il y a un maintien de l'activité de JNK1 (aussi appelé MAPK8), les cellules sont donc moins sensibles à l'apoptose[21]. La molécule augmente alors la viabilité neuronale et a également un rôle dans la résistance membranaire neuronale. Le composé possède cette propriété de neuroprotection grâce à son groupement thiol (pont disulfure), qui joue un rôle dans la régulation du stress oxydant. Le groupement thiol, le glutathion ou l'enzyme glutathion peroxydase servent à l'élimination de radicaux libres qui amènent, lorsqu'ils sont en excès, le phénomène de stress oxydant. La glutathion peroxydase, quant à elle, se lie à du sélénium pour transformer le peroxyde d'hydrogène (espèce oxydante) en molécule d'eau et l'enzyme est ensuite régénérée grâce à deux molécules de glutathion (GSH)[22].
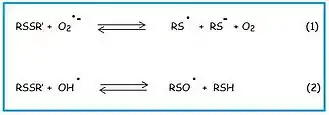
La sulbutiamine a aussi des actions moins connues, par exemple au niveau rétinal et au niveau du système nerveux périphérique. La molécule atténue la privation des facteurs trophiques dans les cellules ganglionnaires rétiniennes (RGC-5), pour cela il y a une réduction de l'expression de caspase-3 et du facteur d'induction d'apoptose AIF. Il y a aussi une réduction du stress oxydant grâce au maintien de la concentration de glutathion et même à l'augmentation de sa forme réduite dans RGC-5[23]. Au niveau du système nerveux périphérique, ce dimère de thiamine stimule la circulation sanguine ce qui explique son utilisation pour contrer les troubles érectiles[16].
Indications
Utilisée dans les états d'apathie, d'abattement, de manque d'énergie.
Clinique
Selon une étude en 2000[24], «L'inhibition psychocomportementale observée au cours des épisodes dépressifs majeurs (EDM) régresse souvent plus lentement que la dépression de l'humeur et sa persistance peut être la source d'un handicap fonctionnel important et donc un facteur de risque pour une rechute.
Méthodologie :
L'étude multicentrique, contrôlée par placebo, randomisée, en double aveugle, a évalué les effets de la sulbutiamine (Arcalion, à la dose de 600 mg par jour), sur les signes d'inhibition de déprimés majeurs traités par la clomipramine. Sa durée était de 2 mois. L'évolution de l'EDM a été surveillée grâce à la MADRS, l'HAM-A et les CGI. L'évolution de l'inhibition dépressive a été appréciée grâce à l'échelle de ralentissement dépressif, aux échelles visuelles analogiques de Norris et aux échelles d'incapacitation de Sheehan.
Résultats :
Après 4 semaines de traitement, et alors que l'évolution de l'EDM était comparable dans les deux groupes, on a observé dans le groupe sulbutiamine une amélioration plus importante de l'inhibition que dans le groupe placebo ; les effets de la sulbutiamine se sont manifestés dans toutes les dimensions de l'inhibition (affective, émotionnelle, cognitive et comportementale).
Conclusion :
La sulbutiamine peut hâter la récupération psychocomportementale des déprimés majeurs et ainsi leur faciliter le retour à une vie familiale, sociale et professionnelle normale.»
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Thiamine disulfide derivatives I : Syntheses of thiamine disulfide derivatives, Ammo T, Sakai T, Fujihira EL, Aizawa T (1965) ; Thiamine disulfide derivatives II : Biological activities of thiamine disulfide derivatives, Ammo T, Sakai T, Aizawa T, Fujihira E, Naganuma A (1965)
- Etiology and pathology of beriberi, K Inouye, E Katsura - Beriberi and Thiamine. Tokyo: Igaku Shoin Ltd, 1965
- A Review of the Biochemistry, Metabolism and Clinical Benefits of Thiamin(e) and Its Derivatives, Derrick Lonsdale
- A Simple Determination of Thiamine in Riceby High-Performance Liquid Chromatography with Post-Column Derivatization, Oryza Sativa L DOI:10.1080/10826079308019597)
- Switching the light on plant riboswitches, Samuel E. Bocobza and Asaph Aharoni (Israel) 2008
- Elucidating biosynthetic pathways for vitamins and cofactors, Michael E. Webb, Andrée Marquet, Ralf R. Mendel, Fabrice Rébeillé and Alison G. Smith (Cambridge, UK) 2007 DOI: 10.1039/b703105j
- Cofactor biosynthesis—still yielding fascinating new biological chemistry, Tadhg P Begley, Abhishek Chatterjee, Jeremiah W Hanes, Amrita Hazra and Steven E Ealick, (USA) 2008
- Synthesis of thiamine, R. R.Williams et J. K.Cline (Columbia University, New York, USA)
- (en) Bettendorff, « The compartmentation of phosphorylated thiamine derivatives in cultured neuroblastoma cells », Biochimica et Biophysica Acta 7-14,
- Poignant JC, « Possibilité d’intervention d’Arcalion 200 mg sur la biosynthèse de la sérotonine. », Méd Prat 1979 : Suppl 3: 6.8,
- Sebban C., « Effets électroencéphaliques d’ Arcalion 200 mg. », J Méd Prat 1989 ; Suppl 3 : 11-18,
- K.P. Tiev, J. Cabane, J.C. Imbert, « Traitement de l’asthénie en période post-infectieuse : étude randomisé en double aveugle de deux doses de sulbutiamine (400-600 mg/j) versus placebo », Revue Médecine interne 1999 ; 20 : 912-8,
- (en) Toshio Matsuda, Jack R. Cooper, « Thiamine as an integral component of brain synaptosomal membranes », Proc. Nati Acad. Sci. USA, Neurobiology, Vol. 78, No. 9, pp.5886-5889, September 1981,
- Jacques Micheau, Thomas P. Durkin, Claude Destrade et Yves Rolland, « Chronic administration of sulbutiamine improves long term memory formation in mice: Possible cholinergic mediation », Pharmacology Biochemistry and Behavior, vol. 23, , p. 195–198 (DOI 10.1016/0091-3057(85)90555-6, lire en ligne, consulté le )
- Fabrice Trovero, Marco Gobbi, Jeanne Weil-Fuggaza et Marie-Jo Besson, « Evidence for a modulatory effect of sulbutiamine on glutamatergic and dopaminergic cortical transmissions in the rat brain », Neuroscience Letters, vol. 292, , p. 49–53 (DOI 10.1016/S0304-3940(00)01420-8, lire en ligne, consulté le )
- (en) U. Staubli, G. Rogers et G. Lynch, « Facilitation of glutamate receptors enhances memory. », Proceedings of the National Academy of Sciences, vol. 91, , p. 777–781 (ISSN 0027-8424 et 1091-6490, PMID 8290599, DOI 10.1073/pnas.91.2.777, lire en ligne, consulté le )
- Jean-Charles Bizot, Alexandre Herpin, Stéphanie Pothion et Sylvain Pirot, « Chronic treatment with sulbutiamine improves memory in an object recognition task and reduces some amnesic effects of dizocilpine in a spatial delayed-non-match-to-sample task », Progress in Neuro-Psychopharmacology and Biological Psychiatry, vol. 29, , p. 928–935 (DOI 10.1016/j.pnpbp.2005.04.035, lire en ligne, consulté le )
- J. Parada-Turska et W. A. Turski, « Excitatory amino acid antagonists and memory: Effect of drugs acting at N-methyl-d-aspartate receptors in learning and memory tasks », Neuropharmacology, vol. 29, , p. 1111–1116 (DOI 10.1016/0028-3908(90)90034-O, lire en ligne, consulté le )
- (en) Jeehyun KWAG, Aman Shah Abdul MAJID, Kui Dong KANG, « Evidence for Neuroprotective Effect of Sulbutiamine against Oxygen–Glucose Deprivation in Rat Hippocampal CA1 Pyramidal Neurons », Biol. Pharm. Bull. 34(11) 1759—1764 (2011),
- (en) A. F. Makarchikov, B. Lakaye, I. E. Gulyai et J. Czerniecki, « Thiamine triphosphate and thiamine triphosphatase activities: from bacteria to mammals », Cellular and Molecular Life Sciences CMLS, vol. 60, , p. 1477–1488 (ISSN 1420-682X et 1420-9071, DOI 10.1007/s00018-003-3098-4, lire en ligne, consulté le )
- « Etude théorique des mécanismes d'oxydation de thiols en milieu d'intérêt biologique », (consulté le )
- (en) Kui Dong Kang, Aman Shah Abdul Majid, Kyung-A. Kim et Kyungsu Kang, « Sulbutiamine Counteracts Trophic Factor Deprivation Induced Apoptotic Cell Death in Transformed Retinal Ganglion Cells », Neurochemical Research, vol. 35, , p. 1828–1839 (ISSN 0364-3190 et 1573-6903, DOI 10.1007/s11064-010-0249-5, lire en ligne, consulté le )
- LOO H. ; POIRIER M.-F. ; OLLAT H. ; ELATKI S. (2000) Étude des effets de la sulbutiamine (Arcalion 200) sur l'inhibition psychocomportementale des épisodes dépressifs majeurs = Study of the effects of sulbutiamine (Arcalion 200) on psycho-behavioural inhibition occurring during major depressive disorder, Revue L'Encéphale, vol. 26, no2, pp. 70-75 (19 ref.)
Liens externes
- Fiche Vidal : http://www.eurekasante.fr/medicaments/vidal-famille/medicament-marcal01-ARCALION.html
- Connaissances générales : http://datab.us/i/Sulbutiamine / http://www.liquisearch.com/sulbutiamine/history / http://everything.explained.today/Sulbutiamine/
- Base de données sur Arcalion (medicament contenant de la Sulbutiamine) : http://base-donnees-publique.medicaments.gouv.fr/extrait.php?specid=64384738
- Portail de la médecine
- Portail de la pharmacie
- Portail de la chimie