Pression de vapeur saturante
La pression de vapeur saturante est la pression à laquelle la phase gazeuse d'une substance est en équilibre avec sa phase liquide ou solide à une température donnée dans un système fermé. L'expression tension de vapeur est parfois utilisée pour désigner la pression de vapeur saturante. L'expression pression de vapeur, quant à elle, désigne la pression partielle de vapeur et non la pression de vapeur saturante. L’ambiguïté entre ces deux termes est renforcée par l'expression anglaise vapour pressure qui désigne, elle, la pression de vapeur saturante.
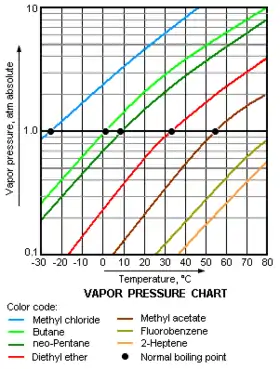
La pression de vapeur saturante est liée à la tendance des molécules à passer de l'état liquide (ou solide) à l'état gazeux : une substance possédant une pression de vapeur saturante élevée (vis-à-vis de la pression atmosphérique) à température ambiante est dite volatile. La pression de vapeur saturante d'une substance augmente de façon non linéaire avec la température selon la formule de Clausius-Clapeyron.
Historique
Au XIXe siècle, John Dalton étudia le volume de vapeur d'eau qui était nécessaire pour saturer l'air. Il remarqua que ce volume dépendait beaucoup de la température.
Définition
Dans le cas d'un corps pur placé dans une enceinte fermée, la pression de vapeur saturante est la pression de la phase gazeuse lorsqu'elle est en équilibre avec la phase liquide ou solide. La notion d'équilibre implique que le flux de molécules passant de l'état liquide (ou solide) à l'état gazeux est équivalent, sur un intervalle de temps donné, au flux de molécules passant de l'état gazeux à l'état liquide (ou solide).
Dans le cas d'un milieu ouvert, en contact avec l'air, la pression de vapeur saturante est la pression partielle de la vapeur à partir de laquelle on ne peut plus former de molécules sous forme de vapeur dans l'air, l'air est saturé. On dit aussi que c'est la pression maximale de sa vapeur « sèche » (c'est-à-dire sans phase liquide).
Si la pression partielle de la vapeur dépasse la pression de vapeur saturante, il y a liquéfaction ou condensation solide. À partir d'une situation d'équilibre, cela peut se faire soit en augmentant la pression partielle de vapeur (par exemple en diminuant le volume), ou bien en diminuant la valeur de la pression de vapeur saturante, ceci est possible en diminuant la température.
La température d'ébullition standard d'un corps, couramment appelée point d'ébullition, est la température à laquelle la pression de vapeur saturante est égale à 1 atm. Lorsque la température du liquide devient supérieure à cette valeur, on observe la formation de bulles à l'intérieur de la substance : c'est le phénomène d'ébullition. La formation de bulles en profondeur dans le liquide nécessite cependant une pression (et donc une température) plus élevée, car la pression du liquide augmente avec la profondeur.
Cas d'un corps pur
En augmentant artificiellement le volume d'un réservoir dans lequel se trouve un corps pur unique et en maintenant la température à un niveau constant, selon le niveau de cette température, le corps peut se trouver en différentes phases en même temps. Dans le cas où le niveau de température est tel qu'on se trouve en présence des phases liquides et gazeuses, il y a équilibre lorsque la fraction massique de chaque phase n'évolue plus avec le temps. La pression régnant dans ce réservoir, une fois cet équilibre atteint, est appelée pression de vapeur saturante (psat).
Si par un moyen extérieur, il est possible de modifier la pression dans l'enceinte (prés), sans changer la composition du gaz et tout en gardant la température constante (par exemple par diminution du volume à l'aide d'un piston et du refroidissement des parois), alors se présentent deux cas :
- augmentation de la pression dans le réservoir
- alors prés > psat
- En conséquence, il y aura condensation de la fraction gazeuse, soit jusqu'à ce que la pression dans l'enceinte ait diminué de sorte qu'elle atteigne la pression de vapeur saturante correspondant à cette température, soit jusqu'à ce qu'il n'y ait plus de vapeur à condenser. Dans ce dernier cas, la pression ambiante en fin de transformation est supérieure à la pression de vapeur saturante correspondant à cette température. De facto, il n'y a plus équilibre entre phases puisqu'il n'y a plus que la phase liquide ;
- diminution de la pression dans le réservoir :
- alors psat > prés
- En conséquence, il y aura vaporisation du liquide soit jusqu'à ce que la pression dans l'enceinte ait augmenté de sorte que soit atteint le niveau de pression de vapeur saturante correspondant à cette température ou jusqu'à ce que toute la phase liquide ait été convertie en phase gazeuse.
- Dans ce dernier cas, la pression ambiante en fin de transformation est inférieure à la pression de vapeur saturante correspondant à cette température. De même, il n'y a plus équilibre entre phases puisqu'il n'y a plus que la phase gazeuse.
Notion de point d'ébullition d'un corps pur
Pour un corps pur donné, il existe un couple unique (pression1, température1), appelé point d'ébullition et défini de la façon suivante :
- si la température est maintenue constante, mais que la pression est amenée en dessous de pression1, alors le corps pur est amené à ébullition ;
- si la pression est maintenue constante mais que la température est amenée au-dessus de température1, alors le corps pur est également amené à ébullition.
On constate par cette définition que la pression1 est simplement la pression de vapeur saturante, dont on sait qu'elle ne dépend que de la température.
Cas du mélange d'un corps pur liquide en équilibre de phase avec un autre corps pur gazeux
Si un corps pur 1 est enfermé à l'état liquide dans un réservoir étanche avec d'autres corps purs présents à l'état gazeux, ppartielle1 désignera la pression partielle de la phase gazeuse du corps pur 1.
- psat1 désignera la pression de vapeur saturante du corps pur 1 ;
- prés désignera la pression totale régnant dans le réservoir en début d'expérience.
À l'équilibre : ppartielle1 = psat1. Si le système est dans un autre état, il tendra vers cet équilibre, et comme la pression de vapeur saturante est une donnée physique (pour une température donnée), qui ne peut donc directement s'ajuster, c'est la pression partielle (et donc la pression totale) qui s'ajustera. Cela se produira, soit via une condensation si elle est trop élevée (ie, plus élevée que psat1), soit via une évaporation si elle est trop basse (resp, plus basse que psat1). Cependant ces deux phénomènes respectivement libère ou utilise de l'énergie, et ainsi modifient la température, ajustant indirectement la pression de vapeur saturante.
Changement de pression
Lorsque la pression change dans le réservoir, il y a trois cas possibles pour une température donnée unique :
- 1) La pression totale change sans modification de la pression partielle du corps 1
- rien ne se passe pour le corps 1 ! L'ajout ou l'évacuation d'un autre gaz est neutre pour le liquide, même si la pression totale augmente considérablement, ou bien se réduit jusqu'à être égale à la seule pression partielle du gaz 1 (elle ne peut descendre plus bas).
- 2) La pression partielle du corps 1 augmente, devenant supérieure à la pression de vapeur saturante du corps pur 1
- le gaz 1 se condense, jusqu'à réduire la pression partielle à la pression de vapeur saturante du corps pur 1. La condensation libère de la chaleur, augmente la température, et donc la pression de vapeur saturante du corps pur 1, ce qui contribue à l'équilibre.
- 3) La pression partielle du corps 1 diminue, devenant inférieure à la pression de vapeur saturante du corps pur 1
- le liquide 1 passe à l'état gazeux, jusqu'à augmenter la pression partielle au niveau de la pression de vapeur saturante du corps pur 1. Ce passage à l'état gazeux dépendra de la pression totale : si la pression totale est restée supérieure à la pression de vapeur saturante du corps pur 1 (prés > psat1), il se produira une évaporation, alors que si elle est descendue plus bas (prés < psat1) il se produira une ébullition (phénomène rapide). Dans les deux cas, de la chaleur est utilisée et la température diminue dans le réservoir, réduisant la pression de vapeur saturante du corps pur 1, contribuant ainsi à la restauration de l'équilibre.
- Nota
- Pour rappel, le cas où psat1 > ppartielle1 > prés ne peut exister, une pression de réservoir qui est une pression totale ne pouvant par définition pas être inférieure à une pression partielle.
- Par conséquent l'ébullition est un phénomène touchant à la fois corps purs et mélanges tandis que l'évaporation ne peut exister que dans le cas d'un mélange.
Changement de température
Pour modifier l'ordre des termes dans les trois inégalités ci-dessus, il est possible d'agir et de changer le niveau de la pression saturante par le biais de la température. Plus la température est élevée, plus le niveau de la pression de vapeur saturante augmente. À partir d'une situation d'équilibre où psat1 = ppartielle1 :
- en diminuant la température, psat1 diminue sous le niveau de ppartielle1 et la vapeur se liquéfie ;
- en augmentant légèrement la température, psat1 augmente et passe au-dessus du niveau de ppartielle tout en restant sous prés : il y a évaporation du liquide ;
- en augmentant fortement la température, alors psat augmente et passe au-dessus du niveau de prés. Le point d'ébullition est dépassé et le changement d'état se fait beaucoup plus rapidement : on parle d'ébullition.
Changement de volume du réservoir
Pour modifier l'ordre des termes dans les trois inégalités ci-dessus, il est possible d'agir et de changer le niveau des pressions partielle et totale en changeant le volume du réservoir et la quantité de corps pur 2. À partir d'une situation d'équilibre :
- en augmentant la pression réservoir à une valeur supérieure à psat1, il y a liquéfaction de la phase gazeuse du corps pur 1 ;
- en diminuant la pression réservoir tout en influant sur la pression partielle du corps pur 2, de façon que la pression réservoir reste supérieure à psat1, alors il y a évaporation de la phase liquide du corps pur 1 ;
- en diminuant la pression réservoir à une valeur inférieure à psat1, il y a alors ébullition de la phase liquide du corps pur 1.
Cas d'un corps pur solide
La pression de vapeur saturante de la plupart des solides est en général très faible pour des températures proches de l'ambiante (environ 20 °C). Par exemple, la pression de vapeur saturante du fer à 20 °C est tellement faible qu'il est improbable d'avoir un seul atome de fer présent dans une pièce sous forme de vapeur bien que l'acier présent soit à l'équilibre avec sa vapeur (on entre là dans des considérations quantiques de probabilité de présence). Les pressions de vapeur très faibles des solides peuvent être mesurées par la méthode de la cellule d'effusion de Knudsen.
Par ailleurs, la cohésion des atomes d'un solide fait qu'il est impensable d'avoir un phénomène d'ébullition. Toutefois, il peut se former des pores dans le matériau, et à l'intérieur de cette porosité, une partie solide passe sous forme gazeuse (avec la même précaution que ci-dessus). Cependant, ceci n'est pas lié à la pression atmosphérique comme pour les liquides (sauf pour des pressions extrêmes), mais plutôt aux propriétés du matériau, comme la présence de défauts ponctuels dans un cristal (lacunes) et la tension superficielle.
À partir d'une situation d'équilibre psat(T) = pvap
- modification de la température ambiante :
- modification de la pression ambiante :
Ainsi, pour une pression donnée, le point de sublimation d'une substance est la température à laquelle la pression de vapeur de cette substance est égale à la pression ambiante.
On n'a donc que trois cas :
- psat(T) > pvap : sublimation ;
- psat(T) = pvap : équilibre ;
- pvap > psat(T) : condensation.
Pression de vapeur saturante et autres changements de phase
La pression de vapeur saturante d'une substance en phase liquide peut être — et est généralement — différente de la pression de vapeur de cette même substance en phase solide. Si la température est telle que la pression de vapeur du liquide est supérieure à celle du solide, le liquide se vaporisera mais la vapeur se condensera en un solide, c'est-à-dire que le liquide gèlera. Si la température est telle que la pression de vapeur du liquide est inférieure à celle du solide, le solide se vaporisera mais la vapeur se condensera en un liquide, c'est-à-dire que le solide fondra.
À la température à laquelle les deux pressions de vapeur sont égales, il existe un équilibre entre les phases solides et liquides. Cette température est mentionnée comme le point de fusion.
Calcul de la pression de vapeur saturante
Le calcul approximatif de la pression de vapeur saturante peut se faire à l'aide d'une formule issue de la formule de Clapeyron, en prenant comme hypothèses — entre autres — que la vapeur se comporte comme un gaz parfait et que l'enthalpie de vaporisation varie linéairement avec la température dans la plage considérée (Lv initial - Lv final = aT).
C'est la formule de Dupré[1] :
avec :
- T0 : température d'ébullition de la substance à une pression p0 donnée, en K ;
- psat : pression de vapeur saturante, dans la même unité que p0 ;
- a : le facteur de linéarité de la variation de l'enthalpie du fluide avec la température ;
- M : masse molaire de la substance, en kg/mol ;
- Lv : chaleur latente de vaporisation de la substance, en J/kg ;
- R : constante des gaz parfaits, égale à 8,314 47 J mol−1 K−1 ;
- T : température de la vapeur, en K.
Pour l'eau, par exemple :
- M = 0,018 kg/mol ;
- Lv = 2,26 × 106 J/kg (à 100 °C) ;
- p0 = 1 013 mbar ;
- T0 = 373 K.
Pression de vapeur saturante de l'eau dans l'air
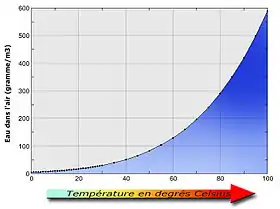
Dans le cas de l'eau dans l'air, l'humidité relative (ou hygrométrie) représente la proportion entre la pression de vapeur d'eau dans l'air et la pression de vapeur saturante à une température donnée. Ce taux est exprimé en pourcentage :
Les manifestations de la saturation de vapeur d'eau dans l'atmosphère sont nombreuses : apparition de « vapeur » (en réalité des petites gouttelettes d'eau) au-dessus d'une casserole d'eau chaude, formation de buée, de rosée, de givre (saturation par rapport à la glace), de brouillard, de précipitations ou de nuages.
Formule de Dupré
L'air possède une humidité relative de 100% (humidité absolue de saturation) quand la pression partielle de l'eau dans l'air est égale à la pression de vapeur saturante de l'eau. Cette pression partielle de l'eau augmente avec la température (voir le tableau ci-dessous). La pression partielle de l'air diminue donc en conséquence et atteint donc 0 bar à 100 °C (il n'y a pas d'air à proximité de la surface d'une casserole d'eau bouillante).
| Température (°C) |
Pression de vapeur saturante (mbar) |
|---|---|
| −60 | 0,001 |
| −40 | 0,13 |
| −20 | 1,03 |
| −10 | 2,6 |
| 0 | 6,10 |
| Température (°C) |
Pression de vapeur saturante (mbar) |
|---|---|
| 5 | 8,72 |
| 10 | 12,3 |
| 15 | 17,0 |
| 20 | 23,4 |
| 25 | 31,7 |
| Température (°C) |
Pression de vapeur saturante (mbar) |
|---|---|
| 30 | 42,4 |
| 40 | 73,8 |
| 50 | 123 |
| 60 | 199 |
| 100 | 1 013 |
Formule de Rankine
La formule de Rankine, une simplification de la formule de Dupré, donne des valeurs pour la pression de vapeur saturante de l'eau avec des coefficients légèrement différents (écart de 0,39 à 4,1 % sur la plage de 5 à 140 °C par rapport aux tables thermodynamiques)[1],[2] :
avec :
- psat : pression de vapeur saturante de l'eau, en atm ;
- T : température absolue, en K.
Formule de Duperray
Pour des températures plus élevées, on peut utiliser la formule de Duperray (écart de 0,12 à 7,7 % sur la plage de 90 à 300 °C)[3] :
avec :
- psat : pression de vapeur saturante de l'eau, en atm ;
- t : température, en °C.
Exemples d'application
Premier cas (phénomène « violent ») : ébullition d'eau.
On porte de l'eau à ébullition dans une casserole à une pression d'une atmosphère. Dans ces conditions de température et de pression, on a :
- psat_eau > ptotale_atmosphère > ppartielle_eau.
Dans ce cas, l'apport d'énergie à la casserole a causé une augmentation de température de l'eau liquide et la pression saturante de l'eau a ainsi également augmenté. Cet état de fait amène à la formation de bulles de vapeur qui viendront augmenter la pression partielle de l'eau à l'état gazeux dans l'atmosphère, idéalement jusqu'à ce que cette dernière pression atteigne le niveau de la pression saturante de l'eau (ou, ce qui est évidemment le cas général, jusqu'à ce que la casserole soit vide).
Variante du premier cas : ébullition de propane et/ou butane ou d'un mélange comme le GPL.
Dans une bouteille stockée à température ambiante (20 °C) est enfermé un corps pur unique sous forme gazeuse. Dans le cas où, à cette température, la pression de vapeur saturante de ce gaz est supérieure à la pression atmosphérique extérieure, il est possible de soutirer du gaz de la bouteille sans aide additionnelle (pompe). En supposant que soit soutirée une certaine quantité de ce gaz, lors de la refermeture de la bouteille, on aura :
- psat_gaz > ppartielle_gaz = ptotale_gaz.
En effet, il n'y a pas d'autres gaz dans cette bouteille que celui qui est sous forme liquide donc sa pression « partielle » est aussi la pression totale. Dès lors, pour rétablir l'équilibre, l'ébullition va spontanément s'établir, jusqu'à ce que la pression dans la bouteille atteigne la pression de vapeur saturante de ce gaz à 20 °C.
Second cas : évaporation d'une flaque d'eau au Soleil.
Dans ces conditions de température et de pression, la pression de vapeur saturante de l'eau est supérieure à la pression partielle de la vapeur d'eau dans l'atmosphère mais est inférieure à la pression atmosphérique totale.
- ptotale_atmosphère > psat_eau > ppartielle_eau.
Il y a évaporation.
Troisième cas : nuages et pluie.
Dans ces conditions de température et de pression, la pression de vapeur saturante de l'eau est inférieure à la pression partielle de la vapeur d'eau dans l'atmosphère et est dès lors forcément inférieure à la pression atmosphérique totale.
- ptotale_atmosphère > ppartielle_eau > psat_eau.
Il y a changement d'état et condensation de la vapeur d'eau en gouttes de pluie.
Mélange de corps purs
La loi de Raoult régit approximativement la pression de vapeur saturante de mélanges de liquides.
Considérons un mélange homogène de deux gaz dans un réservoir: l'énergie d'agitation thermique est supérieure à la différence d'énergie potentielle de gravité et du fait de l'hypothèse d'homogénéité, il n'y a pas de stratification. Sous cette hypothèse, la composition du mélange est constante du début à la fin du tirage. Pour une température de tirage donnée et constante, il va se produire des évaporations des 2 gaz en proportions variant selon la pression de tirage, ce qui va faire varier la composition du mélange soutiré. Le gaz dont la pression saturante sera la plus élevée va avoir d'abord une plus forte proportion car à l'équilibre, sa pression partielle devra atteindre sa pression de vapeur saturante. Celle-ci étant plus élevée que celle de l'autre gaz, sa pression partielle sera également plus importante. Au fur et à mesure de la baisse de pression dans la bouteille, il y aura éventuellement passage sous le niveau de sa pression de vapeur saturante, du niveau de pression partielle d'un gaz puis de l'autre, d'où recondensation. Les bouteilles de mélanges de gaz ont une consigne de température de stockage pour assurer que la composition du gaz effectivement soutiré soit bien la composition nominale, sous l'hypothèse que la température de soutirage soit celle de stockage. Si avant soutirage, on prescrit de ramener le mélange à une température définie pour laquelle les proportions des gaz soutirés sont connues, alors la température de stockage pourra être choisie librement.
Décompression explosive
Dans le cas d'un corps contenu dans une enceinte étanche, il peut se produire une ébullition-explosion (ou bleve) par rupture de l'enceinte lorsque :
- dans les conditions de température et de pression extérieure, le corps est sous forme gazeuse ;
- la pression est plus élevée dans l'enceinte, ce qui maintient une partie du corps sous forme liquide.
Physique des nuages

1) Cristaux de glace
2) Neige et gouttelettes surfondues (dominé par l'effet Bergeron)
3) Gouttelettes surfondues (dominé par la coalescence)
4) Gouttelettes de pluie.
La pression de vapeur saturante est atteinte lorsqu'une parcelle d'air atteint son niveau de condensation, ce qui mène à la formation dans les nuages de gouttelettes d'eau, puis de cristaux de glace lorsque le niveau de condensation solide est atteint. Le grossissement des gouttelettes d'eau et des cristaux de glace s'explique par l'effet de coalescence et l'effet Bergeron[4].
Notes et références
- Richard Taillet, Pascal Febvre et Loïc Villain, Dictionnaire de physique, Bruxelles/Paris, De Boeck, , 754 p. (ISBN 978-2-8041-0248-7 et 2-8041-0248-3, lire en ligne), p. 175
- Nicolas Vandewalle, « Chapitre 7 : Changement d'état », Université de Liège (consulté le )
- « Formules de physique - Pression d'une vapeur », sur formules-physique.com (consulté le )
- Joël Van Baelen, « Pluie, neige, grêle... entre le ciel et la terre », Pour la science, no 78, , p. 71.
Articles connexes
- Diagramme de Dühring
- Diagramme de Cox-Othmer
- Enthalpie
- Équation d'Antoine
- Évaporation
- Humidité absolue
- Humidité relative
- Hygrométrie
- Point de Bancroft
- Point de givrage
- Point de bulle
- Point de rosée
- Pression
- Pression de la vapeur
- Pression partielle
- Psychrométrie
- Règle du palier de Maxwell
- Teneur en eau (chimie)
- Portail de la chimie
- Portail de la physique