Oïdium de la vigne
Erysiphe necator

| Règne | Fungi |
|---|---|
| Division | Ascomycota |
| Sous-embr. | Pezizomycotina |
| Classe | Leotiomycetes |
| Ordre | Erysiphales |
| Famille | Erysiphaceae |
| Genre | Erysiphe |
Uncinula necator, (Schwein.) Burrill, 1892
Erysiphe necator est un champignon filamenteux microscopique[1] de la division des Ascomycètes, parasite obligatoire strictement inféodé aux Vitaceae, essentiellement le genre Vitis. Il est responsable de l’oïdium de la vigne (nommé blanc au Canada), une des maladies majeures des vignobles. Connu encore récemment sous le nom d'Uncinula necator, les études de phylogénétiques moléculaires ainsi que l'examen de l'anamorphe indiquent que le genre Uncinula ne peut être maintenu en soi et doit être considéré comme synonyme de Erisyphe (Braun[2], 2013).
Distribution
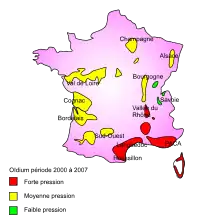
Originaire[4],[5] de l'est de Amérique du Nord où il parasitait les vignes indigènes (Vitis) et les vignes vierges (Parthenocissus, Cissus et Ampelopsis[6]), Erysiphe necator fut introduit dans toutes les parties du monde où la vigne européenne est cultivée (Europe, Asie, Afrique, Australie, Nouvelle-Zélande, Amérique du Sud, Californie).
En France, les épidémies d'oïdium sont le plus souvent observées dans la région méditerranéenne, mais les vignobles septentrionaux peuvent aussi certaines années, subir des attaques sévères[7]. Depuis le début des années 2000, l'oïdium s'étend en dehors du pourtour méditerranéen, sa zone traditionnelle de développement. Il touche désormais les vignobles du Nord-Est et de l'Ouest de la France[3] : on observe de plus en plus d'attaques en Champagne, ou sur le chardonnay en Mâconnais et Côte de Beaune, sans oublier l'Alsace, la région de Cognac, le Val-de Loire et le Bordelais.
Étymologie
- Erysiphe necator Schweinitz[8] (1834). Le genre Erysiphe a été établi par R. A. Hedwig[n 1], (Fung. ined.) et publié par de Candolle en 1805, (Flore Française 2: 272. 17 ).
- Le nom de genre Erysiphe est dérivé[9],[10] du grec ερυσίβη erusibè « rouille, nielle ». L'épithète spécifique necator vient du latin et signifie « meurtrier » (Gaffiot).
- Uncinula necator (Schwein.) Burrill[n 2] (1892).
- Le genre Uncinula a été établi par J.H. Léveillé en 1851; le terme est tiré du latin uncinulus « petit crochet » (uncus « crochet, crampon ») car les espèces du genre Uncinula se caractérisent par des fructifications portant des filaments recourbés à leur extrémité.
Historique de la maladie et de la taxonomie
Les premières observations eurent lieu en Amérique du Nord. Ce fut la téléomorphe qui fut décrite en premier en 1834 par le mycologue américain Schweinitz sous le nom d'Erysiphe necator. Dans un ouvrage pionnier, écrit entièrement en latin[8], il donne alors une description de la flore mycologique d'Amérique du Nord, comportant près de 4 000 espèces et 250 genres. Sa description de E. necator, très succincte, indiquait que ce pathogène ne causait que rarement de dégâts aux vignes américaines[n 3]. Cette description fut probablement en partie oubliée ou peut-être mal interprétée. Toujours est-il que l'espèce dut être décrite de multiples fois, en Amérique et en Europe, sous divers noms et par divers mycologues, avant que la description de Schweinitz ne soit exhumée.

Avant 1845, les vignes européennes (Vitis vinifera) ne connaissaient ni oïdium, ni phylloxera, ni mildiou, ni black rot. En quelques décennies pourtant, ces maladies venues d'Amérique du Nord ravagèrent le vignoble européen : l'oïdium arriva le premier en 1845, le phylloxera en 1861-1863, le mildiou de la vigne suivit en 1878 et le black rot en 1885[11]. L'oïdium fut observé sur la vigne pour la première fois en Europe, en 1845, dans les cultures sous serres de vigne (grapperies) de Margate (Kent, Angleterre) près de l'embouchure de la Tamise (Viala[12], 1893). En 1847, dans le Gardener 's Chronicle, le jardinier Tucker signalait la maladie et le botaniste J. Berkeley décrivait l'anamorphe (asexuée) du champignon responsable, sous le nom de Oïdium Tuckeri (puis de Erysiphe tuckeri Berk.), sans faire la relation avec l'espèce décrite en Amérique par Schweinitz en 1834.

La même année, la maladie fut observée dans les serres de J. de Rothschild, à Suresnes à l'ouest de Paris[13]. Quatre ans plus tard, tout le vignoble français était contaminé et la maladie s'étendait rapidement à tous les vignobles des pays méditerranéens. En certains lieux, comme à Frontignan, une attaque fulgurante put réduire à néant la récolte[12]. Sur toute la France[14], la production viticole passa de 45 millions d'hectolitres en 1850 à 11 millions en 1854. Heureusement, une parade efficace à ce fléau fut trouvée, grâce aux travaux de Marès dans l'Hérault qui établirent l'efficacité des poudrages au soufre[15].
Pendant quatre à cinq décennies, les botanistes mycologues européens cherchèrent en vain la forme sexuée de l'oïdium de la vigne européenne décrite par Berkeley et ce n'est qu'à la fin du siècle qu'ils établirent avec certitude l'identité de ce téléomorphe.
Pendant la même époque, les botanistes américains observaient la forme sexuée d'un oïdium sur les vignes indigènes de leur pays et Berkeley en donnaient une description, sous le nom de Uncinula spiralis (Berkeley et Cooke). Non seulement la description de Schweinitz était négligée mais, en plus, la relation avec l'oïdium des vignes européennes n'était pas établie. Ce n'est qu'en 1870 qu'un microscopiste du nom de Thomas Taylor qui cultivait en serres des vignes européennes à Washington fit la relation entre l'oïdium européen décrit par J. Berkeley et l'oïdium des vignes américaines[16]. Il supposa alors « hautement probable que les spores d' Oidium des vignes indigènes d'Amérique ont été transportées en Angleterre à partir de ce pays, et sont les vrais parents d' Oidium Tuckeri, mais il pensait que les conditions climatiques en Europe étaient défavorables au développement d'une fructification supérieure ». Pierre Viala en France et De Bary en Allemagne avancèrent aussi cette hypothèse à partir de leurs propres observations[12] mais des doutes subsistèrent, surtout en Angleterre et en Amérique. L'identité des deux oïdiums fut finalement clairement établie par Couderc[17] (en 1893) qui observa en Ardèche que les « périthèces [fructifications], en relation directe avec le mycélium de l' Erysiphe Tuckeri, ont les caractères spécifiques de l' Uncinula spiralis ». Ces fructifications apparaissent « sur des pampres non aoûtés au moment de la gelée d'octobre ».
À la même époque aux États-Unis, l'ensemble des descriptions semblent avoir été rassemblées par Thomas J. Burill[18] qui ressuscite pour synonyme de Uncinula spiralis Berk. (Cryp. Bot.) Erysiphe necator Schwein. Il crée ainsi par la règle d'antériorité Uncinula necator (Schwein.) Burill (1892).
Beaucoup d'efforts furent donc nécessaires pour établir une double identité :
- identité spécifique de l'anamorphe et de la téléomorphe de l'oïdium européen
- l'identité de l'oïdium européen et de l'oïdium américain, ayant pour hôte les Vitis.
Il est d'ailleurs possible que durant cette longue période où les fructifications ne furent jamais observées en Europe, seul le mycélium subsistait dans les bourgeons dormants durant l'hiver[19],[20]. Si la lignée importée en Europe n'était porteuse que d'un seul type de croisement[n 4] (+ ou -), tout croisement sexué était impossible, en raison de l'hétérothallisme du champignon. Il n'en est plus du tout ainsi actuellement, puisque l'hivernage des fructifications a été observé partout en Europe et serait même souvent la forme dominante de survie du champignon.
Les sources textuelles invitent à penser que l'oïdium de la vigne aurait été introduit en Europe à partir de l'est de l'Amérique du Nord[5]. Cette région est un centre d'origine de beaucoup de Vitis sauvages manifestant une grande résistance aux maladies de la vigne. Une fois introduit en Europe, l'oïdium s'est propagé à toutes les régions viticoles du monde, y compris la Californie en 1859 et l'Australie en 1866. L'étude génétique d'isolats[5] de Erysiphe necator prélevés en Europe, Australie, et à l'ouest et à l'est des États-Unis a confirmé l'hypothèse que les populations d'Europe, d'Australie et de l'ouest des États-Unis dérivaient d'ancêtres indigènes de l'est des États-Unis.
Symptômes de l'oïdium
L'oïdium est un ectoparasite qui se manifeste à la surface de tous les organes herbacés en croissance de la vigne [14] :
- sur les jeunes rameaux herbacés : l'oïdium peut apparaître dès le début de la végétation et envahir les jeunes pousses qui voient alors leur croissance ralentir. Elles présentent des plages revêtues d'une poussière blanche grisâtre due à la sporulation. Le développement du mycélium provoque une réduction du développement des entre-nœuds et des malformations foliaires (comme des bordures recourbées vers le haut et un aspect fripé), dues à une contamination des deux faces par le champignon. On parle alors d'une forme « en drapeau » des pousses oïdiées ou d'« épidémie de type drapeau ».
- Le jeune rameau herbacé qui se couvre d'une poussière fongique blanche[21] au printemps, dans le facies en drapeau, est en général issu d'un bourgeon contaminé durant la période végétative de l'année précédente et dans lequel le mycélium a hiverné[22].
- sur les feuilles : en pleine végétation, les feuilles sont attaquées d'abord sur leur bord puis sur leur limbe où apparaissent des taches diffuses de poussière gris terne. Ce feutrage grisâtre et poussiéreux correspond à un réseau mycélien dense et à de multiples appendices dressés (ou conidiophores) produisant les spores asexuée (ou conidies). Parfois des taches translucides, semblables à celles du mildiou, apparaissent lors de printemps et été chauds et secs. Les cellules épidermiques sous-tendant le mycélium meurent et forment des taches nécrosées qui peuvent provoquer la chute de la feuille[21].
- sur les grappes : les inflorescences peuvent être contaminées avant la floraison et subir un dessèchement partiel ou total. Après la nouaison, les grains contaminés se recouvrent d'une fine poussière grisâtre d'aspect cendré puis de nécroses noires et finissent par éclater en laissant apparaître les pépins. Les grappes contaminées dégagent une forte odeur de moisissure.
- sur les sarments : en hiver, des taches de rousseur de 5 à 10 mm peuvent être trouvées, correspondant à des tissus morts. Elles correspondent aux attaques de printemps des rameaux herbacés.
Biologie
Cycles biologiques
L'oïdium possède deux modes de conservation hivernale, soit sous forme de mycélium dans les bourgeons dormants soit sous forme de fructifications [23] à la surface de la plante, correspondant respectivement à la reproduction asexuée et sexuée.

Reproduction asexuée
L'oïdium se conserve l'hiver à l'état de mycélium[14], niché entre les écailles des bourgeons latents. Lorsque la végétation redémarre au printemps, le mycélium reprend son activité au moment du débourrement. Il se développe rapidement, produit des spores (conidies) et contamine les jeunes pousses en croissance[24]. Celles-ci prennent alors un aspect rabougri, frisé et poussiéreux gris-blanc, dit « en drapeau ». Ces jeunes pousses contaminées seront ensuite une source de contaminations secondaires. Car lorsque le mycélium trouve les conditions favorables à sa croissance (des tissus jeunes fournissant des nutriments et une température adéquate), il produit un grand nombre de spores par une structure de multiplication clonale, appelée conidiophore, formée par un appendice dressé porteur d'une chaînette de spores (ou conidies, voir figures section suivante). Les conidies se détachent des chaînettes et sont disséminées par le vent et la pluie. Au contact d'un tissu végétal, elles germent en quelques heures et produisent des filaments mycéliens. Il peut s'ensuivre plusieurs cycles asexués de 8 à 12 jours au cours de la croissance de la vigne[7].
En France, le symptôme « en drapeau » est l'apanage de certains cépages méridionaux : le carignan avant tout, puis le chardonnay, le portan, le cabernet-sauvignon, le grenache et le marsanne. La forme drapeau a tendance à disparaître après la mi-juillet, pour être remplacée par la forme sexuée. En général, il n'y a pas de facies en drapeau dans les régions aux hivers froids[21], comme dans les vignobles des états de Washington ou de New York au nord-ouest et au nord-est des États-Unis.
Reproduction sexuée
Erysiphe necator comme tous les oïdiums de l'ordre des Érysiphales, produit dans son stade parfait (téléomorphe, sexué) des fructifications (nommées ascomas) sous forme de réceptacles sphériques renfermant complètement les asques. Ces réceptacles qui ne comportent pas d'ouvertures (ostioles) à la différence des périthèces (du black rot par exemple), sont généralement nommés cléistothèces (mais aussi périthèces dans les textes anciens). Braun (1987, 1995) les nomme cleistothèces érysiphacés et Webster et Weber[25] (2009) ou Rossi et als[26] (2010) chasmothèces.
Dans son cycle de reproduction sexuée, Erysiphe necator produit des cléistothèces en fin d'été et début d'automne, sur tous les tissus infectés. Emportées par les pluies, la plupart aboutissent sur le sol où elles[n 5] sont détruites par les micro-organismes. Mais celles qui se sont fixées dans l'écorce des ceps et des vieux bois peuvent subsister tout l'hiver[27]. Il a ainsi été montré que dans les conditions hivernales de l'État de New York[19], la plupart des cléistothèces déposées sur les feuilles et les sarments meurent l'hiver, alors que celles enfouies dans les crevasses de l'écorce restent viables. Par contre, dans les régions aux hivers doux avec peu de pluies (Californie, Italie, Afrique du Sud), les cléistothèces peuvent survivre sur la litière de feuilles au sol[28] (et encore mieux sur les écorces mais pas sur le sol directement).
Au printemps, par temps pluvieux (à partir de 2 mm) et lorsque la température dépasse 11 °C, les cléistothèces qui ont survécu à l'hiver éjectent leurs ascospores. En provoquant l'éjection des ascospores, la pluie favorise la contamination, par contre au moment de la sporulation, elle empêche la germination des conidies. Dans le vignoble de Bordeaux, l'éjection des ascospores débute après le débourrement et se termine avant la floraison[29] (de mars à juin). Il a été observé de même sur les vignobles du nord de l'Italie que la majorité des ascospores matures (produits par les cléistothèces de l'année précédente) était trouvée à cette même époque[26], entre débourrement et floraison.
Ces ascospores en allant se déposer sur les bourgeons et les jeunes feuilles, vont germer et être une source de contaminations primaires. Cette infection qui se manifeste par de petites taches sur la face inférieure des feuilles dans les zones ombragées à l'intérieur de la végétation, est extrêmement difficile à voir au début[7]. Dans les régions méridionales où le mycélium hiverne dans les bourgeons, les pousses en drapeau sont un foyer de maladie précoce, important et récurrent[21] et faciles à voir, par contre dans les régions où les cléistothèces sont la seule source d'inoculum primaire, les symptômes foliaires graves (et donc manifestes) n'apparaissent qu'après la floraison.
Par la suite, les colonies d'oïdium se développent et sporulent rapidement pour des températures[14] situées entre 20 °C et 25 °C : l'épidémie est alors tirée par des cycles d'infections asexuées. La durée entre la germination d'une spore et la sporulation de la colonie fille fluctue en fonction des températures ; elle va de 12 à 13 jours aux températures fraîches du printemps, à 7 à 8 jours en conditions optimales. Pour autant, deux à trois cycles secondaires vont parfois se dérouler avant que les symptômes soient facilement visibles au champ, lorsque la maladie est bien installée[30]. Le vent est un facteur favorable à la dispersion des conidies.
En France, cette forme de reproduction par cléistothèces-ascospores est dominante dans les vignobles septentrionaux[14]. Jusqu'à récemment, on pensait que les foyers primaires d'oïdium à partir de cléistothèces étaient plus tardifs que ceux qui partaient du mycélium hivernant dans les bourgeons. Or, une étude menée dans le vignoble bordelais[7], a montré que les ascospores peuvent contaminer la vigne très précocement, sur des pousses à deux feuilles étalées. Les symptômes très discrets, se manifestent par de petites taches diffuses à la face inférieure des feuilles situées à proximité de l'écorce des ceps. Ils ont pu être observés sur les cépages merlot et cabernet sauvignon. Cette contamination peut rester peu apparente pendant 40 à 50 jours et brusquement exploser sur les jeunes grappes nouées.
Les groupes génétiques A et B
En 1999, l'étude épidémiologique de diverses populations[20] de E. necator a révélé deux groupes bien caractérisables par l'analyse génétique de marqueurs moléculaires (comme les mutations du gène CYP51) par RAPD (random amplified polymorphic DNA). Les isolats prélevés en avril, en diverses régions, sur les pousses en drapeau se regroupaient dans un même groupe A. Tous en outre, possédaient le seul type de croisement +, interdisant ainsi tout croisement sexué (E. necator est hétérothallique). Un autre groupe (B) correspondait aux isolats prélevés en été, avec un hivernage sous forme de cléistothèces. Cette analyse pionière a été depuis confirmée et raffinée[31] par l'analyse de nombreux autres marqueurs moléculaires (microsatellites, AFLP, RAPD, transposons et SNP), dans plusieurs autres pays (Australie, Italie, Espagne).
Les souches du groupe A sont pour l'essentiel isolées dans les vignobles méditerranéens (et dans quelques vignobles septentrionaux) et sont associées avec les pousses en drapeau. Les souches du groupe B hivernent sous forme de cléistothèces mais aussi de mycélium dormant dans les bourgeons (et apparaissant comme pousses en drapeau). C'est dans ce groupe B que sont identifiés les plus nombreux cas de résistance aux fongicides[32]. La plupart des vignobles de France et d'Italie, portent des oïdiums d'un seul groupe. Mais dans les quelques vignobles, où coexistent des oïdiums du groupe A et du groupe B sur le même hôte, on observe la présence du groupe A uniquement au début de la saison végétative[31]. Puis au cours de l'épidémie, les échantillons du groupe A diminuent et ceux du groupe B croissent jusqu'à atteindre 100 % au cours de l'été. L'isolation temporelle des deux groupes génétiques empêcherait ainsi leur recombinaison. Le groupe A survit l'hiver probablement exclusivement sous forme de mycélium dans les bourgeons alors que le groupe B survit soit sous forme de cléistothèces soit sous forme de mycélium dans les bourgeons.
Morphologie de l'anamorphe
| La reproduction asexuée de Erysiphe necator | |
|---|---|
1. Le mycélium : Erysiphe necator est un ectoparasite dont le réseau de filaments mycéliens se développe à la surface les feuilles et les fruits. Les hyphes sont hyalines, haploïdes, septées (cloisonnées), mononuclées, aux parois minces, de 4 à 5 µm de diamètre[21],[33]. Le mycélium ne se développe pas à l'intérieur du tissu et ne l'envahit pas complètement, comme le fait le mildiou Plasmopara viticola. De plus, E. necator est un biotrophe obligatoire strictement inféodé aux vignes. À la différence de la pourriture grise (Botrytis cinerea), un nécrotrophe qui détruit les cellules de son hôte (avec des toxines et des enzymes) avant d'en absorber les substances nutritives, les biotrophes comme E. necator ne visent pas à détruire les cellules de l'hôte mais à y puiser des nutriments par une structure spécialisée, nommée haustorium. Haustorium ou suçoir (N. masc.[34] du latin haustos « puiser »). L'hyphe élabore un petit organe multilobé, appelé appressorium[n 6], spécialisé dans la perforation de la cuticule, puis de la paroi d'une cellule épidermique. L'organe globuleux sous-tendu, l'haustorium, a pour fonction de prélever les substances nutritives de la plante (glucose, fructose, acide aminés). Il ne perce pas la membrane plasmique mais l'invagine à l'intérieur de la cellule épidermique[35] (voir figure ci-contre). Le noyau de la cellule double de volume. |
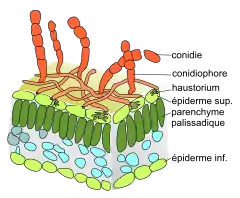 Mycélium à la surface d'une feuille 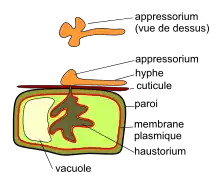 Haustorium dans une cellule épidermique (Hayes[35], 2006) |
| Conidiophore : grâce aux nutriments trouvés chez son hôte, le mycélium peut se développer et se reproduire. La reproduction clonale est assurée par des appendices dressés, perpendiculairement au plan du tissu, constituées de 2 à 4 cellules différenciées en spores[33]. Cette structure, d'environ 400 µm de long, s'appelle un conidiophore et les spores s'appellent des conidies. La cellule basale est tordue voire torsadée. Elle est surmontée de 1 à 3 cellules plus courtes qui une fois matures, se détachent successivement alors que de nouvelles conidies se forment à la base. Sur une colonie en croissance rapide, les conidiophores peuvent former un tapis très dense, d'aspect poussiéreux. | 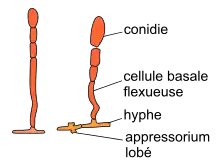 Conidiophores, chaînette de conidies |
| Conidie (N. fem.[34] du grec konis-idos « poussière ») : spore fongique ellipsoïdo-ovoïde à doliiforme[n 7], de 22-48 x 12-22 µm, avec une ou deux grandes vacuoles aqueuses[21]. La paroi externe est striée longitudinalement, fibreuse ou écailleuse. En absence de courant d'air, des chaînes de conidies peuvent se former. Les conidies sont dispersées par le vent et par les pulvérisateurs à haute pression. Elles vont infecter les faces supérieures des feuilles (alors que le mildiou pénètre par les stomates de la face inférieure), les inflorescences ou les grappes. |
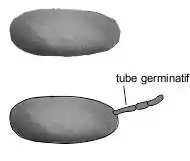 |
| Germination de conidie : la conidie germe en produisant un tube germinatif qui comporte à son extrémité un appressorium, capable de générer une pression suffisante pour percer la cuticule et la paroi d'une cellule végétale. Par cette voie, s'introduit un pédoncule à partir duquel se différencie par invagination de la membrane plasmique l'haustorium, une structure globuleuse qui permettra au champignon de puiser ses nutriments au détriment de l'hôte. La température optimum de germination se situe entre 20 et 25 °C (dans une fourchette de 6 à 33 °C possible). L'optimum d'humidité pour la germination est aux environs de 75 %. Mais la germination est empêchée par l'eau libre et elle peut s'effectuer avec des taux d'humidité faible[30]. Environ 14 heures après l'infection, une hyphe se développe à la surface de la feuille[22]. |
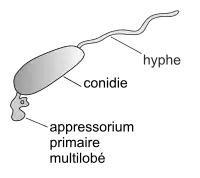 Développement de la première hyphe du côté opposé de l'appressorium (Schnee[33]) |
Morphologie du téléomorphe
Pearson et Gadoury[19] (1987) furent les premiers à montrer que les cléistothèces pouvaient survivre aux hivers parfois rigoureux de l'État de New York et libérer au printemps des ascospores fournissant l'inoculum primaire de l'oïdium. Par contre, aucun mycélium dormant dans les bourgeons n'a pu être observé dans ces vignobles américains.
| La reproduction sexuée de Erysiphe necator | |
|---|---|
| La cléistothèce (N. fem.[34], du grec κλειστός kleistos « fermé », et θήκη têke « étui »). La reproduction sexuée résulte de la fusion de deux hyphes de types sexuels compatibles (hétérothalisme) qui donne une hyphe ascogène, séquestrant des paires de noyaux (n+n). L'hyphe ascogène génère à son apex un asque, au sein duquel s'opère une caryogamie suivie d'une méiose et d'une mitose, conduisant finalement à la production de 4 à 6-7 (asco)spores internes. Les cléistothèces apparaissent à la surface du tissu infecté, au point de rencontre de plusieurs hyphes. Ce sont des enveloppes externes de nature stromatique, résultant de l’agrégation d'hyphes haploïdes (n). Elles forment des amas globuleux d'abord blancs, puis jaunes, marron et finalement noirs. D'abord guère visible isolée, à l’œil nu (d'environ 0,1 mm chacune), à maturité, on peut voir leur emplacement sous forme de petites pustules sphériques foncées[36], apparaissant au milieu ou à la fin de la saison végétative. Les cléistothèces sont dispersées aux alentours par la pluie ; seules celles qui tombent sur les écorces des ceps, survivent durant l'hiver. La cléistothèce est un réceptacle sphérique, fermé, de 80-130 µm de diamètre, formé de cellules polygonales à rondes[4]. De la zone équatoriale émergent au bout de 3 semaines, des appendices filiformes (ou fulcres), au nombre de 10 à 30, flexueux, de longueur 2 à 5 fois plus grande que le diamètre de la cléistothèce, aux parois minces, septés (par 4 à 9 cloisons), colorés dans la partie inférieure, bruns puis hyalins, à l'apex unciné (recourbé en crochet) ou circiné (enroulé en crosse). Au printemps, les cléistothèces éclatent en présence d'eau et les asques qui s'ouvrent par la même occasion, libèrent leurs ascospores. |
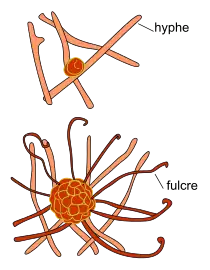 Cléistothèces en formation, puis matures 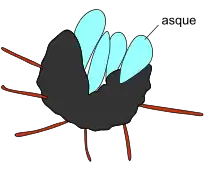 Cléistothèce éclatée |
| Asque (N. masc. du grec ασκός askos « outre ») Chaque cléistothèce contient de 4 à 6 asques[21], en forme de sac ventru, au sein duquel s'opère une caryogamie produisant un noyau diploïde, suivie par une méiose complétée par une mitose conduisant à la production d'ascospores haploïdes, internes. L'asque de forme ovoïde, fait 40-70 x 25-45 µm et contient 4 à 7 (asco)spores. Ascospore C'est une spore ellipsoïdo-ovoïde, de 15-25 x 9-15 µm, contenant de nombreux globules lipidiques. D'un cytoplasme granulaire à l'état immature, on passe à un cytoplasme à vacuoles à l'état mature. L'ascospore libérée est dispersée par le vent[37]. À 20-25 °C, elle germe lorsque la durée d'humectation est supérieure à 8 heures et forme des appressoriums lobés et des haustoriums afin de puiser des nutriments dans la plante, nécessaires à la production des hyphes[38]. L'humidité et un faible ensoleillement favorisent la croissance du mycélium. |
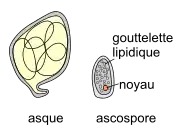 En août, distribution uniforme de globules (gouttelettes) lipidiques dans le cytoplasme de l'ascospore, puis globules plus gros en janvier-mai (Gadoury et al[38]) |
Facteurs climatiques favorables et défavorables
Au printemps, lorsque les températures dépassent les 5 °C, le mycélium commence à croître en atmosphère humide. La sporulation devient importante pour des températures situées entre 20 °C et 25 °C mais les fortes chaleurs (avec des températures supérieures à 35 °C) inhibent la germination des conidies.
L'oïdium se développe en atmosphère chaude et humide par temps couvert[14]. Ainsi, une pluie orageuse d'été peut être très favorable. Mais les années à forte pluviométrie de printemps ou d'été, comme furent 2000 et 2007, sont défavorables à son développement alors qu'elles sont favorables au mildiou[3]. Contrairement au mildiou, l'eau libre gène la germination des conidies.
Le vent en dispersant les conidies, favorise les contaminations secondaires.
L'ensoleillement, par dessèchement et action des rayons ultraviolets, est défavorable. A contrario, un faible ensoleillement est un facteur favorable au développement.
Impacts quantitatifs et qualitatifs de l'oïdium sur la récolte
Au moment des vendanges, une grappe de raisin attaquée par l'oïdium possède des graines couvertes d'une fine poussière grisâtre, des graines éclatées, d'autres nanifiées ou ayant avorté pour cause de coulure des fleurs ou de jeunes baies. L'effet quantitatif peut être significatif puisque les attaques peuvent occasionner jusqu'à 62 % de pertes de récolte[39], sur carignan ou chardonnay en région méditerranéenne.
L'attaque a pour effet un ralentissement de la croissance et de la maturité phénolique du raisin, ainsi qu'une fragilité de la pellicule qui favorisera l'extraction des polyphénols et du potassium lors de la vinification. En faisant éclater les graines, l'oïdium favorise aussi les attaques de botrytis, maladie très préjudiciable à la qualité du vin.
Les raisins attaqués par l'oïdium ont un goût caractéristique de moisi. Le retentissement sur le goût du vin ne se fait ressentir qu'à partir d'un certain seuil. En deçà de ce seuil, la fermentation alcoolique efface les défauts.
On dit qu'une grappe est « très touchée » si au moins 50 % de ses baies sont attaquées par l'oïdium, certaines étant éclatées ou de taille réduite. Une étude sur chardonnay[39] a montré qu'à partir environ 8 % de grappes très touchées par d'oïdium, il apparaît des arômes de type soufré, herbacé, moisi, champignon, animal, accompagnés d'une diminution des arômes fruités et de confiture et d'une nette augmentation en bouche de l'intensité tannique (ou de la rugosité sur vin blanc) et de la sécheresse, de l’astringence et de l'amertume. Ces défauts sont encore corrigibles lors de la vinification. Mais au-delà de 10 % de grappes très touchées à la récolte, des défauts rédhibitoires apparaissent : des arômes de type mentholés, brûlants, métalliques et herbacés. Il est alors impossible de les corriger au cours de la vinification, sauf par des techniques de thermovinification[n 8] coûteuses.
Des analyses de la composition des vins issus de vendanges plus ou moins oïdées ont montré une augmentation du pH, des polyphénols totaux, des hydroxycinnamates et des flavonoïdes d'autant plus forte que les raisins étaient plus attaqués[40]. Les composés aromatiques indésirables sont des phénols comme l'eugénol (arôme de clou de girofle) ou la zingérone (au goût piquant du gingembre). Les composés responsables de l'odeur de champignon du raisin[41] sont l'1-octène-3-ol et le (Z)-1,5-octadiène-3-one. La fermentation alcoolique réduit ces molécules en des composés moins odorants : 3-octanone et (Z)-5-octène-3-one, ce qui pourrait expliquer en partie pourquoi la fermentation des grappes peu touchées permet d'effacer les défauts.
Protection phytosanitaire
La lutte contre l'oïdium doit être essentiellement préventive. La précocité des attaques sur feuilles conditionne la fréquence et la gravité des attaques sur grappes, avec une bonne corrélation entre fréquence de feuilles attaquées à la floraison et la sévérité des attaques sur grappes visibles à la fermeture de la grappe (A. Calonnec[30]). Plus les attaques sont précoces et fortes au moment de la floraison, plus les attaques sont sévères sur les grappes.
Les traitements précoces constituent la clé de l'efficacité de la protection contre l'oïdium, dès le stade 2-3 feuilles sur les parcelles qui connaissent les formes en drapeau et seulement au stade 10-12 feuilles (boutons floraux agglomérés à séparés). La protection doit être maintenue jusqu'à la fermeture de la grappe (période de forte sensibilité).
Pour développer une stratégie rationnelle de protection contre les risques de l'oïdium, le viticulteur doit observer régulièrement son vignoble pour détecter les symptômes et surtout les attaques précoces. Le recours aux outils d'aide à la décision (OAD) devrait lui permettre de mieux prévenir les risques. Mais suivant Agnès Calonnec[42] (INRA) « Les modèles actuellement disponibles sont loin d’être prêts. Il faut absolument faire des échantillonnages pour repérer des contaminations primaires... Ne pas oublier qu’une très grande variabilité persiste dans l’évolution dans le temps des stocks de cléistothèces, à l’origine des contaminations primaires. À l’heure actuelle, aucun modèle n’est capable d’évaluer ce stock ! »
Soufre, fongicide minéral de contact

Au milieu du XIXe siècle, à l'époque où la production vinicole s'effondrait, Henri Marès mettait au point la technique du traitement de l'oïdium par soufrage à sec. Grâce à trois poudrages annuels avec 150 kg/ha/an de soufre trituré, les récoltes retrouvèrent rapidement leur niveau antérieur. Le soufre fut ensuite le seul fongicide anti-oïdium employé pendant plus d'un siècle. Ce n'est qu'en 1978, que le premier fongicide organique à base d'IBS (inhibiteur de la biosynthèse des stérols) arrive à concurrencer le soufre.
Le soufre a un triple effet sur le champignon[14] :
- action préventive sur les conidies avant et pendant la germination
- action stoppante sur les filaments mycéliens et les suçoirs
- action éradicatrice provoquant le dessèchement des conidies et du mycélium.
Le soufre est utilisé sous formes de poudre ou sous forme mouillable. Le soufre pour poudrage a une action de choc mais son effet est de courte durée. Le soufre pour pulvérisation a une action de contact à effet préventif et sa durée d'action est plus longue. Le soufre n'agit qu'à l'endroit précis où il est en contact direct avec la plante. La pulvérisation étant toujours partielle, son action serait très insuffisante. Heureusement, le soufre est "sublimé" par la chaleur: il s'évapore et vient se condenser en une très fine couche sur toute la surface de la plante. Il suffit donc de le répandre grossièrement, pour qu'il joue son rôle dès que la température est suffisante.
Fongicides pénétrants à base d'IBS (inhibiteurs de la biosynthèse des stérols)
Les IBS pénètrent dans la plante et provoquent l'inhibition d'enzymes impliqués dans la synthèse des stérols, entrainant la perturbation du fonctionnement et de la formation de la paroi externe des filaments mycéliens.
Fongicides pénétrants
Les fongicides pénétrants utilisés sont ceux de la famille des strobilurines (Qol), les phénoxyquinoléines, les benzophénones et les quinazolinones.
Les strobilurines agissent agissent par inhibition de la chaîne respiratoire mitochondriale du champignon[14].
Le quinoxyfen, de la famille des phénoxyquinoléines a une action préventive par inhibition de la germination des spores et une très bonne résistance au lessivage.
Le métrafone de la famille des benzophénones, perturbe la pénétration de l'oïdium dans les cellules et inhibe la croissance du mycélium.
Pour maintenir l'efficacité des produits et éviter l'apparition de résistance, il est important d’alterner des produits à modes d'action différents[43].
Ces dernières années, l'emploi de fongicide à base de soufre a eu tendance à reculer devant les fongicides pénétrants et systémiques[44]. En 2010, un hectare traité avec les produits à base de soufre reçoit en moyenne 20 kg de produits contre 26 en 2006. Ce recul a bénéficié aux IBS. Voir Traitement de la vigne.
Politique de réduction de l'utilisation des pesticides
En France, chaque parcelle de vigne a reçu en 2010, en moyenne, 16 traitements phytosanitaires dont 12 de fongicides, 2 d'insecticides et 2 d'herbicides (enquête du ministère de l’Agriculture[44]). Avec des disparités régionales importantes, puisque le nombre de traitements moyens est de 21 en Midi-Pyrénées, 20 dans les Charentes et la Champagne, et seulement de 11 en Provence.
L'importance des fongicides s'explique par les risques que font courir à la vigne le mildiou et l'oïdium. Pour l'oïdium seul, la vigne reçoit en moyenne 6 traitements par an, avec un espacement entre traitements de 18 jours en Provence et Val de Loire et de 12 jours en Champagne. Les régions où les viticulteurs cherchent des rendements élevés, ont des vignes plus vigoureuses et donc plus sensibles aux maladies fongiques, comme l'illustre les régions productrices de Cognac, d'Armagnac ou de Champagne. Ainsi, pour combattre le mildiou, les vignobles avec des rendements inférieurs à 85 hl par hectare nécessitent en moyenne 6 traitements mais au-delà, 2 traitements supplémentaires sont appliqués.
La France a développé un système de production agricole fondé sur l'utilisation massive des pesticides. Quelques cultures sont de très grosses consommatrices de produits phytosanitaires (vigne, céréales à paille, maïs, colza). Ainsi, la viticulture qui occupe seulement 3 % de la surface agricole utile, utilise pourtant 20 % de la consommation totale de pesticides (Aubertot et als[45], 2005).
La prise de conscience par une partie de la population des impacts négatifs des produits phytosanitaires sur l'environnement et sur la santé humaine commence à porter ses fruits. La France avec l'Union Européenne s'est engagée dans un processus de réduction des risques liés aux pesticides dans l'agriculture. Dans le cadre du Grenelle de l'environnement (2007), le plan Ecophyto 2018 a prévu de réduire en 10 ans (de 2008 à 2018) de moitié l'usage des pesticides. Ces réductions pourraient s'obtenir en réduisant les inefficacités des exploitations intensives qui font un recours systématique aux pesticides. Selon une note du ministère de l'agriculture[46] « Ces exploitations dépensent en effet 40 % de plus de pesticides que celles de niveau N1 de l'"agriculture raisonnée" ..., pour des niveaux de productions équivalents, du moins en grandes cultures ».
La pression de l'oïdium ces dernières années (particulièrement en 2012) est tellement forte que l'application de ce plan, notamment la suppression des substances anti-oïdium, pourrait entrainer la disparition de la vigne, du raisin et de la viticulture.
Annexes
Notes
- Romanus Adolf Hedwig (1172-1806), professeur de botanique à l'université de Leipzig, poursuivit la constitution de l'herbier de son père. L'herbier a été récupéré par le Conservatoire et Jardin botaniques de Genève.
- in Ellis & Everhart, The North American Pyrenomycetes (Newfield): 92
- E. necator, L. von Schw., multo rarius in Uvis Vitis labruscae varietatibus cultis in vineis nostris. E. Hyphasma, tenuissimum albidum, floccis valde tenuibus, orbiculatum, non constringens. Sporangiolis minutissimis - raris fusco-nigris, globosis. Ubi omnino evoluta, etiam haec species destruit uvas.
- les signes sexuels opposés sont aussi appelés « MAT 1 » et « MAT 2 » pour MAting Types 1 et 2
- cléistothèce est un nom féminin ; les genres et l'étymologie des termes scientifiques sont tirés du dictionnaire de Boullard, Plantes et champignons, cf. biblio. En outre, les termes latins sont lexicalisés en français, c'est-à-dire qu'ils obéissent à l'orthographe française, le pluriel de « appressorium » est « appressoriums » et non pas « appressoria » comme en anglais
- du latin apprimere « presser contre »
- en forme de tonnelet plus ou moins haut
- le raisin foulé est chauffé à 60-80 °C pendant 20 minutes
Références
- (en) Référence Index Fungorum : Erysiphe necator (+ MycoBank)
- Uwe Braun, « Phylogeny of Erysiphe, Microsphaera, Uncinula (Erysipheae) and Cystotheca, Podosphaera, Sphaerotheca (Cystotheceae) inferred from rDNA ITS sequences – some taxonomic consequences », Schlechtendalia, vol. 4, no 0, , p. 1-33 (ISSN 2195-9889, lire en ligne)
- dossier ICV, Basf, « Un champignon de la vigne attaque la qualité des vins », In vivo qualitas, (lire en ligne)
- Uwe Braun, The Powdery Mildews (Erysiphales) of Europe, Springer,
- Marin T. Brewer, « Phylogeography and population structure of the grape powdery mildew fungus, Erysiphe necator, from diverse Vitis species », BMC Evolutionary Biology, vol. 10, no 1, , p. 268 (ISSN 1471-2148, DOI 10.1186/1471-2148-10-268, lire en ligne, consulté le )
- Kumar, J. Chaube, Singh, Mukhopadhyay, Plant diseases of international importance, t. Vol III : Diseases of Fruit Crops, Englewood Cliffs, , « Grape powdery mildew, par Pearson, Gadoury »
- Philippe Cartolaro, Laurent Deliere, Agnès Calonnec, « Initiation et développement des épidémies d'oïdium : les bases biologiques pour optimiser la protection », Coloque Mondiaviti (Bordeaux, 29-30 novembre 2006), (lire en ligne)
- (en) American Philosophical Society., American Philosophical Society, Transactions of the American Philosophical Society., vol. new ser.:v.4 (1834), Philadelphia etc., « VIII, Synopsis Fungorum in America Boreali media degentium, par Ludovici Davidis de Schweinitz, pp. 141-316 »
- Académie d'Amiens, Académie d'Amiens, Memoires de l'Academie des Sciences (Agriculture, Commerce), Belles-Lettres et des Arts d'Amiens.
- M. Casevitz, « Note sur ερυσιβη : (à propos des exemples du mot ches les Septante) », Revue de philologie de littérature et d'histoire anciennes, vol. 70, no 2, , p. 211-215 (ISSN 0035-1652, lire en ligne, consulté le )
- (en) W. G. Farlow, American Grape Mildew in Europe, Botanical Gazette, (lire en ligne)
- Pierre Viala, Les maladies de la vigne (3e édition entièrement refondue...) : par Pierre Viala,..., G. Masson (Paris), (lire en ligne)
- Jacques Barnouin, Ivan Sache et al. (préf. Marion Guillou), Les maladies émergentes : Épidémiologie chez le végétal, l'animal et l'homme, Versailles, Quæ, coll. « Synthèses », , 444 p. (ISBN 978-2-7592-0510-3, ISSN 1777-4624, lire en ligne), I. Facettes et complexité de l'émergence, chap. 2 (« Les maladies émergentes affectant les végétaux »), p. 25, accès libre.
- Alain Reynier, Manuel de viticulture : guide technique du viticulteur, Paris, Éd. Tec & doc, , 592 p. (ISBN 978-2-7430-1347-9 et 2743013478, lire en ligne)
- Jean-Louis Bernard, « Le soufre et la protection des cultures, Hier, aujourd'hui demain », séance de l’Académie d’Agriculture de France,
- Thomas Taylor, « Oidium Tuckeri - A Fungus of the Grape-Vine », The American monthly Microscopical Journal, vol. V, no 1, (lire en ligne)
- G. Couderc, « Sur les périthèces de l' Uncinula spiralis en France et l'identification de lOïdium américain de lOïdium européen », Comptes rendus hebdomadaires des séances de l'Académie des sciences, no 01, (lire en ligne)
- Ellis & Everhart, North American Pyrenomycètes, Newfield, New Jersey,
- Roger C. Pearson, « Cleistothecia, the Source of Primary Inoculum for Grape Powdery Mildew in New York », Phytopathology, vol. 77, no 11, , p. 1509 (ISSN 0031-949X, DOI 10.1094/Phyto-77-1509, lire en ligne, consulté le )
- C. Délye, « RAPD Analysis Provides Insight into the Biology and Epidemiology of Uncinula necator », Phytopathology, vol. 87, no 7, , p. 670-677 (ISSN 0031-949X, DOI 10.1094/PHYTO.1997.87.7.670, lire en ligne, consulté le )
- David M. Gadoury, « Grapevine powdery mildew (Erysiphe necator): a fascinating system for the study of the biology, ecology and epidemiology of an obligate biotroph », Molecular Plant Pathology, vol. 13, no 1, , p. 1–16 (ISSN 1364-3703, DOI 10.1111/j.1364-3703.2011.00728.x, lire en ligne)
- J. Rumbolz, « Susceptibility of grapevine buds to infection by powdery mildew Erysiphe necator », Plant Pathology, vol. 54, no 4, , p. 535–548 (ISSN 1365-3059, DOI 10.1111/j.1365-3059.2005.01212.x, lire en ligne, consulté le )
- Guillaume Garin, Modélisation du cycle de l'oïdium de la vigne dans un outil d'aide à la décision : intégration de nouveaux formalismes, Université de Nancy,
- A. Rügner, « Formation of overwintering structures of Uncinula necator and colonization of grapevine under field conditions », Plant Pathology, vol. 51, no 3, , p. 322–330 (ISSN 1365-3059, DOI 10.1046/j.1365-3059.2002.00694.x, lire en ligne)
- (en) John Webster, Roland Weber, Introduction to fungi, Cambridge, Cambridge University Press, , 841 p. (ISBN 978-0-521-01483-0 et 0-521-01483-2, lire en ligne)
- Vittorio Rossi, « Dynamics of Ascospore Maturation and Discharge in Erysiphe necator, the Causal Agent of Grape Powdery Mildew », Phytopathology, vol. 100, no 12, , p. 1321-1329 (ISSN 0031-949X, DOI 10.1094/PHYTO-05-10-0149, lire en ligne, consulté le )
- Hajjeh Miazzi, « Occurrence and distribution of two distinct genetic groups in populations of Erysiphe necator schw. in Southern Italy », JOURNAL OF PLANT PATHOLOGY, vol. 90, no 3, , p. 563-573 (ISSN 1125-4653)
- M. Bisiach Paolo Cortesi, « Cleistothecia of Uncinula necator: An Additional Source of Inoculum in Italian Vineyards », Plant Disease - PLANT DIS, vol. 81, no 8, , p. 922-926 (DOI 10.1094/PDIS.1997.81.8.922)
- F Jailloux, « Effect of weather factors on the release of ascospores of Uncinula necator, the cause of grape powdery mildew, in the Bordeaux region », Canadian Journal of Botany, vol. 77, no 7, , p. 1044-1051 (ISSN 0008-4026, DOI 10.1139/b99-118, lire en ligne, consulté le )
- Calonnec
- Josselin Montarry, « Genetic Structure and Aggressiveness of Erysiphe necator Populations during Grapevine Powdery Mildew Epidemics », Applied and Environmental Microbiology, vol. 74, no 20, , p. 6327-6332 (ISSN 0099-2240, DOI 10.1128/AEM.01200-08, lire en ligne)
- inra
- Sylvain Schnee, Facteurs de résistance à l'oïdium (Erysiphe necator Schwein.) chez la vigne (Vitis vinifera L.), Thèse, Faculté des Sciences de l'Université de Neuchâtel,
- (en) Bernard Boullard, Plantes & champignons : dictionnaire, Paris, Editions Estem, , 875 p. (ISBN 2-909455-99-8 et 9782909455990)
- (en) Matthew Allan Hayes, Identification of host genes involved in the biotrophic interaction between grapevine and powdery mildew, Thèse, University of Adelaide,
- (en) Bernadette Dubos, Maladies cryptogamiques de la vigne : champignons parasites des organes herbacés et du bois de la vigne, Bordeaux, Éd. Féret, , 207 p. (ISBN 2-902416-77-6 et 9782902416776)
- David M. Gadoury, Roger C. Pearson, « Germination of ascospres and infection of Vitis by Uncinula necator », Phytopathology, vol. 80, no 11,
- David M. Gadoury, « Ascocarp Dehiscence and Ascospore Discharge in Uncinula necator », Phytopathology, vol. 80, no 4, , p. 393 (ISSN 0031-949X, DOI 10.1094/Phyto-80-393, lire en ligne, consulté le )
- Jacques Rousseau, Daniel Blanc, Vincent Jacus, « Oïdium de la vigne, vers une protection mieux raisonnée », Phytoma, no 668, 2013 nov. (lire en ligne)
- Belinda E. Stummer, « Effects of powdery mildew on the sensory properties and composition of Chardonnay juice and wine when grape sugar ripeness is standardised », Australian Journal of Grape and Wine Research, vol. 11, no 1, , p. 66–76 (ISSN 1755-0238, DOI 10.1111/j.1755-0238.2005.tb00280.x, lire en ligne, consulté le )
- Philippe Darriet, « Impact odorants contributing to the fungus type aroma from grape berries contaminated by powdery mildew (Uncinula necator); incidence of enzymatic activities of the yeast Saccharomyces cerevisiae », Journal of agricultural and food chemistry, vol. 50, no 11, , p. 3277–3282 (ISSN 0021-8561, PMID 12009998)
- bayer
- Note technique commune Maladies de la vigne 2013
- Agreste, « Fortes disparités de protection contre l'oïdium et le mildiou », Primeur, vol. 289, (agreste.agriculture.gouv.fr/IMG/pdf/primeur289.pdf)
- Aubertot J.N., J.M. Barbier, A. Carpentier, J.J. Gril, L. Guichard, P. Lucas, S. Savary, I. Savini, M. Voltz (éditeurs) Expertise scientifique collective, « Pesticides, agriculture et environnement, Réduire l'utilisation des pesticides et en limiter les impacts environnementaux », rapport INRA et Cemagref, (lire en ligne)
- ean-Pierre Butault, Nathalie Delame, Florence Jacquet, Guillaume Zardet, « L'utilisation des pesticides en France : état des lieux et perspectives de réduction », NESE notes et études socio-économiques, no 35, (agriculture.gouv.fr/IMG/pdf/V3TAPButault7a26.pdf)
Articles connexes
- Portail de la mycologie
- Portail de la vigne et du vin
- Portail de la protection des cultures