Zirconocène
Le zirconocène est un composé organozirconique hypothétique de formule chimique (η5-C5H5)2Zr apparenté aux métallocènes qui n'a été observé qu'en coordination avec des ligands suffisamment stabilisateurs. Identifier de tels ligands est précisément un enjeu important de la recherche dans ce domaine[2] car les complexes de zirconocène jouent un rôle important comme catalyseurs en synthèse organique, voire inorganique. Ces catalyseurs permettent par exemple d'atteindre des modes d'insertion et de couplage croisé (en) C–C novateurs conduisant à une grande variété de composés organiques fonctionnalisés, comme des hétérométallacycles (en) jusqu'alors inaccessibles[3]. En utilisant un réactif de Rosenthal, il est ainsi possible d'obtenir, avec un rendement élevé, des composés macrocyliques de structure prévisible, ouvrant la voie à de nombreuses applications telles qu'en réalisation de capteurs chimiques, en chimie hôte-invité, en catalyse ou plus généralement en science des matériaux[4].
| Zirconocène | |
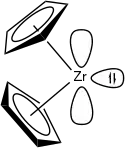
| |
| Structure du zirconocène | |
| Identification | |
|---|---|
| Nom UICPA | zirconocène |
| Synonymes |
bis(η5-cyclopentadiényl)zirconium |
| No CAS | |
| PubChem | 498771 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H10Zr |
| Masse molaire[1] | 221,41 ± 0,011 g/mol C 54,25 %, H 4,55 %, Zr 41,2 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Structures et modes de synthèse
Contrairement aux métallocènes stricto sensu, qui sont des composés sandwich dans lesquels les deux ligands cyclopentadiényle sont parallèles, comme les ferrocènes, la géométrie des zirconocènes et des autres métallocènes du groupe 4 est coudée, de sorte que les ligands cyclopentadiényle ne sont pas parallèles entre eux. En l'absence de ligands stabilisateurs, le fragment zirconocène Cp2ZrII est instable et tend à dimériser en formant un ligand pontant fulvalène :
 Zirconocène stabilisé.
Zirconocène stabilisé.
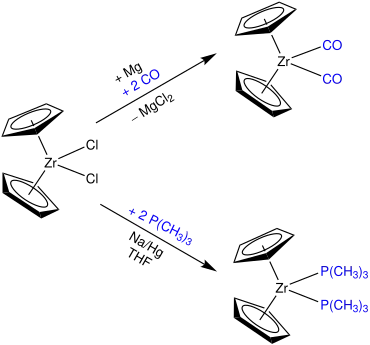
L'instabilité du zirconocène provient de ce qu'il porte 14 électrons dans sa couche de valence, avec un doublet non liant et deux orbitales de valence vacantes, d'où une réactivité généralement comparée à celle des carbènes[2]. Une voie possible pour le stabiliser consiste à utiliser des ligands π-accepteurs tels que le monoxyde de carbone ou la triméthylphosphine P(CH3)3[5], par exemple à partir de dichlorure de zirconocène Cp2ZrCl2 :
Une autre approche consiste à traiter le dichlorure de zirconocène Cp2ZrCl2 dans le tétrahydrofurane (THF) avec deux équivalents de n-butyllithium à −78 °C pour obtenir le Cp2Zr(η2-butène), qui présente les mésomères A et B, réactif développé par Ei-ichi Negishi[5] :

On peut obtenir un meilleur rendement qu'avec le n-BuLi en utilisant le bis(triméthylsilyl)acétylène (CH3)3SiC≡CSi(CH3)3 pour donner un réactif de Rosenthal[6] :
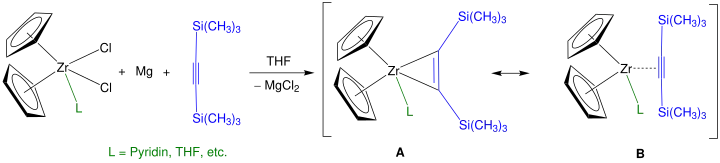
Cette réaction fait souvent intervenir des ligands cyclopentadiényle diversement substitués ainsi que des ligands supplémentaires (notés en vert sur le schéma ci-dessus) tels que la pyridine et le THF afin de contrôler plus précisément les réactions avec les complexes métallocènes. Il est également possible d'utiliser du titane pour obtenir un dérivé de titanocène analogue[7].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Uwe Rosenthal et Vladimir V. Burlakov, « Organometallic Chemistry of Titanocene and Zirconocene Complexes with Bis(trimethylsilyl)acetylene as the Basis for Applications in Organic Synthesis », Titanium and Zirconium in Organic Synthesis, , p. 355-389 (DOI 10.1002/3527600671.ch10, lire en ligne)
- (en) Uwe Rosenthal, « Reactions of Group 4 Metallocene Bis(trimethylsilyl)acetylene Complexes with Nitriles and Isonitriles », Angewandte Chemie International Edition, vol. 57, no 45, , p. 14718-14735 (DOI 10.1002/anie.201805157, lire en ligne)
- (en) Viktoria H. Gessner, John F. Tannaci, Adam D. Miller et T. Don Tilley, « Assembly of Macrocycles by Zirconocene-Mediated, Reversible Carbon−Carbon Bond Formation », Accounts of Chemical Research, vol. 44, no 6, , p. 435-446 (PMID 21473633, DOI 10.1021/ar100148g, lire en ligne)
- (en) Ei-ichi Negishi et Jean-Luc Montchamp, « Zirconocenes », Metallocenes: Synthesis Reactivity Applications, (DOI 10.1002/9783527619542.ch5, lire en ligne)
- (en) Jonathan R. Nitschke, Stefan Zürcher et T. Don Tilley, « New Zirconocene-Coupling Route to Large, Functionalized Macrocycles », Journal of the American Chemical Society, vol. 122, no 42, , p. 10345-10352 (DOI 10.1021/ja0020310, lire en ligne)
- (en) Uwe Rosenthal, Vladimir V. Burlakov, Perdita Arndt, Wolfgang Baumann et Anke Spannenberg, « The Titanocene Complex of Bis(trimethylsilyl)acetylene: Synthesis, Structure, and Chemistry », Organometallics, vol. 22, no 5, , p. 884-900 (DOI 10.1021/om0208570, lire en ligne)
- Portail de la chimie