أوكسيداز الزانثين
أوكسيديز الزانثين أو أكسيداز الزانثين (Xanthine oxidase) هو شكل من أشكال الزانثين المؤكسدة المختزلة، وهو نوع من الإنزيم الذي يولد أنواع الاكسجين التفاعلية .[2]> هذه الانزيمات تحفيز أكسدة من هيبوزانتين إلى الزانثين ويمكن أن تزيد من تحفيز أكسدة الزانثين إلى حمض اليوريك . هذه الانزيمات تلعب دورا هاما في الانتقاض من البيورينات في بعض الأنواع، بما في ذلك البشر.[3][4]
| xanthine oxidase/dehydrogenase | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Crystallographic structure (monomer) of bovine xanthine oxidase.[1] The bounded FAD (red), FeS-cluster (orange), the molybdopterin cofactor with molybdenum (yellow) and salicylate (blue) are indicated. | |||||||||||
| أرقام التعريف | |||||||||||
| رقم التصنيف الإنزيمي | 1.17.3.2 | ||||||||||
| رقم التسجيل CAS | 9002-17-9 | ||||||||||
| قواعد البيانات | |||||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||||
| إكسباسي | راجع NiceZyme | ||||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||||
| ميتاسيك | المسار الأيضي | ||||||||||
| بريام | ملف التعريف | ||||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||||
| الأونتولوجيا الجينية | AmiGO / EGO | ||||||||||
| |||||||||||
| xanthine oxidase/dehydrogenase | |
|---|---|
 | |
| المعرفات | |
| الرمز | XDH |
| أنتريه | 7498 |
| HUGO | 12805 |
| أوميم | 607633 |
| بنك بيانات البروتين | 1FIQ |
| RefSeq | NM_000379 |
| يونيبروت | P47989 |
| بيانات أخرى | |
| رقم التصنيف الإنزيمي | 1.17.3.2 |
| الموقع الكروموسومي | Chr. 2 p23.1 |
يتم تعريف أوكسيديز الزانثين كنشاط انزيم (EC 1.17.3.2). 5] نفس البروتين،[5] xanthine dehydrogenase activity (EC 1.17.1.4).[6] والتي في البشر لديه HGNC المعتمدة الجين رمز XDH، يمكن أن يكون أيضا نازعة الزانثين النشاط EC 1.17.1.4). معظم من البروتين في الكبد موجود في نموذج مع النشاط نازعة الزانثين، ولكن يمكن تحويلها إلى أوكسيديز الزانثين عن طريق عكس عملية أكسدة سلفهيدريل أو لا رجعة فيه لتعديل البروتين.
رد الفعل
يتم تحفيز التفاعلات الكيميائية التالية أوكسيديز الزانثين:
هيبوزانتين + H 2 O + O 2 \ rightleftharpoons الزانثين + H 2 O 2 الزانثين + H 2 O + O 2 \ rightleftharpoons حمض اليوريك + H 2 O 2 يمكن أوكسيديز الزانثين تعمل أيضا على بعض البيورينات الأخرى، pterins، والألدهيدات. على سبيل المثال، فإنه يحول بكفاءة 1-بالميثيل (أ المستقلب من الكافيين ) لحمض 1-methyluric، ولكن لديها نشاط يذكر على 3 بالميثيل. تحت بعض الظروف يمكن أن تنتج الفائق أيون RH + H 2 O + O 2 2 \ rightleftharpoons ROH + 2 O 2 - + 2 H + [6]
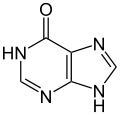 هيبوزانتين (one oxygen atom)
هيبوزانتين (one oxygen atom) زانثين (two oxygens)
زانثين (two oxygens) حمض البول (three oxygens)
حمض البول (three oxygens)
المراجع
- ببب: 1FIQ; Enroth C, Eger BT, Okamoto K, Nishino T, Nishino T, Pai EF (سبتمبر 2000)، "Crystal structures of bovine milk xanthine dehydrogenase and xanthine oxidase: structure-based mechanism of conversion"، Proc. Natl. Acad. Sci. U.S.A.، 97 (20): 10723–8، doi:10.1073/pnas.97.20.10723، PMC 27090، PMID 11005854، مؤرشف من الأصل في 13 ديسمبر 2019.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ardan T, Kovaceva J, Cejková J (2004)، "Comparative histochemical and immunohistochemical study on xanthine oxidoreductase/xanthine oxidase in mammalian corneal epithelium"، Acta Histochem، 106 (1): 69–75، doi:10.1016/j.acthis.2003.08.001، PMID 15032331.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Hille R (2005)، "Molybdenum-containing hydroxylases"، Arch. Biochem. Biophys.، 433 (1): 107–16، doi:10.1016/j.abb.2004.08.012، PMID 15581570.
- Harrison R (2002)، "Structure and function of xanthine oxidoreductase: where are we now?"، Free Radic. Biol. Med.، 33 (6): 774–97، doi:10.1016/S0891-5849(02)00956-5، PMID 12208366.
- "KEGG record for EC 1.17.3.2"، مؤرشف من الأصل في 08 يوليو 2018.
- "KEGG record for EC 1.17.1.4"، مؤرشف من الأصل في 08 يوليو 2018.
وصلات خارجية
- Xanthine+Oxidase في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي